耐盐菊芋对胁迫的生长及生理响应*
2018-08-08陈小倩陈建华吴玉环
刘 鹏, 周 蜜, 陈小倩, 郦 枫, 陈建华,方 芳, 吴玉环, 章 艺
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.杭州师范大学 生命与环境科学学院,浙江 杭州 310036;3.浙江旅游职业学院,浙江 杭州 311231)
菊芋(HelianthustuberousL.)为菊科多年生草本,是向日葵属的一种植物.菊芋本身对生态环境条件要求并不严苛,因而世界各地均有其分布和栽培[1-2].在一些盐碱土壤的生物修复上,菊芋的应用已经初具规模,国内外对菊芋的抗逆性也正在进行深入钻研.地下块茎是菊芋主要的价值来源,其主要成分为属于多聚果糖的菊粉,菊粉可在菊粉酶的水解作用下成为果糖[3],此外,菊芋通过微生物发酵能够生产乙醇和油脂,所以又有“能源植物之称”[4-5].菊粉这种有机物也可以作为原料经过多种反应制备成氢能与多种化学品[6],胡素琴等[7]就菊芋开发利用的前景进行了探索,结果表明,其地上部分与扎根于地下的块茎均有很高的实用价值.
高氯酸盐在自然界中以极微量的形态存在,而由于重工业及航天业的发展,人为造成高氯酸钠(NaClO4)的污染比重日趋增大.通常情况下,高氯酸盐极易溶解于水,在土壤中会随水分和无机盐一起被摄入植物体内,加之其具有稳定的化学特性,一般在生物体内很难将其降解.陈桂葵等[8]的研究表明,氯酸盐是高氯酸盐的中间代谢产物,其与锰毒复合污染效应协同,会使得水稻(OryzasativaL.)铁锰营养严重失调,从而导致“烧苗”症状加重.与此同时,氯酸盐对龙眼(DimocarpuslonganLour.)具有胁迫效应,对菌根有严重的毒害效应[9].之前所探索的植物抗盐类胁迫,大多以加入单盐氯化钠(NaCl)或中性盐模拟胁迫条件来进行.近年来有学者[10]进行了关于水稻等其他作物的高氯酸盐胁迫实验,结果表明,植物根系仍然是毒害效应最易识别的植物体部位.除此之外,各类抗氧化酶的活性变化能够相对准确地反映出这套体系应对逆境时的运作情况,植物体各器官生物量及糖分含量的变化也是判断植物抗逆性强弱的重要根据.目前在我国南方地区,对于菊芋在酸铝及盐碱环境下的研究,已经进行了大量的工作并取得了较好的成效,然而,有关菊芋在高氯酸钠污染环境的生长目前仍未见相关报道.本文旨在探究菊芋在高氯酸胁迫下的根系特性、光合特点及抗氧化酶系统等变化情况,有助于完善高氯酸钠对不同植物体的胁迫效应方面的探讨,同时寻找较高浓度高氯酸盐环境下的缓解途径,并为完善菊芋在不同胁迫环境下的种植管理提供理论支撑.
1 材料与方法
1.1 试验材料及处理
本实验前期以多个菊芋品种为材料,用NaCl进行胁迫实验,筛选出徐州、潍坊、南京3个不同产地耐盐较好的菊芋品种.选取具有发芽能力的菊芋块茎萌发,苗龄20 d后从3个产地中各自选取高度一致的材料各21盆(共63盆),每种随机分成7组(共21组),每组3盆(3次重复),每盆留苗1株,施加含不同浓度NaClO4和NaCl进行胁迫处理,NaClO4浓度为50,100,150 mmol/L,NaCl浓度与之相同,对照组加1/2 Hoagland营养液,20 d后测定各项指标.实验所用材料、浓度梯度皆由前期预实验所得.
1.2 生物量、叶绿素荧光特性和根系活力的测定
1)测定生物量:根长、株高与鲜重.
2)测定叶绿素荧光特性:叶绿素仪(SPAD-502PLUS)测定叶绿素的含量.调制叶绿素荧光仪(PAM-10,Walz)测定叶绿素荧光参数,方法参照文献[11].
3)测定根系活力:称取洗净鲜根0.3 g,放置于试管中,加入浓度为0.4% TTC 5 ml和磷酸(H3PO4)缓冲液(pH 7.5)5 mL,恒温37 ℃下反应3 h,注入2 mL浓度为2 mol/L的硫酸(H2SO4)终止反应;将根取出,擦干,并将3 mL乙酸乙酯(CH3COOC2H5)和少量石英砂于研钵中研磨,溶解后倒入10 mL容量瓶中,加入乙酸乙酯定容、摇匀、静置至完全沉淀,将滤液置于485 nm处比色,记录其光密度,对照查出标准曲线的转铁蛋白(TRF)含量.TRF可以代表TTC还原量,即能表示脱氢酶活性,因此,TRF可作为根系活力的指标.
1.3 MDA含量及抗氧化酶活性的测定[12]
丙二醛(MDA)含量采用硫代巴比妥酸法进行测定;过氧化物酶(POD)活性采用性愈创木酚法进行测定;超氧化物岐化酶(SOD)活性采用NBT光化还原法进行测定;过氧化氢酶(CAT)活性采用紫外吸收法进行测定;叶片脯氨酸(Pro)含量采用茚三酮试剂显色法测定.
1.4 数据处理
采用灰色关联度分析法分析3个耐盐菊芋品种(徐州、潍坊、南京)不同生理指标在不同胁迫下的相关性.数据分析:用SPSS 22软件分析相关性及显著性,用Origin 9及Execl 2010绘制图表.
2 结果分析

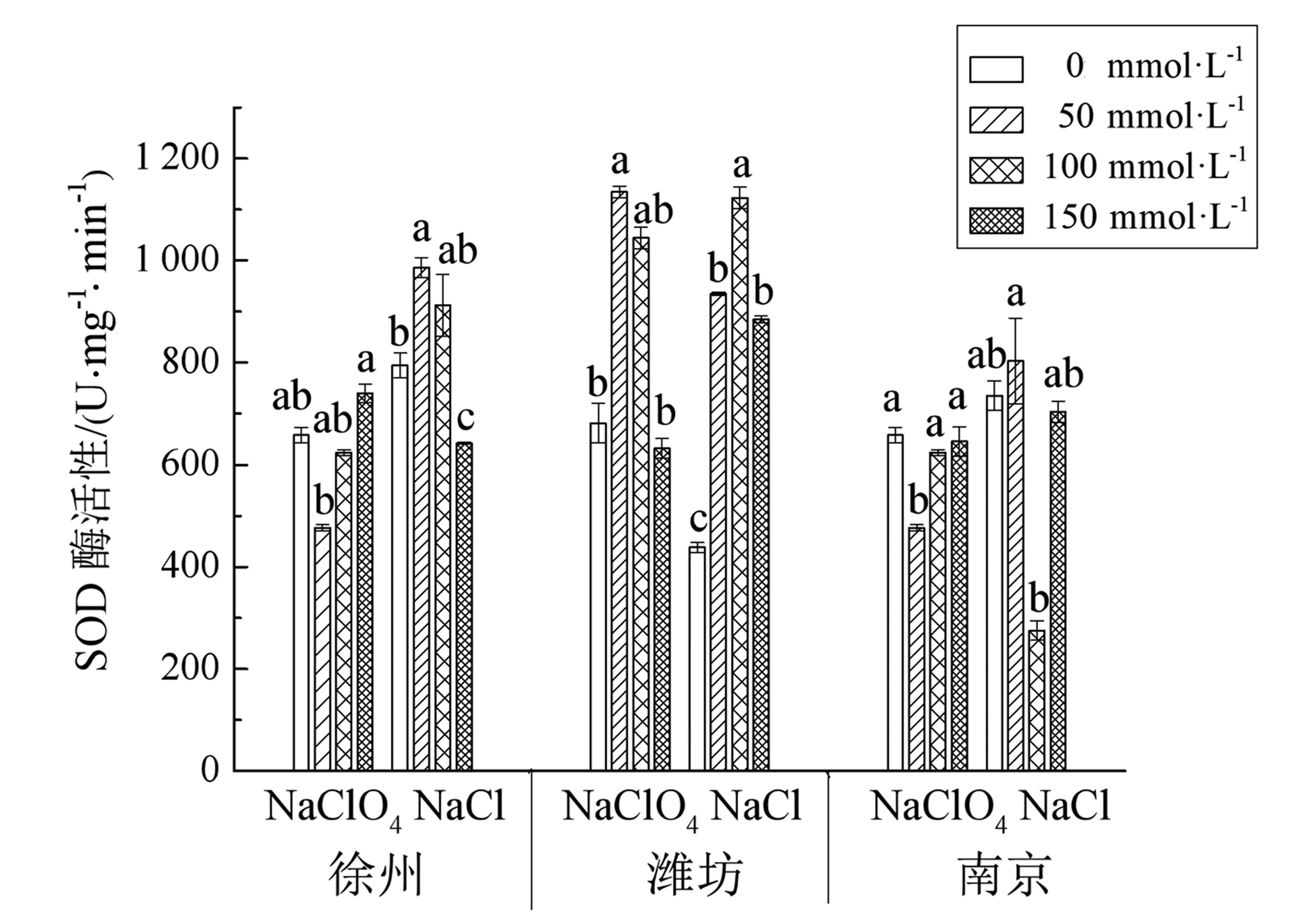
图1 NaClO4和NaCl对3个菊芋品种植株SOD酶活性影响 图2 NaClO4和NaCl对3个菊芋品种植株POD酶活性影响

图3 NaClO4和NaCl对3个菊芋品种植株CAT酶活性影响 图4 NaClO4和NaCl对3个菊芋品种植株根系活力影响
从图4可以看出,就菊芋根系活力的影响性来说,NaClO4较NaCl的作用力更加显著.具体表现在当NaClO4处理浓度为0~50 mmol/L时,徐州、南京菊芋根系活力随浓度增大而显著上升,且高于等浓度下NaCl处理组;在50 mmol/L达到最大值,分别为175.42,168.65 μg/g,明显高于对照和NaCl处理组.但随着盐胁迫加重,后呈现下降趋势.而潍坊产地菊芋在NaClO4浓度为100 mmol/L处理时达到最大值,但上升趋势较缓,在150 mmol/L浓度处理时与其他两地的菊芋相似,出现显著的下降,降幅为3个品种中最高,达到52.3%.3个品种的根系活力最低水平,均出现在高浓度NaClO4处理条件下,分别为对照的90.2%,78.4%和52.25%.

图5 NaClO4和NaCl对3个菊芋品种 叶片Pro含量影响
叶片Pro是菊芋抗逆性的重要指标之一.NaClO4和NaCl处理后的菊芋根系Pro含量结果如图5显示,不同浓度的NaCl处理后Pro含量明显增加,但处理之间的差异不显著.而NaClO4处理各组呈现的变化不尽相同,均相比对照组有较明显的上升趋势,其中数值反映最明显的是南京菊芋,高、中、低3个浓度处理的Pro含量分别是对照的1.62,1.41,1.37倍.随胁迫浓度增大,当NaClO4和NaCl的浓度都达到150 mmol/L时,南京菊芋在2种胁迫间的差异最显著,特别是在NaCl处理浓度时叶片Pro含量较低,NaClO4处理浓度是其1.51倍.在低浓度胁迫处理下,各品种菊芋间的差异不显著,不能明显比较出根系抗逆,当在浓度为150 mmol/L时,则各组出现了明显的波动,在不同条件下测定到3个菊芋品种均显著高于对照.在较高浓度NaClO4处理下,各品种间比较明显看到了根系对逆境的敏感性差异为南京菊芋>徐州菊芋>潍坊菊芋.
随着NaClO4和NaCl浓度的增高,菊芋幼苗的可溶性糖含量呈有规律变化(见图6).在NaCl处理下,徐州和南京2个品种均出现先升后降再升的变化趋势,但最大值都低于同浓度的NaClO4处理组,且这2个品种高浓度NaClO4处理下均有极显著上升,分别上升了12.25%和22.25%,潍坊菊芋则不明显.在处理浓度为50 mmol/L时,3个产地菊芋的可溶性糖含量差异不显著;当处理浓度增至100 mmol/L时,南京菊芋同比增加了23.01%,而徐州及潍坊同比分别增加了27.17%,19.45%;在150 mmol/L时具有显著差异,2种盐胁迫处理下,南京和潍坊菊芋的可溶性糖含量相近,分别较对照增加了31.64%和29.43%,二者NaClO4胁迫的可溶性糖含量较NaCl 胁迫处理高了7.3%和6.9%.
MDA的含量在一定程度上可以反映出植物细胞膜系统受到损伤的程度大小.从图7也可看出,在NaClO4和NaCl处理下,南京菊芋MDA的浓度剂量效应十分明显且相似,都呈现出先缓慢波动后迅速升高的趋势,且在150 mmol/L浓度下达到最大,NaClO4处理组是NaCl处理组的1.5倍.虽然徐州菊芋和潍坊菊芋的剂量效应没有如此明显,但对同一品种内不同浓度梯度数据观察后仍可发现,徐州菊芋在低、中、高浓度的NaClO4下与对照组相比分别是其1.24,1.18和2.13倍,而潍坊为1.46,2.12,2.63倍,南京菊芋则为1.46,2.44和4.27倍.此外,由图7还可以发现,尽管NaClO4和NaCl处理之间有一定的差异,但均能从不同程度来提升叶片MDA的含量,只是较NaCl而言,NaClO4的胁迫会使得菊芋幼苗叶片细胞膜结构的损害更加严重.
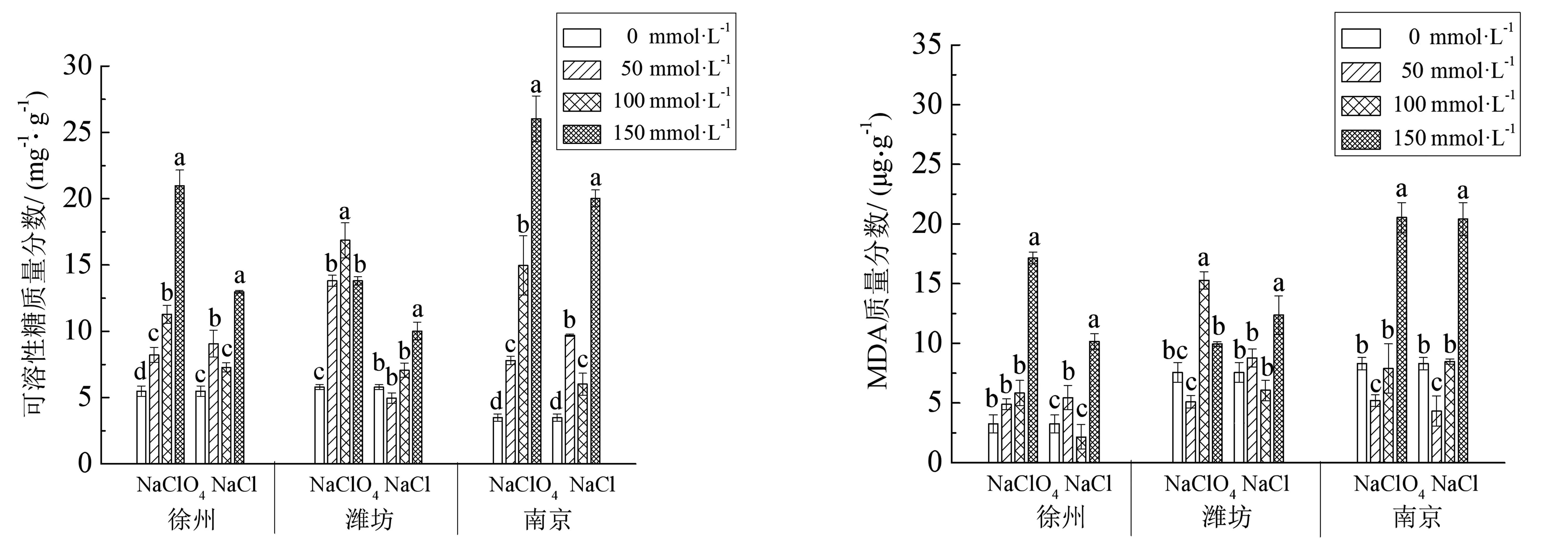
图6 NaClO4和NaCl对3个菊芋品种植株可溶性糖含量影响 图 7 NaClO4和NaCl对3个菊芋品种植株MDA含量的影响

图8 NaClO4和NaCl对3个菊芋品种植株叶绿素含量的影响

3 讨 论


表1 NaClO4和NaCl对3个菊芋品种各荧光参数的影响
注:表内数字后不同小字母表示不同处理差异(P<0.05).


