利福喷丁联合氟康唑对耐药白念珠菌细胞周期的影响
2018-08-08王玉连袁公陈雅楠曹永兵吴建华
王玉连 袁公 陈雅楠 曹永兵 吴建华
(1.第二军医大学附属长海医院皮肤科,上海 200433;2.第二军医大学药学院新药研究中心,上海 200433)
近年来,随着广谱抗生素的不合理应用、激素的滥用、肿瘤的化学治疗及器官移植后免疫抑制剂的大量应用,导致真菌感染呈上升趋势,其中白念珠菌导致的真菌感染最常见 (36%)[1]。氟康唑因其口服吸收效果好,生物利用度高,副作用小,在临
床上广泛使用。但由于其长期过度使用,目前白念珠菌对氟康唑的耐药率逐渐增加,导致临床治疗真菌感染失败。
利福喷丁为利福霉素类抗生素,是治疗结核病的一线用药,抗结核杆菌作用比利福平强2~10倍,且同等剂量下对患者胃肠道刺激及肝功能损伤均小于利福平[2]。本课题组前期研究发现利福喷丁对氟康唑抗耐药白念珠菌有增效作用[3],为进一步研究其增效作用机制,本实验通过流式细胞仪检测不同用药组细胞内DNA含量变化,观察利福喷丁、氟康唑单用及联合用药对耐药白念珠菌细胞周期的影响。
1 材料和方法
1.1 实验材料
主要仪器 5417R高速冷冻离心机 (Eppendorf FACSCalibur);流式细胞仪 (美国BD公司)。
菌株 氟康唑耐药白念珠菌100临床分离株,由长海医院真菌室提供,海军军医大学药学院新药研究中心保存,经形态学及生化学鉴定,氟康唑MIC80≥256 μg/mL,菌株实验前经沙氏培养基 (SDA)划板活化,30℃培养24~48 h,以保证受试真菌的活力与纯度,并于4℃保存备用。
药物与试剂 利福喷丁 (美国melone公司,批号S0118A),将利福喷丁用二甲基亚砜 (DMSO,Sigma公司)溶解为20 mg/mL,-20℃避光储存备用;氟康唑注射液 (大扶康DIFLUCAN,辉瑞制药有限公司,批号A075102,浓度2 mg/mL),4℃储存。碘化丙啶 (PI,Sigma产品);RNAse (Sigma分装) ;磷酸盐缓冲液 (Phosphate Buffered Saline,PBS):氯化钠 (NaCl)8 g,氯化钾 (KCl)0.2 g,磷酸氢二钠 (Na2HPO4)0.133 g,磷酸二氢钾 (KH2PO4)0.06 g,碳酸氢钠 (NaHCO3)0.35 g,调整pH值为7.2,定容至1 000 mL,然后高压蒸汽灭菌,置于4℃冰箱保存。
培养基 SDA培养基:蛋白胨10 g,葡萄糖40 g,琼脂18 g,加三蒸水900 mL溶解,加入2 mg/mL氯霉素水溶液50 mL,调整pH值为7.0±0.1 (25℃),定容至1 000 mL,高压灭菌,4℃保存。RPMI 1640培养液:RPMI 1640粉末10 g,NaHCO32.0 g,三氮吗啡啉丙磺酸钠 (MOPS,Sigma)34.5 g,加三蒸水900 mL溶解,1 moL/L NaOH溶液调pH值为7.0±0.1 (25℃),定容至1 000 mL,0.22 μm微孔滤膜过滤除菌,分装后于4℃保存。
1.2 方法
含药RPMI 1640培养液的配制 利福喷丁:首先将利福喷丁用二甲基亚砜溶解为20 mg/mL药物原液,然后用RPMI 1640培养液将上述药物原液稀释至利福喷丁浓度为250 μg/mL (2倍工作浓度)。氟康唑:将浓度为2 mg/mL氟康唑注射液用RPMI 1640培养液稀释至氟康唑浓度8 μg/mL (2倍工作浓度)。利福喷丁+氟康唑联:取一定量的RPMI 1640培养液,分别加入20 mg/mL利福喷丁原液和2 mg/mL氟康唑注射液,配制成利福喷丁/氟康唑浓度为250/8 μg/mL (2倍工作浓度)。
白念珠菌的复苏和菌悬液的配制 用接种环挑取SDA培养基上的单克隆菌落,接种到1 mL YEPD培养液中,于30℃,200 r/min振荡培养,活化24 h,使真菌处于指数生长期后期。取菌液10 μL再次接种到YEPD培养液1 mL中活化16 h,经3 000×g离心5 min,去上清液,取1 mL RPMI 1640培养液重悬,然后用血球计数板计数,并用RPMI 1640培养液调整菌液浓为 (3~5)×106cell/mL (2倍工作浓度)。分别取配制好的药物培养液500 μL加入新鲜配制的菌悬液500 μL于玻璃试管中,使利福喷丁的终浓度为125 μg/mL,氟康唑终浓度为4 μg/mL、合药组 (利福喷丁/氟康唑)终浓度为125/4 μg/mL,同时取RPMI 1640培养液500 μL加入菌悬液500 μL作为生长对照组。将各组样本放入30℃,200 r/min恒温振荡箱避光条件下分别培养24 h。每组平行做3个样本。
固定、DNA染色、流式细胞仪检测 将培养12 h的菌悬液移至1.5 mL的EP管中,5 000×g离心5 min,去上清液,加PBS重悬洗涤2次,加入预冷的70%无水乙醇放置于4℃冰箱,72 h后取出,加PBS洗涤,离心,用PBS重悬,计数,调整细胞数为1×106左右,取上述菌悬液400 μL,加入20 μL的RNAse (10 mg/mL),使其工作浓度为500 μg/mL,充分混匀后于37℃水浴1 h,除去RNA,然后各组样品中加入20 μL PI溶液 (1 mg/mL)染色,使其工作浓度为50 μg/mL,常温避光条件下静置30 min后,将各样品分别移入进样试管中, 每个样品获取2 000个细胞,FL2检测通道,激发光波长为488 nm,检测光为560~580 nm,对样品进行单参数DNA含量分析。
1.3 统计学处理
2 结 果
本实验通过流式细胞术检测药物作用12 h对耐氟康唑白念珠菌100细胞周期中各期DNA含量,探索利福喷丁、氟康唑单用及联合用药对耐药白念珠菌100细胞周期的影响。
不同细胞周期DNA含量百分比统计结果显示 (见图1~2):空白对照组、利福喷丁组、氟康唑组及合药组在G0/G1期细胞计数百分比分别为:(76.41±1.52)%、(75.48±1.41)%、(72.36±1.01)%、(8.11±0.22)%,S期细胞计数百分比分别为:(5.46±0.73)%、(8.46±0.23)%、(6.86±0.56)%、(12.52±0.54)%, G2/M期细胞计数百分比分别为:(18.14±1.11)%、(16.06±1.37)%、(20.78±1.48)%、(79.37±0.52)%。G0/G1期:生长对照组、利福喷丁组及氟康唑组两两比较,其组间DNA含量均无明显差异 (P>0.05);联合用药组DNA含量较低,与生长对照组及单药组相比,均有显著性差异 (P<0.01)。S期:与生长对照组相比,氟康唑组DNA含量无差异 (P=0.224),利福喷丁组 (P=0.043)、联合用药组 (P=0.01)DNA含量均有显著性差异;利福喷丁、氟康唑单药组与联合用药组两两比较显示,利福喷丁组与氟康唑组之间DNA含量无差异 (P>0.086),单药组与联合用药组DNA含量均有显著性差异 (P<0.01)。G2/M期:生长对照组、利福喷丁组及氟康唑组两两比较,其组间DNA含量均无明显差异 (P>0.05);联合用药组DNA含量明显增加,与生长对照组及单药组相比,均有显著性差异 (P<0.01)。这说明联合用药组细胞周期阻滞在G2/M期,即联合用药可抑制白念珠菌的正常分裂增殖。
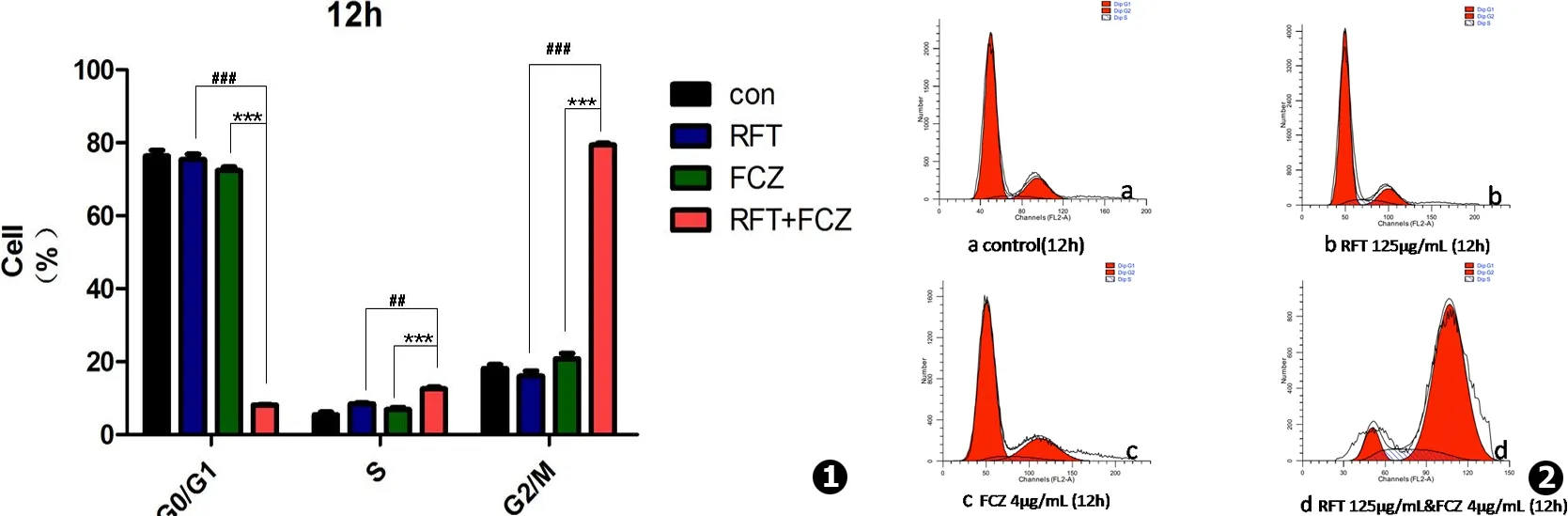
图1 利福喷丁、氟康唑单用及两药合用12 h后耐药白念珠菌各期细胞百分比 图2 利福喷丁、氟康唑单用及两药合用12 h后耐药白念珠菌胞内DNA含量变化
Fig.1 Histogram indicating the percentages of FLC-resistanceCandidaalbicanscells treated with different drugs for 12 h in cycle progress. Results are shown as mean±SD;***P<0.001 vs FCZ group;##P<0.01 vs RFT group,###P<0.001 vs RFT group Fig.2 DNA contents of FLC-resistanceCandidaalbicanscells treated with Fluconazole or Rifapentine alone and combination for 12 h
3 讨 论
流式细胞术 (Flow Cytometry,FCM)是一项发展迅速的新型生物医学分析技术,因其检测速度快、精确度高、灵敏度高等优势被广泛应用于细胞内DNA含量的检测。流式细胞仪检测细胞内DNA含量的主要原理是用化学定量方式对细胞内DNA进行染色,DNA结合荧光染料后,在流式细胞仪内受激光激发而发出不同的荧光束,根据荧光强度区分细胞周期中各期DNA含量,可将检测样本细胞分为二倍体的G0/G1期,二倍体与四倍体之间的S期,四倍体的G2/M期。
细胞周期指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞结束所经历的过程。白念珠菌为真核细胞生物,其细胞周期分为G0期 (此期细胞处于停止分裂状态,具有潜在分裂能力,细胞内是二倍体DNA)、G1期 (细胞有丝分裂完成到DNA复制之前的时期,又称合成前期,细胞内是二倍体DNA)、S期 (DNA的合成期,是二倍体DNA到四倍体DNA的过程)、G2期 (DNA合成终止,为有丝分裂的准备期,此时细胞内含四倍体DNA)、M期 (细胞的有丝分裂期,此时细胞内为四倍体DNA)[4]。
本课题组前期药敏试验结果显示:对多株耐药白念珠菌临床分离株,利福喷丁单用无抗菌活性,联合用药后利福喷丁的MIC80值由单用时的>1 024 μg/mL,下降至32~64 μg/mL,氟康唑的MIC80值由单用时的>64 μg/mL,下降至1~8 μg/mL,FICI均<0.5,两药的相互作用为协同作用[3]。本实验通过流式细胞仪检测利福喷丁、氟康唑单用及联合用药细胞内DNA含量变化,观察其对耐药白念珠菌细胞周期的影响。结果显示,利福喷丁、氟康唑单药组与对照组相比无显著差异,联合用药组G0/G1期DNA含量减少 (P<0.01),G2/M期DNA含量显著增加 (P<0.01)。氟康唑主要通过抑制白念珠菌麦角甾醇的合成,进而影响细胞膜的完整性发挥抑菌效应,因此其抗真菌机制与细胞周期无明显关系。利福喷丁抗细菌作用机制主要是通过竞争性结合依赖DNA的RNA多聚酶β亚单位,阻碍细菌mRNA的合成,进而影响DNA及蛋白质合成,最终致细菌死亡[5]。
细胞的正常分裂增殖是一个极其复杂又精准过程,真核细胞能够使细胞周期正确地开启和结束,依赖于细胞内周期调控系统[6]。当细胞经药物作用后,可发生DNA损伤,细胞会启动细胞周期自查及修复,若细胞损伤被及时修复,则细胞周期继续进入下一个阶段。如果细胞损伤持续存在或损伤严重,无法被修复,则细胞周期将不能从一个阶段进入下一个阶段,这种现象称为细胞周期阻滞[7-8]。G2/M期为细胞增长及有丝分裂期,在此期间,DNA合成停止,主要为RNA及蛋白质的合成,进而完成分裂增殖。本实验结果提示联合用药组G2/M期DNA含量均显著增加,这表明联合用药后大量细胞在G2/M期堆积,导致细胞无法进入下一个细胞周期。由此推测,由于利福喷丁分子量较大,无法直接透过真菌细胞壁或细胞膜直接对真菌造成损伤,与氟康唑合用时,可通过受损的细胞膜进入细胞内,发挥其协同抗菌作用。利福喷丁对白念珠菌的损伤不能被及时修复,为一种不可逆损伤,细胞无法进一步正常分裂增殖,细胞周期阻滞在G2/M期。Li等[9]和吕霞琳等[10]研究发现小檗碱、汉防己甲素联合氟康唑对耐药白念珠菌细胞周期也有一定的阻滞作用。目前,尚未见关于利福喷丁对白念珠菌细胞周期影响的文献报道。本实验表明利福喷丁和氟康唑联合用药时对耐药白念珠菌的细胞周期有阻滞作用,具体作用机制有待进一步研究验证。
