车前三个不同部位中主要化学成分含量差异及其黄嘌呤氧化酶体外抑制作用比较*
2018-08-07李晶刘雯陈超虞金宝
李晶 刘雯 陈超 虞金宝
(江西省中医药研究院 南昌330046)
车前科植物车前(Plantago asiatica L.)是中医临床中利湿通淋常用药车前子和车前草的植物来源之一,在我国各地均有分布,主产于江西、四川、江苏、河南和浙江等地[1]。全国第四次中药资源普查调查结果显示,江西车前主要分布于泰和县、吉水县、永修县、樟树县和新干县。随着中医药产业化发展的不断深入,我省作为该两种药材的道地产区,每年车前的种植面积为3万余亩,亩产车前子约180 kg,即每年车前子产量高达5 400吨,按车前子与废弃物植株产量比例1∶4计,每年车前取车前子后的废弃植株产量超过2万吨,而目前车前废弃植株最常见的利用方式是还田,利用效率相对较低。基于车前子和车前草有较高的药用价值及良好的市场前景,我们根据其化学成分和药理药效的共同点,针对性地开展了对车前不同部位主要化学成分的含量差异研究及其黄嘌呤氧化酶体外抑制作用的比较研究,以探索车前废弃植株的利用前景。现报道如下:
1 仪器与材料
1.1 仪器 HP-1260全自动高效液相色谱仪(美国安捷伦公司),Simplicity TM个人型超纯水系统(德国默克密理博公司),CQ-250超声波清洗器(上海船舶电子设备研究所),AG-135电子天平(梅特勒-托利多仪器上海有限公司)。
1.2 材料 车前的三个不同部位车前草、车前子和车前取车前子后废弃植株均来源于江西省泰和县不同季节采集的车前植物标本,均经江西省中医药研究院虞金宝研究员鉴定为车前科植物车前(Plantago asiatica L.)的不同部位。大车前苷对照品(含量测定用,批号:111914-201102,中国食品药品检定研究院),毛蕊花糖苷对照品(含量测定用,批号:111530-201512,中国食品药品检定研究院),京尼平苷酸对照品(含量测定用,批号:111828-201403,中国食品药品检定研究院),黄嘌呤对照品(含量测定用,批号:140662-200802,中国食品药品检定研究院),尿酸对照品(含量测定用,批号:CAS#69-93-2,上海源叶生物科技有限公司),黄嘌呤氧化酶对照品(含量测定用,批号:CAS#902-17-9,上海源叶生物科技有限公司),别嘌醇对照品(含量测定用,批号:CAS#315-30-0,上海源叶生物科技有限公司),甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 车前三个不同部位主要化学成分的含量差异比较
2.1.1 指标确立 2015年版中国药典[2]中对车前子药材制定了分别以毛蕊花糖苷和京尼平苷酸为检测指标的含量限度,车前草药材标准中则制定了大车前苷的最低含量标准。因此,本实验选取大车前苷、毛蕊花糖苷和京尼平苷酸为检测指标对车前的三个不同部位进行含量测定及比较。
2.1.2 对照品溶液 分别精密称取大车前苷、毛蕊花糖苷和京尼平苷酸适量,用60%甲醇溶解并稀释成浓度为每1ml含大车前苷29.0μg、毛蕊花糖苷30.818 μg和京尼平苷酸31.52μg的混合对照品溶液。
2.1.3 车前三个不同部位供试品溶液 取车前三个不同部位粉末(过二号筛)各约1.0 g,精密称定,置具塞三角瓶中,精密加入60%甲醇50 ml,称定重量,加热回流2 h,放冷,再次称重,用60%甲醇补充减失的重量,摇匀,滤过,取续滤液适量用微孔滤膜(孔径0.45 μm)滤过,作为供试品溶液。
2.1.4 色谱条件 色谱柱:Dikma Diamonsil C18(2)柱(4.6 mm×250 mm,5 μm);流动相:甲醇 -0.1%磷酸系统梯度洗脱,流动相梯度(0~1 min为5∶95;1~40 min 为 5→60∶95→40;40~50 min 为5∶95);流速:1 ml/min;检测波长为 254 nm 和 330 nm。在此条件下,对照品溶液中大车前苷、毛蕊花糖苷和京尼平苷酸与车前三个不同部位供试品溶液在相同时间有色谱峰相对应,且与其它相邻色谱峰均能获得大于2.0的较好分离度。见图1~2。

图1 车前不同部位中毛蕊花糖苷和大车前苷的色谱图(检测波长254 nm)
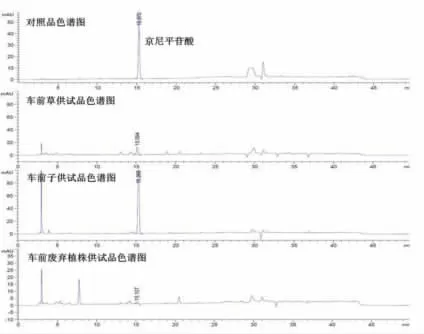
图2 车前不同部位京尼平苷酸的色谱图(检测波长330 nm)
2.1.5 不同部位中主要成分的含量比较 按“2.1.3”项下的方法制备各供试品溶液,每个部位平行制备供试品溶液2份,分别测定车前三个不同部位中大车前苷、毛蕊花糖苷和京尼平苷酸的峰面积并计算含量。见表1。

表1 不同部位中主要成分的含量比较(mg/g,n=2)
2.2 车前三个不同部位的黄嘌呤氧化酶体外抑制作用比较
2.2.1 车前不同部位供试品溶液的制备 取车前草、车前子和车前取车前子废弃植株粉末(过二号筛)各约0.5 g,精密称定,分别置于具塞三角瓶中,精密加入60%甲醇25 ml,加热回流2 h,放冷,摇匀,滤过,收集滤液,以60%甲醇洗涤容器,洗涤液并入滤液,浓缩至近干后转移至10 ml容量瓶,加1 ml二甲基亚砜助溶,并以PBS定容至刻度,作为车前不同部位供试品溶液。
2.2.2 色谱条件 色谱柱:Dikma Diamonsil C18(2)柱(4.6 mm×250 mm,5 μm),流动相:甲醇 -0.02 mol/L 磷酸二氢钾溶液(2∶98),流速:1 ml/min,检测波长254 nm。在此条件下,对照品溶液中尿酸和黄嘌呤对照品与车前不同部位供试品溶液在相同保留时间有色谱峰相对应,且与其它相邻色谱峰均能获得较好的分离度。见图3。

图3 酶促反应HPLC测定色谱图
2.2.3 反应缓冲液(PBS)的配制 精密称取磷酸二氢钾0.482 6 g、三水合磷酸氢二钾3.483 0 g和乙二胺四乙酸18.42 mg,加入纯净水适量超声使溶解并定容至250 ml,即得。
2.2.4 尿酸对照品溶液 精密称取尿酸对照品15.01 mg,置于100 ml量瓶中,加PBS适量超声使溶解并定容至刻度,制成浓度为0.150 1 mg/ml的尿酸对照品溶液。
2.2.5 黄嘌呤对照品溶液 精密称取黄嘌呤对照品9.24 mg,置于50 ml量瓶中,加入1.0 mol/L氢氧化钠溶液100 μl使溶解并用PBS定容至刻度,制成浓度为1.216 mmol/L的黄嘌呤对照品溶液。
2.2.6 黄嘌呤氧化酶储备液 精密称取黄嘌呤氧化酶对照品适量,用PBS适量溶解并定容,制得浓度为56.56 U/L的黄嘌呤氧化酶储备液。
2.2.7 别嘌醇对照品溶液 精密称取别嘌醇对照品7.26 mg,置于100 ml量瓶中,加入少量二甲基亚砜使溶解并用PBS定容至刻度,制成浓度为0.534 mmol/L的别嘌醇对照品溶液。
2.2.8 酶促反应时间考察 精密吸取150 μl的0.534 mmol/L别嘌醇对照品溶液10份,加入黄嘌呤氧化酶储备液400 μl,37℃孵化15 min后,分别加入黄嘌呤对照品溶液400 μl启动反应,分别于37℃ 反 应 15、20、25、30、35、40、45、50、55 和 60 min后,加入1 mol/L盐酸500 μl终止反应,并用PBS分别定容至2 ml作为供试品溶液,分别进行测定。通过计算尿酸生成量与反应时间关系判定,酶促反应以30 min为宜。见图4。
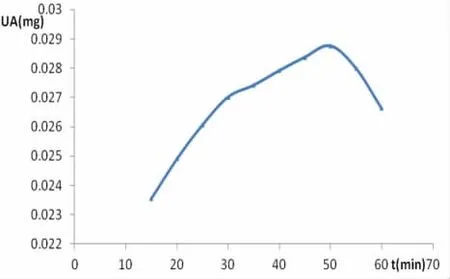
图4 酶促反应速度曲线
2.2.9 酶促反应酶浓度优化 分别精密吸取浓度为 565.600、282.800、113.120、56.560、28.280、14.140和5.656 U/L黄嘌呤氧化酶储备液各400 μl,37℃孵化15 min后,分别加入1.216 mmol/L的黄嘌呤对照品溶液400 μl启动反应,于37℃反应30 min后,分别加入1 mol/L盐酸500 μl终止反应,并用PBS定容至2 ml作为供试品溶液,分别进行测定。根据尿酸生成量与酶浓度间的关系确定56.56 U/L为体系最佳酶浓度。
2.2.10 酶促反应底物浓度优化 精密吸取56.56 U/L黄嘌呤氧化酶储备液400 μl,37℃孵化15 min后,加入 400 μl浓度分别 0.121 6、0.304 0、0.608 0、1.216 0、2.432 0、6.080 0和 12.160 0 mmol/L 的黄嘌呤对照品溶液启动反应,于37℃反应30 min后,分别加入1 mol/L盐酸500 μl终止反应,并用PBS定容至2 ml作为供试品溶液,分别进行测定。通过尿酸生成量与加入底物浓度间的关系判定在56.56 U/L黄嘌呤氧化酶反应体系中黄嘌呤的最适浓度为1.216 mmol/L。
2.2.11 酶促反应体系 取车前不同部位供试品溶液各150 μl,加入浓度为56.56 U/L的黄嘌呤氧化酶储备液400 μl,37℃孵化15 min后,加入浓度为1.216 mmol/L的黄嘌呤对照品溶液400 μl启动反应,于37℃反应30 min后,加入1 mol/L盐酸500 μl终止反应,用PBS定容至2 ml作为供试品溶液。同时设置PBS空白组,分别进行测定,计算各实验组的黄嘌呤氧化酶抑制率[3]。抑制率(%)=[实验组30 min反应体系黄嘌呤浓度-空白组30 min反应体系黄嘌呤浓度]/[空白组0 min反应体系黄嘌呤浓度-空白组30 min反应体系黄嘌呤浓度]×100%。
2.2.12 不同部位体外抑制作用差异 取2.2.1项下车前不同部位供试品溶液进行酶促反应,经HPLC法分别测定后计算各部位的黄嘌呤氧化酶抑制率。结果显示,车前三个部位的体外抑制作用存在一定的差异,同一浓度水平下,通常作为废物处理的车前废弃植株供试品溶液的黄嘌呤氧化酶抑制率高达42.60%,我们推测其药理作用可能与车前草和车前子一致,可降低尿酸的形成,并具有利尿功效;同时结合表1中3个主要指标的测定结果,发现该三个成分的含量与其黄嘌呤氧化酶体外抑制作用不存在明显的量效关系,对于车前三个不同部位的黄嘌呤氧化酶体外抑制作用机理还有待于进一步探索。见表2。

表2 车前不同部位黄嘌呤氧化酶抑制作用比较(%,n=2)
3 讨论
在对车前三个不同部位的主要成分含量测定研究中,分别对流动相、比例和洗脱方式进行了优化,本研究结果显示,以甲醇-0.1%磷酸系统进行梯度洗脱可使各主要成分达到很好的基线分离,且色谱峰对称性良好;在供试品溶液制备方法的研究中,分别比较了超声与回流提取的效果,并对提取时间和溶剂用量进行了摸索,本研究结果显示,以2015年版《中国药典》收录的车前子含量测定项下的方法提取效果最优;此外,在前期文献检索中发现,方芸和吴祥松等[4~5]分别对车前草和车前子药材进行了桃叶珊瑚苷的含量测定研究,因此,我们也分别对车前三个不同部位进行了桃叶珊瑚苷的含量测定,可能由于产地差异,本研究结果显示,各部位中桃叶珊瑚苷的含量均较低,故本文中未将其列入含量差异比较。
随着中医药产业化发展的不断推进,中药产业化种植所产生的农业废弃物日趋增多,对废弃物的资源化利用一方面可以缓解资源短缺的紧张局面,另一方面还可有效地控制由农业生产导致的环境污染。目前,我省对车前废弃植株最常见的利用方式是还田,但其综合利用率还是较低。通过本次体外药效实验我们发现,车前废弃植株有较好的黄嘌呤氧化酶体外抑制作用,因此为探索其利用价值,我们将进一步开展其对高尿酸血症大鼠降血尿酸作用的研究。
