胰岛素不同给药方式对颅脑创伤应激控制的效果比较
2018-08-07李先如高翔蔺志清
李先如 高翔 蔺志清
随着现代化交通运输的不断发展,颅脑创伤的发生率呈逐年上升趋势[1]。相关研究指出,颅脑创伤越严重,患者昏迷时间越长,其新陈代谢就越紊乱,一般伴随不同程度的应激性高血糖;应激性高血糖会增加患者并发症发生率,损害器官功能,直接影响到患者的预后[2-3]。高血糖的主要治疗药物是胰岛素,但是不同给药方式的治疗效果各异,目前尚无统一的标准[4]。笔者采用胰岛素不同给药方式对颅脑创伤患者进行应激控制,并比较其应用效果。
1 对象和方法
1.1 对象 选择2015年12月至2017年1月本院收治的107例颅脑创伤患者为研究对象。在患者知情同意的情况下,采用随机数字列表法分为两组,即微量泵入组(静脉微量泵泵入胰岛素)54例和皮下注射组(间断性皮下注射胰岛素)53例。入选标准[5]:(1)确诊为颅脑创伤,且并发应激性高血糖的患者;(2)积极配合治疗者;(3)格拉斯哥昏迷评分(GCS)<8分者。排除标准:(1)既往有高血压、高血糖等病史者;(2)人体重要脏器异常或损伤者;(3)对胰岛素过敏者。微量泵入组男30例,女24例;年龄35~65(50.36±5.66)岁;双侧额颞部脑挫裂伤 23 例,单侧额颞部脑挫裂伤31例;锐器伤5例,车祸30例,高处坠落19例。皮下注射组男28例,女25例;年龄36~64(50.45±5.67)岁;双侧额颞部脑挫裂伤24例,单侧额颞部脑挫裂伤29例;锐器伤4例,车祸31例,高处坠落18例。两组患者一般资料比较,差异均无统计学意义(均P>0.05)。本研究经医院伦理委员审核通过。
1.2 方法 所有患者接受常规手术治疗,术后给予抗感染、改善脏器功能、调节水电解质、平衡酸碱的治疗以及基础营养支持治疗等。针对颅脑创伤进行应激控制,术后3d给予胰岛素治疗。
1.2.1 胰岛素给药方式 (1)皮下注射组:采用间断性皮下注射胰岛素。选择上臂外侧皮下脂肪层,对穿刺部位进行常规消毒、铺巾。根据每例患者血糖情况抽取相应剂量胰岛素(批号:国药准字H20160148,上海第一生化药业有限公司)进行皮下注射。对于血糖水平<14mmol/L者,皮下注射胰岛素4U,连续治疗3d后检测血糖水平,若降至正常则停止用药;对于血糖水平14~16.5mmol/L者,皮下注射胰岛素6U,若血糖水平降至正常则降低药物剂量或停止用药;对于血糖水平>16.5mmol/L者,皮下注射胰岛素8U,连续治疗7d,若血糖水平降至正常则降低药物剂量或停止用药。(2)微量泵入组:采用静脉微量泵泵入胰岛素。入院后建立静脉通道,利用注射器抽取胰岛素(国药准字:H11020548,四环药业股份有限公司)50U与49ml 0.9%氯化钠注射液混合,制备成浓度为1U/ml的胰岛素注射液。将注射器与一次性延伸输液管相互连接,将连接管中的空气排空,再将输液管一段连接到微量注射泵的注射器槽中,完成静脉通路搭建后调节微量注射泵速度(2ml/h)及泵入量(每天给予0.34U/kg),开始对患者进行静脉持续泵入胰岛素。连续治疗3d后检测血糖水平,对于血糖水平<14.0mmol/L者,快速推入2ml,速度2ml/h;对于血糖水平在14~16.5mmol/L者,快速推入4ml,速度2ml/h;对于血糖水平≥16.5mmol/L者,快速推入4ml,速度4ml/h;经过7d连续治疗后,若血糖水平降至正常则降低药物剂量或停止用药。
1.2.2 观察指标 观察并比较两组患者胰岛素用量、低血糖发生次数、血糖达标时间、机械通气时间、入住ICU时间、住院时间、并发症发生率,治疗前后外周血多形核白细胞(PMN,采用全自动血细胞分析仪进行检测)、TNF-α(采用双抗体夹心ELISA法进行检测)水平以及GCS(内容包括语言反应、肢体运动、睁眼反应等3个方面,总分15分,分值越低表示意识障碍越严重[6])、急性生理与慢性健康(APACHEⅡ)评分(内容包括急性生理、年龄和慢性健康评分等3个方面,总分71分,分值越低表示器官功能障碍越轻)。
1.3 统计学处理 应用SPSS 19.0统计软件。计量资料用表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对样本t检验;计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者胰岛素用量、低血糖发生次数及血糖达标时间比较 微量泵入组患者胰岛素用量、低血糖发生次数、血糖达标时间均低于皮下注射组,差异均有统计学意义(均P<0.05),见表 1。

表1 两组患者胰岛素用量、低血糖发生次数及血糖达标时间比较
2.2 两组患者机械通气、入住ICU及住院时间比较 微量泵入组机械通气、入住ICU及住院时间均短于皮下注射组,差异均有统计学意义(均P<0.05),见表2。
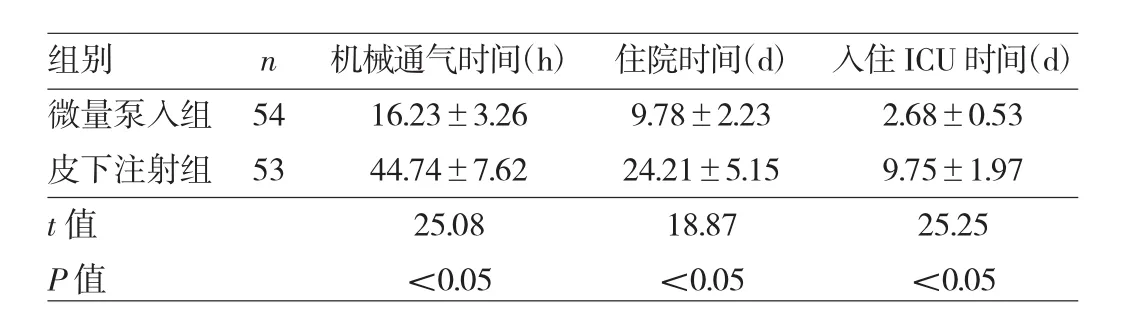
表2 两组患者机械通气、入住ICU及住院时间比较
2.3 两组患者治疗前后PMN、TNF-α水平比较 治疗前,两组患者PMN、TNF-α水平比较,差异均无统计学意义(均P>0.05)。治疗后,两组患者PMN水平均较治疗前上升(均P<0.05),微量泵入组低于皮下注射组(P<0.05);TNF-α 水平均较治疗前下降(均P<0.05),微量泵入组低于皮下注射组(P<0.05),见表3。
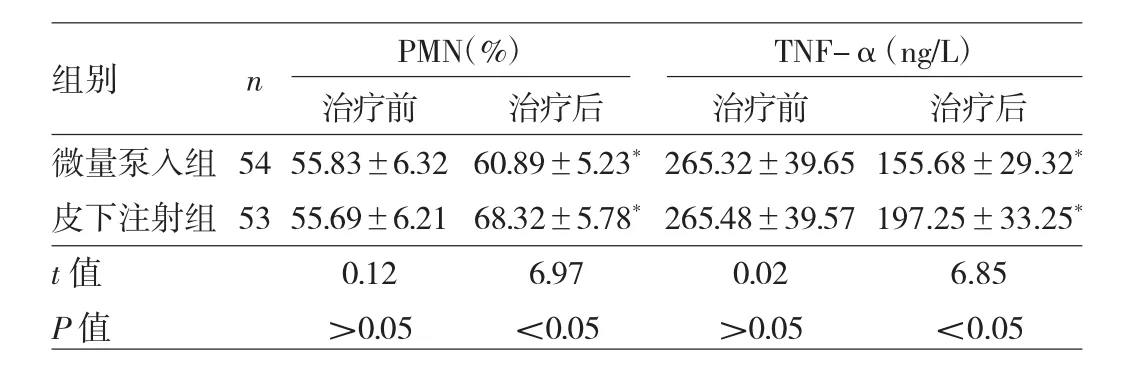
表3 两组患者治疗前后PMN、TNF-α水平比较
2.4 两组患者治疗前后GCS、APACHEⅡ评分比较 治疗前,两组患者GCS、APACHEⅡ评分比较,差异均无统计学意义(均P>0.05)。治疗后,两组患者GCS均较治疗前上升(均P<0.05),微量泵入组高于皮下注射组(P<0.05);APACHEⅡ评分均较治疗前下降(均P<0.05),微量泵入组低于皮下注射组(P<0.05),见表4。

表4 两组患者治疗前后GCS、APACHEⅡ评分比较
2.5 两组患者并发症发生情况比较 微量泵入组并发症发生率低于皮下注射组,差异有统计学意义(χ2=5.33,P<0.05),见表 5。
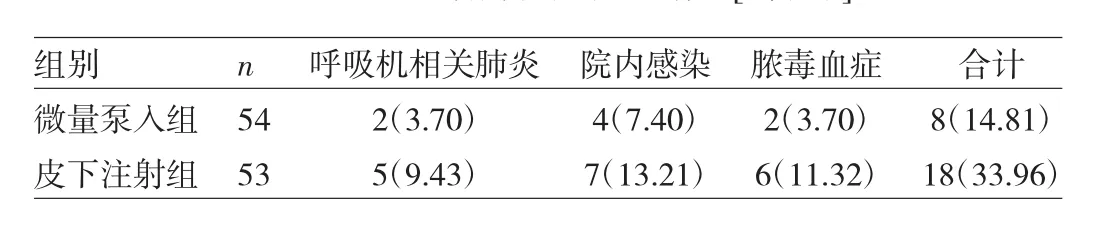
表5 两组患者并发症发生情况[例(%)]
3 讨论
健康人体是通过神经内分泌、肝脏等调节血糖水平并使其维持在一定范围内[7]。但是当人体受到严重创伤时,机体会产生强烈的应激反应,使交感神经兴奋,从而增强肾上腺皮质激素等反向调节激素的分泌,最终引起机体胰岛素分泌减少、机体血糖代谢紊乱,出现应激性高血糖现象[8-9]。在高血糖状态下,机体会因多种病理、生理效应而受到损害,发生水电解质紊乱等风险增加,最终影响预后[10-12]。颅脑创伤是强烈的应激源,创伤会提高脑组织对能量的需求,颅内代谢加快,因此一般伴随应激性高血糖。在应激性高血糖状态下,脑组织功能需求得不到满足而导致大脑在缺乏能量情况下进行代谢,直接影响预后。因此,控制颅脑创伤患者的血糖水平,能有效减少感染、脏器功能衰竭等并发症的发生[13-15]。
胰岛素不仅能有效降低血糖;还能降低促炎细胞因子表达水平,提升抗感染细胞因子表达水平,共同恢复细胞因子的稳定状态[16]。相关研究表明,胰岛素能提高内皮细胞一氧化氮合成作用,从而抑制黏附分子-1的生成,起到保护内皮细胞的作用[17]。对颅脑创伤并发应激性高血糖的患者给予胰岛素治疗,能降低其血糖水平,减轻炎症反应,减少脓毒血症的发生等,对降低患者病死率的风险具有积极作用。采用胰岛素治疗应激性高血糖得到了国内外医学界的一致认可[18]。然而,关于胰岛素给药方式尚无统一的定论。目前,临床上最为常用的给药方式是静脉微量泵泵入胰岛素和间断性皮下注射胰岛素。有研究指出,皮下注射胰岛素一般在0.5h内起效,3h达到药物浓度峰值,药效持续时间为6~8h[19]。针对病情严重的颅脑创伤患者,手术治疗后一般会出现血流动力学不稳定、脱水等危急情况,此时皮下注射胰岛素可能出现吸收不良、见效慢、治疗效果差的状况。胰岛素的半衰期约为3.8h,多次注射胰岛素可能造成药物蓄积,待人体循环改善后,极有可能出现迟发性低血糖现象,从而引发神经元变性或水肿等[20]。静脉微量泵泵入胰岛素则立即起效,一般给药0.5h内达到药物浓度峰值,药效持续时间为2h,能迅速、有效地控制应激性高血糖[21-22]。同时,静脉微量泵泵入胰岛素能随时调节胰岛素用量,还能在恒定浓度的状态下匀速泵入,有效避免低血糖的发生,它是一种相对安全、有效的血糖控制方案。
相关研究指出,在机体应激状态下血PMN快速被活化,再通过黏附、吞噬、游走等一系列反应参与局部炎症反应及急性期反应[23]。但是PMN反应释放炎性物质过多会使炎症反应过度,引起人体各器官发生病理性损伤[24]。TNF-α是炎症反应最初也是最关键的启动者,能激活人体中性粒细胞及淋巴细胞合成次级炎性介质,从而加剧炎症反应[25]。本研究结果表明,与皮下注射组比较,微量泵入组胰岛素用量、血糖达标时间、低血糖发生次数以及机械通气时间、入住ICU时间、住院时间均较低,GCS较高,APACHEⅡ评分较低。这说明静脉微量泵泵入胰岛素治疗能加快血糖达标时间,缩短胰岛素用量,有效减少低血糖发生次数,缩短机械通气、入住ICU及住院时间,加快患者恢复。治疗后,微量泵入组PMN、TNF-α水平均低于皮下注射组,说明静脉微量泵泵入胰岛素治疗颅脑创伤应激状态下炎症反应的效果更优。此外,微量泵入组并发症发生率低于皮下注射组,这可能与静脉微量泵泵入胰岛素能有效控制血糖处于达标状态有关。
综上所述,与间断性皮下注射胰岛素比较,静脉微量泵泵入胰岛素对颅脑创伤患者的应激控制良好,能有效减少胰岛素用量、血糖达标时间、低血糖发生次数、机械通气时间、入住ICU时间、住院时间,能有效改善应激性炎症状态,提高GCS,降低APACHEⅡ评分,降低并发症发生率,值得在临床推广。
