儿童功能性便秘与抗生素暴露相关性分析
2018-08-05牟娅妮丁国栋王怡仲张婷
牟娅妮 丁国栋 王怡仲 张婷
摘 要 目的:探讨儿童功能性便秘与抗生素暴露的关系。方法:本研究为回顾性研究,采用病例对照研究方法,通过调查问卷获取研究对象的抗生素使用情况、便秘情况及基本信息。病例组包含2017年9月—2018年4月就诊于上海市儿童医院消化科门诊并被诊断为儿童功能性便秘的100例患儿。结果:共收集病例组患儿调查问卷100份,对照组患儿调查问卷51份。病例组患儿的年龄为4个月 ~ 11岁,平均年龄3.6岁。78%的病例组患儿和67%的对照组患儿于2岁内使用过抗生素,但此差异无统计学意义;70%的病例组患儿和53%的对照组患儿在近1年内使用过抗生素,此差异有统计学意义。结论:抗生素暴露可能是儿童功能性便秘的危险因素。
关键词 功能性便秘 抗生素 儿童
中图分类号:R725.7 文献标志码:C 文章编号:1006-1533(2018)13-0007-03
Analysis of correlation between functional constipation and antibiotic exposure in children*
MOU Yani, DING Guodong, WANG Yizhong, ZHANG Ting**
(Department of Gastroenterology, Hepatology and Nutrition, Shanghai Childrens Hospital, Shanghai 200062, China)
ABSTRACT Objective: To explore the correlation between functional constipation and antibiotic exposure in children. Methods: This was a case-control study. The use of antibiotics, constipation and basic information were obtained by questionnaires. The case group included 100 children diagnosed as functional constipation in Shanghai Childrens Hospital from September, 2017 to April, 2018. Results: A total of 100 questionnaires were collected from the case group and 51 from the control group. The age in the case group was 4 months old ~ 11 years old with average age 3.6 years old. Antibiotics were ever used in 78% of patients in the case group and 67% in the control group, whose age was within 2 years of old, however these differences were not statistically significant. Antibiotics were ever used in the past 1 year in 70% of patients in the case group and 53% of children in the control group, which showed to be statistically significant. Conclusion: Exposure to antibiotics may be a risk factor for functional constipation in children.
KEY WORDS functional constipation; antibiotics; children
兒童功能性便秘是非器质性因素引起的便秘,主要表现为排便次数减少、大便干硬、排便困难,可伴有腹痛、肛裂、大便失禁、遗尿等[1] ,占儿童便秘的90%以上,好发于2 ~ 4岁儿童[2] 。功能性便秘是儿科常见病、多发病,其全球发病率为3% ~ 8%,占消化专科就诊人数的10% ~ 25%。儿童功能性便秘不仅威胁患儿的身心健康,严重时还会影响患儿的生活质量,给其家庭带来经济和精神负担[3] 。
功能性便秘的病因及病理生理学机制仍未明确,目前认为与不良的排便习惯、遗传、饮水量不足、膳食纤维摄入过少、活动量少、肠道菌群失衡、精神负担大等多种因素相关[4] 。一项历时11年余的队列研究显示,抗生素暴露可能会增加功能性胃肠病的发病率,机制可能涉及肠道菌群等[5] 。
1 研究方法
本研究为回顾性研究,采用病例对照研究方法。病例组包含2017年9月—2018年4月在上海市儿童医院消化科门诊就诊并被诊断为儿童功能性便秘的100例患儿,入选标准参考罗马Ⅳ诊断标准。对照组51例患儿收集自上海市儿童医院其他科室,他们无便秘症状,也无与便秘有关的其他基础疾病。病例组和对照组患儿的年龄、性别相匹配。
调查问卷由相关领域专家协助设计,主要内容包括一般资料(姓名、出生年月、身高、体重、父母学历及月收入等)、便秘情况(病程、排便频率、粪便的Bristol分型、排便费力否等)、便秘的危险因素(家族史、抗生素使用情况、饮食等)、出生史(母亲的分娩年龄、胎次产次、孕周、分娩方式等)、喂养情况。
将所有调查问卷内容录入数据库后,用SPSS 22.0软件进行统计学分析,P<0.05表示差异有统计学意义。
2 研究结果
2.1 基本信息
在100例病例组患儿中,有男54例、女46例,他们的年龄范围为4个月 ~ 11岁,平均年龄为(3.62±2.29)岁,以6岁以下居多,其中又以2 ~ 4岁最多;在51例对照组患儿中,有男34例、女17例,他们的年龄范围为4个月 ~ 11岁,平均年龄为(3.60±2.38)岁。
2.2 功能性便秘情况
调查结果显示,在病例组中,69%(69例)患儿的病程≤1年,31%(31例)患儿的病程>1年,病程长短不一,中位数为10个月;78%(78例)患儿的粪便类型为BristolⅠ~ Ⅲ型,部分患儿的粪便初始部分干硬,后为成形软便或稀糊便,故调查问卷上的回答可能不甚正确;65%(65例)患儿抗拒排便,表现为拒绝使用马桶、扣留行为、排便时哭闹或尖叫等;33%(33例)患儿合并肛裂,主要表现有便血、肛门疼痛、肛管裂口。
43%(43例)的病例组患儿和6%(3例)的对照组患儿有便秘家族史,比值比(odds ratio, OR)达12.07,经卡方检验得χ2=21.967,P<0.05,表明便秘家族史可能是儿童功能性便秘的危险因素。
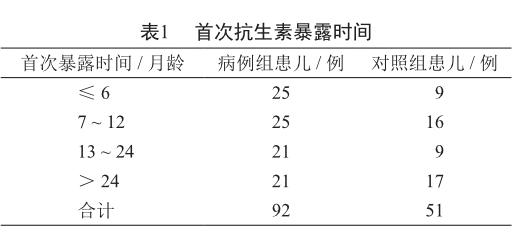
2.3 功能性便秘与首次抗生素暴露时间
对首次抗生素暴露时间,在病例组患儿的调查问卷中有92份作了回答,回答率为92%,而在对照组患儿的调查问卷中均作了回答,具体情况见表1。
初步计算,与≤2岁未使用过抗生素的患儿相比,≤2岁使用过抗生素患儿的OR=1.69,表明早期的抗生素暴露可能是儿童功能性便秘的危险因素。为进一步探究首次抗生素暴露时间与儿童功能性便秘的关系,进行两样本的秩和检验。病例组的平均秩和为68.78,对照组的平均秩和为77.81,P=0.196,尚不能认为病例组患儿与对照组患儿在首次抗生素暴露时间上有差异。
2.4 功能性便秘与近1年内抗生素暴露的关系
病例组中,69%患儿的病程≤1年。近1年内,病例组中有70%(70例)患儿使用过抗生素,30%(30例)患儿未使用过抗生素;对照组中有53%(27例)患儿使用过抗生素,47%(24例)患儿未使用过抗生素。两组患儿使用的抗生素种类均为头孢菌素类、大环内酯类、青霉素类抗生素。
统计分析表明,抗生素暴露可能是导致儿童功能性便秘的危险因素(OR=2.07)。对两组数据进行卡方检验,χ2=4.278,P=0.039,表明近1年内抗生素暴露是导致儿童功能性便秘的危险因素。
为了进一步研究年龄对上述关系的影响,对年龄分层并进行卡方检验。根据患儿年龄分为两组,≤4岁组的OR=2.322,>4岁组的OR=1.806,P=0.759,提示抗生素暴露对儿童功能性便秘的影响与年龄无关。
3 讨论
目前,有关功能性便秘的病因及病理生理学机制仍未明确。本研究收集了100例功能性便秘患儿和51例非便秘患儿的调查问卷,通过统计分析发现,功能性便秘患儿的首次抗生素暴露时间早于非便秘患儿,近1年内的抗生素暴露显著高于非便秘患儿且此差异有统计学意义。这与相关研究[5] 的结果相符,机制可能与肠道菌群等相关。
Zhu等[6] 以8例功能性便秘和14例无便秘的肥胖患儿为对象,通过16S rRNA高通量焦磷酸测序法检测、比较了这两组患儿的粪便菌群组成,结果发现在菌门水平上,无便秘肥胖患儿的拟杆菌门占比为59.18%,厚壁菌门占比为34.38%,两者占比合计为93.56%,而功能性便秘肥胖患儿的此两菌门占比正好相反,厚壁菌门占比为57.98%,拟杆菌门占比为33.69%;在菌属水平上,功能性便秘肥胖患儿的粪球菌属、瘤胃球菌属数量显著增加,柔嫩梭菌属占比为无便秘肥胖患儿的2.8倍,普雷沃菌属数量则显著减少,但双歧杆菌属、梭杆菌属占比没有显著变化。de Meij等[7] 以76例功能性便秘患儿和61例健康儿童为研究对象,通过检测他们的肠道菌群DNA并经岭回归分析发现,功能性便秘患儿与健康儿童的肠道菌群在菌门的水平上存在82%的差异,其中脆弱拟杆菌、卵形拟杆菌、长双歧杆菌、类拟杆菌数量增加,另枝菌属数量减少。以上研究表明,与健康儿童相比,功能性便秘患儿的肠道菌群组成发生了改变。
动物实验证实,肠道菌群影响肠道蠕动,但机制尚未明确,存在不同的假说[7, 10]:①肠道菌群发酵食物后会改变肠道的pH,低pH可促进肠道蠕动[11] ;②肠道菌群产生的气体(二氧化碳、氢气、甲烷等)可影响肠道平滑肌收缩,如慢传输型便秘患儿呼出气中的甲烷含量升高,经治疗便秘情况好转后则此含量降低[11-12] ;③肠道菌群的代谢产物可通过调节肠道渗透压来增加肠内容物;④肠道菌群的代谢产物可直接作用于肠道平滑肌,如粪球菌、柔嫩梭菌会代谢产生丁酸,丁酸既可抑制結肠平滑肌收缩而引起慢传输型便秘,又可刺激肠对水的吸收而导致粪便干硬[7] 。
另有小鼠实验表明,使用广谱抗生素后,肠道中的革兰阴性菌数量显著减少,肠道Toll样受体-4表达下调,导致肠肌层巨噬细胞的骨形态发生蛋白-2生成减少,胃肠动力降低,进而引起排便次数减少、粪便水分减少、肠道扩张及蠕动减缓[13-14] 。综上所述,抗生素暴露影响肠道菌群,肠道菌群影响肠道蠕动,最终导致便秘发生。
本研究样本量较少,且为回顾性研究,多方面因素导致调查问卷回答不完整,存在回忆偏倚。部分患儿的病程>1年,近1年内抗生素暴露情况不能很好地反映抗生素暴露对疾病发生的影响。抗生素对功能性便秘发生的影响可能主要通过影响肠道菌群产生,今后应结合肠道菌群分析进行进一步的研究。
参考文献
[1] Dehghani SM, Kulouee N, Honar N, et al. Clinical manifestations among children with chronic functional constipation [J]. Middle East J Dig Dis, 2015, 7(1): 31-35.
[2] Malowitz S, Green M, Karpinski A, et al. Age of onset of functional constipation [J]. J Pediatr Gastroenterol Nutr, 2016, 62(4): 600-602.
[3] 胡會, 肖咏梅, 张婷. 儿童功能性便秘的危险因素分析[J].临床儿科杂志, 2015, 33(4): 306-308.
[4] Levy EI, Lemmens R, Vandenplas Y, et al. Functional constipation in children: challenges and solutions [J/OL]. Pediatric Health Med Ther, 2017, 8: 19-27 [2018-05-13]. doi: 10.2147/PHMT.S110940.
[5] Paula H, Grover M, Halder SL, et al. Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders [J]. Neurogastroenterol Motil, 2015, 27(11): 1580-1586.
[6] Zhu L, Liu W, Alkhouri R, et al. Structural changes in the gut microbiome of constipated patients [J]. Physiol Genomics, 2014, 46(18): 679-686.
[7] de Meij TG, de Groot EF, Eck A, et al. Characterization of microbiota in children with chronic functional constipation [J/ OL]. PLoS One, 2016, 11(10): e0164731 [2018-05-13]. doi: 10.1371/journal.pone.0164731.
[8] Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis [J]. Rev Gastroenterol Hepatol, 2009, 6(5): 306-314.
[9] Kashyap PC, Marcobal A, Ursell LK, et al. Complex interactions among diet, gastrointestinal transit, and gut microbiota in humanized mice [J]. Gastroenterology, 2013, 144(5): 967-977.
[10] Verdu EF. Probiotics effects on gastrointestinal function: beyond the gut? [J]. Neurogastroenterol Motil, 2009, 21(5): 477-480.
[11] B?r F, Von Koschitzky H, Roblick U, et al. Cell-free supernatants of Escherichia coli Nissle 1917 modulate human colonic motility: evidence from an in vitro organ bath study[J]. Neurogastroenterol Motil, 2009, 21(5): 559-566, e16-e17.
[12] Soares AC, Lederman HM, Fagundes-Neto U, et al. Breath methane associated with slow colonic transit time in children with chronic constipation [J]. J Clin Gastroenterol, 2005, 39(6): 512-515.
[13] Ge X, Zhao W, Ding C, et al. Potential role of fecal microbiota from patients with slow transit constipation in the regulation of gastrointestinal motility [J/OL]. Sci Rep, 2017, 7(1): 441 [2018-05-13]. doi: 10.1038/s41598-017-00612-y.
[14] Inagawa H, Saika T, Nishiyama N, et al. Improvement effect of Dewaxed brown rice on constipation in antibiotic-treated mice [J]. In Vivo, 2017, 31(4): 573-577.
