胡萝卜苷对人肝癌细胞株HepG2增殖、凋亡的影响及其机制探讨
2018-08-03曾俊权林晔刘婷婷柯波肖游章
曾俊权,林晔,刘婷婷,柯波,肖游章
(1井冈山大学,江西吉安343009;2赣州市人民医院;3江西省人民医院)
肝癌是一种常见的恶性肿瘤,病死率很高[1]。探索肝癌防治方案成为国内研究的热点[2]。近年来研究[3]发现,多种中药的天然有效成分及其提取物在肿瘤等疾病的治疗中发挥了积极作用。胡萝卜苷是一种从中药材望江南中提取出的具有抗肝癌作用的活性单体之一,其具体抗肝癌机制尚未明确[4]。我们前期研究[5]发现胡萝卜苷可能通过下调TOPOⅠ、TOPOⅡ基因表达而抑制肝癌HepG2细胞增殖。Wnt/β-catenin信号通路是细胞内重要的信号转导途径之一,参与了许多恶性肿瘤的发生发展[6],该通路在部分肝癌病例中呈活化状态[7]。有研究[8]表明Wnt/β-catenin信号通路的异常活化可能是β-catenin基因突变所致。本研究观察了胡萝卜苷对肝癌细胞株HepG2增殖和凋亡的影响,及对Wnt/β-catenin信号通路相关蛋白表达的影响,探讨胡萝卜苷可能的抗癌机制。
1 材料与方法
1.1 主要实验材料 HepG2细胞由广州莱德尔生物科技有限公司实验室传代和保存。胡萝卜苷购于Sigma公司。胎牛血清、RPMI-1640培养基、青-链霉素和PBS购于Hyclone公司。细胞培养板、细胞培养瓶、细胞培养皿等购于CORNING公司。Annexin V-FITC细胞凋亡检测试剂盒购于Keygen公司。HRP标记的GAPDH内参购于上海康成生物有限公司。羊抗兔标记HRP二抗购于Southern Biotech公司。Bax、Bcl-2、WNT3A和β-catenin抗体购于Abcam公司。倒置光学显微镜购于OLYMPUS公司。CO2细胞恒温培养箱、DMI6000B酶标仪购于赛默飞世尔(上海)仪器有限公司。垂直电泳槽、转移电泳槽购于上海天能科技有限公司。流式细胞仪购于BD Calibur公司。
1.2 细胞培养与分组 HepG2细胞按1×105/mL接种于含10%胎牛血清并加入青-链霉素的RPMI-1640培养液中,于37 ℃、5% CO2饱和湿度的细胞培养箱中常规培养,取对数生长期细胞用于实验。将HepG2细胞分为胡萝卜苷组和对照组。
1.3 细胞增殖能力观察 选取对数生长期的HepG2细胞用trypsin-EDTA进行消化处理,离心后计数,按5×105/mL接种于96孔板中,置于37 ℃、5% CO2饱和湿度的细胞培养箱中常规培养24 h。胡萝卜苷组分别加入25、50、100、150、200 μg/mL的胡萝卜苷,对照组不加入药物。继续培养48 h后,每孔中加入10 μL的CCK-8试剂,培养1 h后用酶标仪检测450 nm处的OD值,每组设置6个复孔。细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.4 细胞凋亡情况观察 取对数生长期的肝癌HepG2细胞,按5×105/mL接种于6孔板中。胡萝卜苷组分别加入50、100 μg/mL的胡萝卜苷,对照组不加入药物。在37 ℃、5% CO2饱和湿度的细胞培养箱中常规培养48 h。弃去培养液,PBS清洗1次,加入0.5 mL的0.25%胰酶消化,待细胞消化完全后加入预冷的结合缓冲液吹打成单个细胞悬液,调整细胞密度为1×106/mL。取0.5 mL细胞悬液,加入1.25 μL的Annexin V-FITC,室温避光反应15 min,离心弃上清。加入0.5 mL预冷的结合缓冲液重悬细胞,并加入10 μL的Propidium Iodide,室温避光孵育,用流式细胞仪进行检测。
1.5 细胞中Bax、Bcl-2、WNT3A、β-catenin蛋白检测 取对数生长期的HepG2细胞,按5×105/mL接种于6孔板中。胡萝卜苷组分别加入50、100 μg/mL的胡萝卜苷,对照组不加入药物。于37 ℃、5% CO2饱和湿度的细胞培养箱中常规培养48 h。收集细胞并提取细胞全蛋白,用BCA法对蛋白浓度进行定量。取20 μg的蛋白进行聚丙烯酰胺凝胶电泳,然后转印至PVDF膜上,于5%脱脂奶粉中室温封闭2 h;4 ℃条件下一抗孵育过夜,次日将膜用TBST漂洗4次、每次10 min;用HPR二抗室温振荡孵育2 h;TBST漂洗4次、每次10 min;配置化学发光反应液、曝光、显影,用Quantity One凝胶图像分析软件分析目的蛋白条带与内参条带的光密度比值,代表目的蛋白的相对表达量。
2 结果
2.1 两组细胞增殖抑制率比较 胡萝卜苷组中25、50、100、150、200 μg/mL亚组细胞增殖抑制率分别为18.0%±2.7%、28.0%±2.1%、42.0%±2.1%、45.6%±2.3%、48.0%±3.3%,对照组细胞增殖抑制率为0,胡萝卜苷各亚组细胞增殖抑制率均高于对照组,且胡萝卜苷组中25、50、100、150、200 μg/mL亚组细胞增殖抑制率依次增高(P均<0.05)。
2.2 两组细胞凋亡率比较 胡萝卜苷组50 μg/mL亚组、100 μg/mL亚组细胞凋亡率均高于对照组,且100 μg/mL亚组细胞凋亡率高于50 μg/mL亚组(P均<0.05)。见图1、表1。
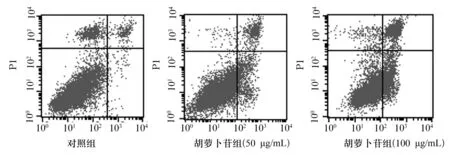
图1 胡萝卜苷组与对照组细胞凋亡情况

表1 胡萝卜苷组与对照组细胞凋亡率比较
2.3 两组细胞中Bax、Bcl-2、WNT3A和β-catenin蛋白表达比较 对照组及胡萝卜苷组的50 μg/mL亚组、100 μg/mL亚组细胞中Bax蛋白相对表达量依次增高,Bcl-2、WNT3A、β-catenin蛋白相对表达量依次降低(P均<0.05)。详见图2、表2。
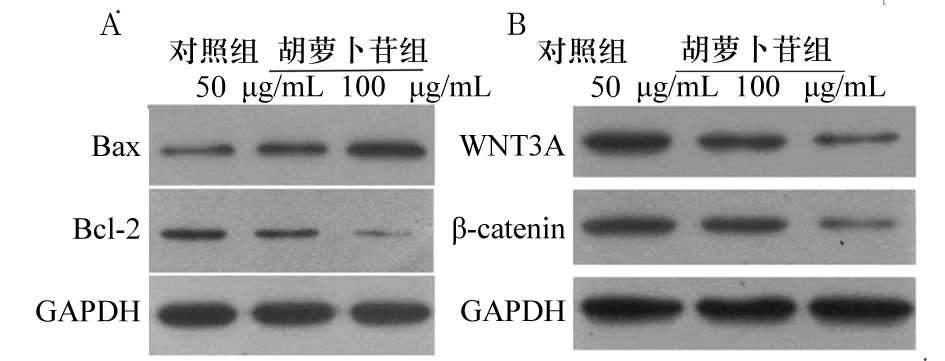
注:A为Bax、Bcl-2蛋白表达情况;B为WNT3A、β-catenin蛋白表达情况。
表2 胡萝卜苷组与对照组细胞中Bax、Bcl-2、WNT3A、β-catenin蛋白表达比较
3 讨论
肝癌是一种高病死率的恶性肿瘤,传统的手术切除治疗、放疗、化疗都存在一定的弊端,并且治疗后容易复发,对机体的继发性损伤也很大。中医中药学在控制病情发展、改善症状体征及提高生存质量等方面的优势日益显现。许多中药对肿瘤具有多靶点、多环节、多效应的作用[9]。发掘具有抗肝癌作用的中药及阐明其相关作用机制已成为研究热点。胡萝卜苷是传统常用中药望江南中的一种活性单体。已有研究[5]表明,胡萝卜苷能够抑制肝癌细胞的增殖、迁移。胡萝卜苷还可促进肺癌A549细胞发生线粒体依赖的细胞凋亡,诱导细胞周期阻滞在G2/M期[10],但具体机制尚不清楚。我们研究结果发现,胡萝卜苷处理肝癌HepG2细胞48 h后对细胞的增殖有明显的抑制作用,且随着胡萝卜苷浓度增加,抑制效应越显著。
细胞凋亡是一种由基因调控的细胞程序性死亡过程,与细胞增殖共同维持机体的稳态。本研究观察了两组细胞凋亡情况,结果显示,胡萝卜苷对肝癌细胞的早期凋亡和晚期凋亡都有促进作用,说明胡萝卜苷具有促进肝癌细胞凋亡的作用。Bcl-2家族蛋白是细胞凋亡调节过程中的重要蛋白。Bcl-2主要定位于内质网、线粒体和核膜,通过抑制细胞色素C的释放来抑制细胞凋亡。Bax通过转位并紧密结合到线粒体膜上,从而使线粒体的结构和功能受到破坏,诱导释放细胞色素C及激活Caspase-8、Caspase-9,通过多种Caspase依赖的信号通路促进细胞凋亡[11]。因此,Bcl-2和Bax的相互作用对细胞凋亡起决定性作用[12]。有研究发现60%以上肝癌组织中出现Survivin和β-catenin蛋白的异常表达,并与原发性肝癌的发生有关。本研究结果显示,对照组及胡萝卜苷组的50 μg/mL亚组、100 μg/mL亚组细胞中Bax蛋白相对表达量依次增高,Bcl-2蛋白相对表达量依次降低,提示胡萝卜苷对HepG2细胞中Bax蛋白表达起促进作用,而对Bcl-2的表达起抑制作用,可调节Bax/Bcl-2平衡,这从蛋白水平验证了胡萝卜苷能促进肝癌细胞的凋亡。
Wnt/β-catenin通路是细胞内信号转导的主要信号通路,也被称为经典Wnt通路[13]。Wnt/β-catenin信号通路异常与多种恶性肿瘤发生及发展有着密切关系[14]。活化后Wnt蛋白会破坏β-catenin的降解复合体,抑制β-catenin的降解过程,导致β-catenin在细胞质堆积,还能促进β-catenin进入细胞核[15],β-catenin进入细胞核后能够调节多种靶基因的表达,如c-Myc、Survivin和Cyclin D1[16]。根据研究统计,至少有90%的结直肠癌患者细胞中Wnt/β-catenin信号通路异常[17]。有学者[18]发现卵巢癌细胞中Wnt-1、β-catenin蛋白异常高表达可能是卵巢癌晚期的重要标志。β-catenin蛋白在多种鼻咽癌细胞中异常高表达,与鼻咽癌的发生发展有密切关系[19]。国内学者[20]发现,通过上调P53蛋白表达,可抑制胆管癌细胞中Wnt/β-catenin通路相关分子及其下游Notch信号分子的表达,从而抑制细胞增殖、诱导凋亡,同时也导致Bax/Bcl-2升高。我们对Wnt/β-catenin信号通路中的WNT3A和β-catenin蛋白进行检测,发现对照组及胡萝卜苷组的50 μg/mL亚组、100 μg/mL亚组细胞中WNT3A、β-catenin蛋白相对表达量依次降低,提示胡萝卜苷对WNT3A和β-catenin蛋白的表达起抑制作用,进而抑制Wnt/β-catenin信号通路的功能。Survivin是一种凋亡抑制因子[21],可通过抑制Caspase活性发挥抗凋亡作用,而Survivin的表达受Wnt/β-catenin信号通路的调节,但是胡萝卜苷对Survivin表达的影响尚不明确。
综上所述,胡萝卜苷对HepG2细胞的增殖具有抑制作用,而对其凋亡具有促进作用,其机制可能与抑制Wnt/β-catenin信号通路和促进凋亡蛋白表达有关。然而,胡萝卜苷具体的抗肿瘤机制尚未完全阐明,还需进一步研究确定其体内抗肿瘤活性。
