膀胱尿路上皮癌组织中桩蛋白的表达变化及意义
2018-08-03姚佳沛刘炜徐建春李颢
姚佳沛,刘炜,徐建春,李颢
(昆明医科大学第一附属医院,昆明 650031)
全球范围内膀胱癌的发病率位居恶性肿瘤的第9位,膀胱尿路上皮癌(BUC)是最常见的类型[1]。BUC依照是否发生肌层浸润可分为浸润性尿路上皮细胞癌与非浸润性尿路上皮细胞癌。BUC组织学形态多样,临床上已见多种变异型,形态学上可近似良性病变,为病理医生的鉴别诊断增加了难度;同时有些变异型BUC侵袭性较普通型更高,更需要加强监测谨慎制定治疗方案[2]。近年来,尽管以外科手术为代表的肿瘤治疗手段飞速发展,但BUC患者
的预后并没有得到显著的改善,患者术后5年生存率在50%~60%[3]。新的诊疗手段,例如BUC特异性肿瘤标记物,可能是未来发展的方向。桩蛋白作为一种分布广泛的信号蛋白,是近年学者们研究的热点之一。桩蛋白家族包括桩蛋白、过氧化氢诱导的克隆5与Leupaxin[4]。桩蛋白在体内的作用范围最为广泛,其能够激活局部黏着斑激酶(FAK)信号通路,从而调节细胞的黏附和转移[5],因此推测桩蛋白可能与肿瘤的形成与发展有关。近年来的研究[6~8]表明,桩蛋白与多种肿瘤密切相关,但桩蛋白在BUC的起病与发展过程中的作用目前尚不明确。本研究观察了BUC组织中桩蛋白的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选取2012年9月~2015年12月昆明医科大学第一附属医院收治的BUC患者93例,男71例,女22例;年龄51~73(59±8.17)岁,其中≤60岁34例、>60岁59例;肿瘤直径(3.41±2.17)cm,其中≤3 cm 27例,>3 cm 66例;组织低分化42例,高分化51例;临床分期T1~T2期44例,T3~T4期49例;有淋巴结转移25例,未发生淋巴结转移68例。纳入标准:①临床病历资料完整,所有患者均知情同意;②术后经病理科确诊为BUC;③为原发性BUC,且未合并其他恶性肿瘤;④术前未经放、化疗及其他辅助抗肿瘤手段治疗;⑤未合并其他严重代谢性疾病;⑥完成随访调查。手术留取BUC组织93例份(观察组),另取37例份正常膀胱组织作为对照(对照组)。
1.2 桩蛋白检测方法 采用免疫组化法。将保存的石蜡包埋标本以间距4 μm连续切片,烤箱中65 ℃烤片过夜,常规脱蜡水化,枸橼酸缓冲液中煮沸(95 ℃)修复,自然冷却后以TBS洗涤2次,以正常山羊血清封闭,孵育30 min,加入一抗桩蛋白单克隆抗体(CST,购于上海北诺生物科技有限公司),阴性对照采用PBS代替,于4 ℃孵育过夜。TBS洗涤3次,加入二抗EnVisionTM+/HRP(DAKO,购于上海北诺生物科技有限公司)37 ℃孵育30 min;DAB显色,苏木素复染。常规制片。结果判定:300倍光学高倍镜下取4个不同视野,每个视野至少含有100个细胞,4视野的计分结果取算术平均数。将染色结果计分分为染色程度计分与染色数目计分,染色程度计分:无染色计0分,浅黄至黄色计1分,黄棕色计2分,褐色计3分;染色数目计分:<5%计0分,5~25%计1分,25%~75%计2分,>75%计3分;程度计分×数目计分得到染色结果总分,其中0~3分视为阴性表达,>3分视为阳性表达。
1.3 随访方法 以患者术后出院为观察起点,利用电话、电子通讯等手段并结合患者复诊记录进行随访调查,随访9~62(39.14±8.62)个月。失访病例已剔除。
1.4 统计学方法 采用SPSS22.0统计软件。计数资料比较采用χ2检验,利用Kaplan-Meier生存曲线分析患者生存率与生存时间。P<0.05为差异有统计学意义。
2 结果
2.1 两组桩蛋白表达比较 观察组及对照组桩蛋白阳性率分别为50.54%(47/93)、0,两组比较,P<0.05。
2.2 桩蛋白表达与BUC临床病理参数的关系 结果见表1。由表1可知,桩蛋白表达与BUC组织分化程度、临床分期、是否发生淋巴结转移有相关性(P均<0.05),而与患者年龄、性别、肿瘤直径无相关性(P均>0.05)。
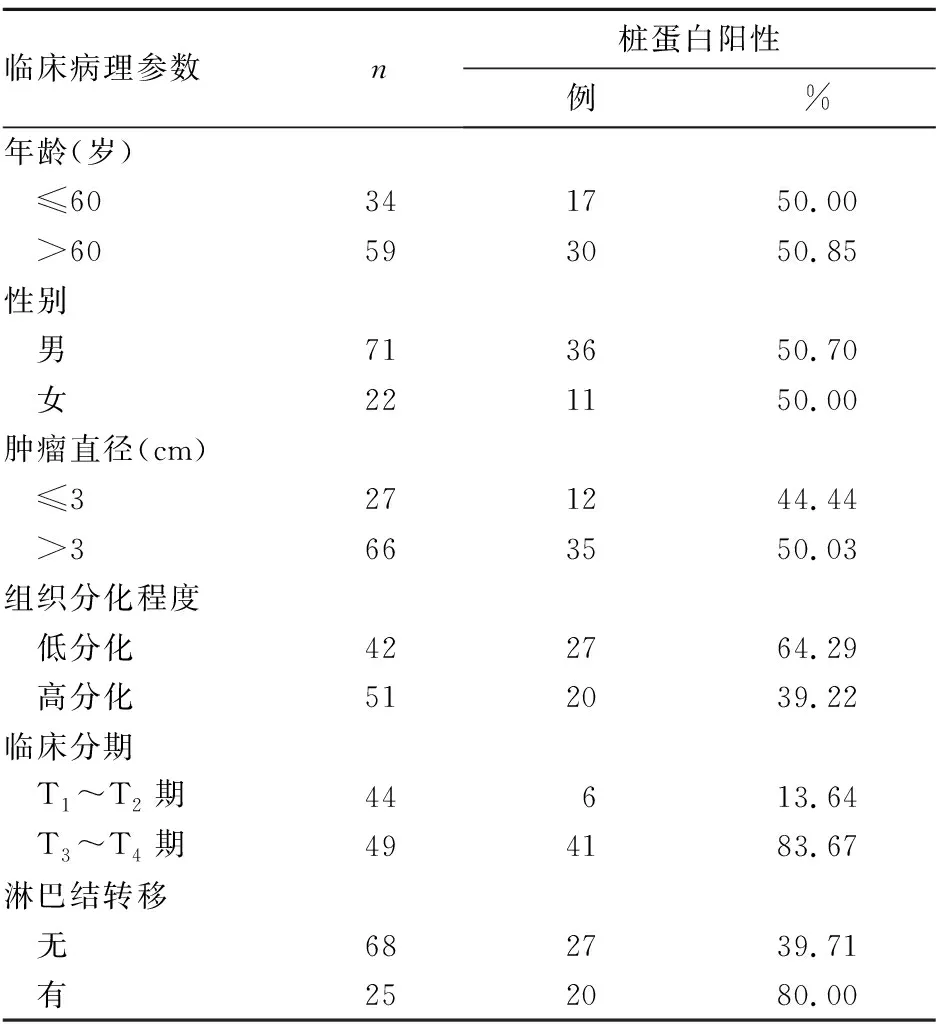
表1 桩蛋白表达与BUC临床病理参数的关系
2.3 桩蛋白表达与BUC患者预后的关系 观察组患者按照桩蛋白表达结果分为桩蛋白阳性表达者(47例)与桩蛋白阴性表达者(46例),随访调查结果制成Kaplan-Meier生存曲线(图1)。桩蛋白阳性表达者生存率为59.57%(28/47)、生存时间(43.99±2.57)个月,桩蛋白阴性表达者生存率为84.78%(39/46)、生存时间(54.41±2.24)个月,两组比较,P均<0.05。
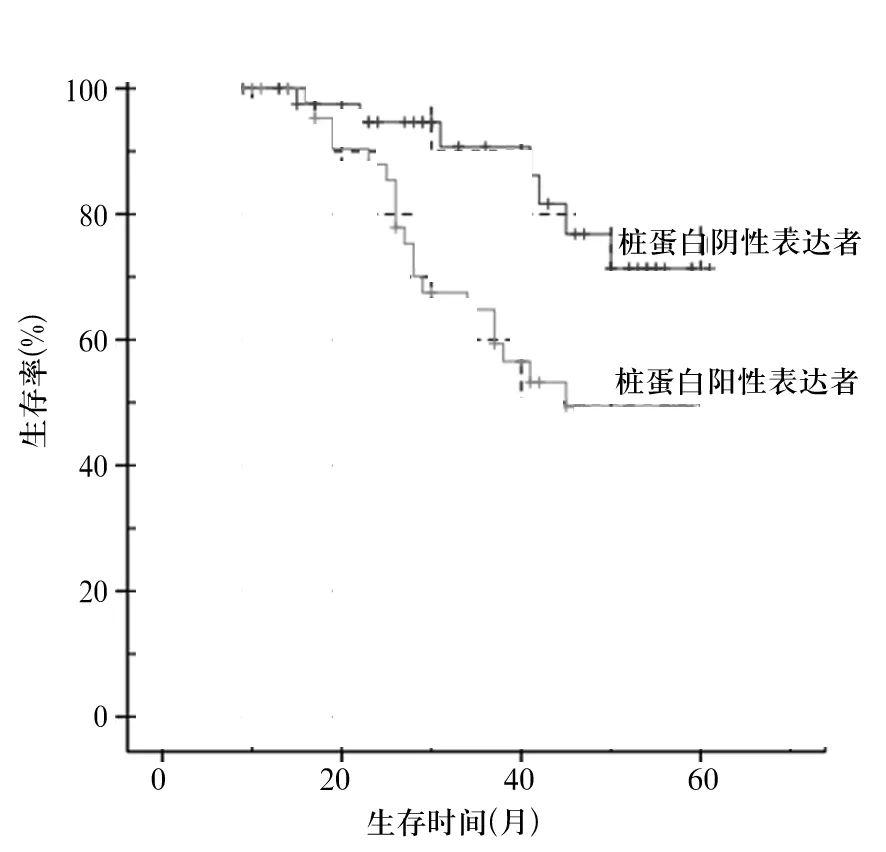
图1 桩蛋白阳性、阴性表达者Kaplan-Meier生存曲线
3 讨论
BUC多起源于上皮细胞,发病初期症状不明显,多为血尿,但可自行减轻或停止,较为隐匿,但恶性程高。在我国,BUC的发病率位居泌尿系统恶性肿瘤之首,也是引发癌症相关死亡的主要病因之一[9]。BUC存在多种生物学行为,临床上公认的治疗难点在于复发容易,预后诊断难[10]。依据BUC的不同细胞生物学行为,一般将其分为两种,非肌层浸润性BUC即表浅性、高分化肿瘤,约占BUC的80%左右,治疗相对容易,但也易复发;肌层浸润性BUC即浸润性、低分化肿瘤,恶性程度较高,一般需要联合治疗。传统BUC的治疗方案以外科手术切除和放化疗为主,但即使联合应用药物膀胱内灌注治疗、光动力治疗等辅助抗肿瘤手段,仍无法明显降低BUC复发率与病死率,同时联合方案的不良反应也较大,给患者带来生理、经济上的多重压力[11,12]。近年来,随着临床技术的发展,非肌层浸润性BUC患者能够选择膀胱内卡介苗作为主要的免疫治疗手段[13];而根治性膀胱切除术为代表的外科手术仍然是治疗肌层浸润性膀胱癌的标准方案,同时该手术对非肌层浸润性BUC也有一定的疗效[14]。合理选择治疗方案一直是影响患者预后与生活质量的关键因素。临床上一般依据临床分期、淋巴结转移等传统肿瘤相关病理参数估计[15]。然而,许多临床病理参数相似的患者术后生存时间差异巨大[16],说明目前的临床病理参数并不能准确反映患者的情况。尽管近年来BUC的诊断方面有许多进展,例如以荧光原位杂交探针为代表的免疫组化相关病理诊断手段,临床上已较多地应用于尿液细胞样本筛查和复发监测[17],但BUC患者的预后却并没有得到明显的改善。因此,深入研究BUC的发生与恶性进展机制,从而指定针对性的诊疗方案成为改善临床诊疗方案的当务之急。
桩蛋白是一种多功能的多结构域蛋白,分子量约68 kD,于SRC基因转染的细胞中最先被发现,是一种能与癌基因结合的细胞连接相关蛋白[18]。桩蛋白主要表达于细胞黏着斑,在平滑肌组织中表达最高,能够通过与结构分子、信号分子的连接参与调控细胞黏着斑的结构,从而影响细胞的黏附与迁移[19]。正常表达的桩蛋白是机体内细胞黏附、分化、繁殖等生理活动的必须,但桩蛋白的异常表达会引起细胞形态的改变,引发细胞黏附能力异常,从而引发多种疾病[20]。肿瘤的原位侵袭、远端浸润与肿瘤细胞的迁移能力密切相关,而细胞的迁移能力是一个由前黏着斑消失伴随新黏着斑形成的动态过程,与细胞的黏附力直接相关[21],因此可以推测黏着斑相关的桩蛋白表达必然影响肿瘤细胞的侵袭力。近期研究[22]显示,由桩蛋白、肉瘤基因(Src)、FAK参与调控的络氨酸磷酸化作用是细胞非依赖性信号转导、增殖、转移的关键步骤。而许多细胞因子正是通过Tyr31/118磷酸化桩蛋白,从而促进或调控肿瘤细胞的黏附、迁移[23~25]。因此,桩蛋白具有成为抗肿瘤治疗新靶点的可能。Zheng等[26]认为,桩蛋白在前列腺癌组织中较正常组织高表达,其表达与前列腺癌病理分级、淋巴结转移密切相关,同时桩蛋白表达较高的患者预后较差。另文献[27~29]报道,桩蛋白在胰腺癌、结直肠癌、乳腺癌等恶性肿瘤中的表达也呈现出类似的作用。因此,初步推测桩蛋白在肿瘤组织中的异常表达与肿瘤的发生、恶性进展密切相关。
本研究显示,桩蛋白在正常膀胱组织中未见阳性表达,而在BUC组织中阳性率为50.54%,提示桩蛋白在BUC组织中的表达异常上调,与前述其他类型肿瘤组织中同样显著升高的效果相似,因此桩蛋白的异常可能与BUC的形成相关。本研究还显示,桩蛋白表达与BUC临床分期、组织分化程度、淋巴结转移密切相关。因此可以推测,桩蛋白在BUC肿瘤细胞中,应当呈现出与其他类型肿瘤细胞中类似的作用,即促进肿瘤细胞上皮-间质转化,增强肿瘤细胞的侵袭力,桩蛋白可能有潜力成为临床上反应BUC患者肿瘤恶性程度的生物标记物之一。本研究还发现,桩蛋白阳性表达者的预后显著差于桩蛋白阴性表达者,提示桩蛋白可以作为BUC患者不良预后的生物标记物。因此,针对桩蛋白表达阳性患者,应加强监护,重视复诊,重点防范BUC的术后复发,以尽可能改善患者预后。
总之,BUC组织中桩蛋白表达升高,其可能参与BUC的发生发展。
