血管性眩晕患者血清Nε-羧甲基赖氨酸、氧化低密度脂蛋白水平变化及其意义
2018-08-03张耀元王立坤常青张继超龚姗姗邹玉安
张耀元,王立坤,常青,张继超,龚姗姗,邹玉安
(河北北方学院附属第一医院,河北张家口 075000)
血管性眩晕是血管病变导致的眩晕,占眩晕病因的3%~7%,其病变主要涉及椎-基动脉系统,包括前庭动脉前支、小脑前下动脉、迷路动脉(内听动脉)、椎动脉、基底动脉等,该处血管形态和功能异常,即在相应的灌注区产生供血不足等一系列的临床症状,主要以眩晕及头晕为主[1,2]。动脉粥样硬化(AS)是血管性眩晕血管病变最重要的原因,指动脉壁的一种非炎性、增生性、退行性的改变。目前,对于血管性眩晕的诊断和预后监测多借助于影像学检查,缺乏有效的、特异度较高的血清学标志物支持。研究[3,4]证实,糖基化终末产物(AGEs)参与心脑血管粥样硬化的病理生理过程,Nε-羧甲基赖氨酸(CML)是AGEs的重要活性成分,以往关于CML的研究多集中于内分泌系统和代谢性疾病方面。随着研究的深入,发现CML在心血管病变中亦有重要作用[5]。氧化低密度脂蛋白(ox-LDL)是LDL发生脂质氧化修饰而形成,其在AS病灶中呈高表达,而在正常动脉中无表达或低表达,且其水平的高低与AS病变发展密切相关。本研究观察了血管性眩晕患者血清CML、ox-LDL水平变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选取河北北方学院附属第一医院2016年1月~2017年6月收治的血管性眩晕患者55例(血管性眩晕组),男25例、女30例,年龄(63.42±10.22)岁,BMI(21.95±2.56)kg/m2;非血管性眩晕患者40例(非血管性眩晕组),男18例、女22例,年龄(62.41±12.58)岁,BMI(21.55±2.81)kg/m2。血管性眩晕组纳入标准[6,7]:①发病在1周之内;②主诉为头晕或眩晕;③头部CT、CTA、MRI、MRA和颈动脉彩超提示血管病变包括颅内外动脉狭窄、闭塞、血管迂曲、发育异常、粗细不均或血管舒缩紊乱等;④有吸烟、高血脂、高血糖等血管病变高危因素。非血管性眩晕组纳入标准:①发病在1周之内;②血管评估无明星异常;③无神经系统缺损症征;④确诊为良性阵发性位置性眩晕、梅尼埃病、前庭神经炎等非血管疾病。血管性眩晕组和非血管性眩晕组排除标准:①发病2周前严重的感染病史;②近期服用抗凝及抗血小板聚集药物;③伴严重的冠心病、肺心病、免疫性疾病、内分泌疾病;④严重的肝肾功能异常;⑤恶性肿瘤患者。另选40例既往未发生眩晕的健康体检者作对照(健康对照组),男20例、女20例,年龄(65.43±7.15)岁,BMI(22.04±2.13)kg/m2。本实验按前瞻性、对照临床研究方法设计,经院伦理委员会批准,受试者均签署知情同意书。
1.2 血清CML、ox-LDL检测方法 采用ELISA法检测。采集所有入选对象清晨空腹静脉血12 mL,以3 000 r/min离心20 min,取上清,分装后置于-80 ℃冰箱冻存备用。样本孔中加入含CML、ox-LDL的样本,后加入辣根过氧化物酶标记的检测抗体,封孔,37 ℃恒温温育,每孔复加入底物,避光温育,在450 nm波长处测定各孔的吸光度值(OD值),严格按照试剂盒步骤说明书进行操作,应用美国Bio-rad酶标仪,于450 nm波长处测定各孔的OD值,绘制标准曲线,检测各样本中CML、ox-LDL。
1.3 血清CML、ox-LDL诊断血管性眩晕的效能分析 绘制血清CML、ox-LDL单独及两者联合诊断血管性眩晕的ROC曲线,分别计算曲线下面积,采用最大约登指数法计算CML、ox-LDL诊断血管性眩晕的截断值,并计算各自的灵敏度及特异度。

2 结果
2.1 各组血清CML、ox-LDL水平比较 血清CML、ox-LDL水平见表1。

表1 各组血清CML、ox-LDL水平比较
注:与非血管性眩晕组、健康对照组比较,*P<0.05。
2.2 血管性眩晕组血清CML与ox-LDL的相关性 血管性眩晕组患者血清CML与ox-LDL呈明显正相关(r=0.455,P<0.05)。
2.3 血清CML、ox-LDL单独及联合检测诊断血管性眩晕的效能 血清CML、ox-LDL检测诊断血管性眩晕的ROC曲线下面积分别为0.821和0.701,联合检测诊断血管性眩晕ROC曲线下面积为0.938,约登指数最大时血清CML、ox-LDL水平截断值分别为475.9 ng/mL和154.3 μg/mL,此时血清CML水平检测诊断此病的灵敏度和特异度分别为69.5%、70.1%,血清ox-LDL水平检测诊断此病的灵敏度和特异度分别为58.3%、65.1%,两者联合检测诊断此病的灵敏度和特异度分别为88.3%、84.5%。两者联合检测诊断血管性眩晕的ROC曲线下面积、灵敏度和特异度均明显高于血清CML、ox-LDL单独检测(P均<0.05),详见图1。
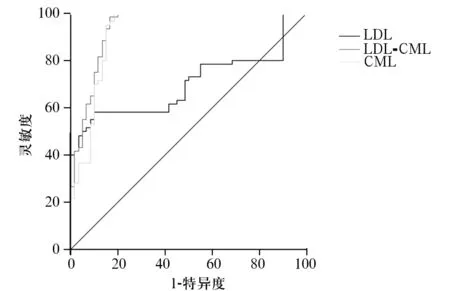
图1 血清CML、ox-LDL诊断血管性眩晕的ROC
3 讨论
血管性眩晕是以椎-基底动脉系统病变为主的多种脑血管病变导致前庭系统(前庭器官、前庭神经及脑干的诸前庭核)供血不足,而引起的以眩晕为主并伴恶心、呕吐等症状的神经系统疾病。以往研究证实,AS引发的血流动力学异常是血管性眩晕主要的病因。文献[8,9]报道,氧化应激、血管内皮细胞损伤、各种炎性因子异常表达、细胞外基质大量降解均参与了AS的形成,降低了血管弹性,最终导致脑缺血的发生。
近年来,随着经颅多普勒超声、颈动脉彩超、CT、CTA、MRI(MRA)、DSA等神经影像学技术的不断发展和进步,对于血管性眩晕的诊断,尤其是对病变血管结构和功能的评估有了很大提高,有效的指导了临床。但对于血管性眩晕的早期诊断,目前仍缺乏灵敏度、特异度高的血清学标记物支持。
CML是首个在机体内从AGEs中分离出来重要活性成分,具有交联结构,但无荧光特性[10]。CML通过与细胞膜受体结合,影响细胞功能,如巨噬细胞、血管内皮细胞、系膜细胞等,参与组织老化及信号转导等重要过程,在AS、肾病、冠心病、糖尿病等病变过程中发挥重要作用[11~15]。华强等[16]研究证实,在糖尿病早期患者机体内已启动蛋白质等的非酶糖化反应,并诱导机体产生氧化应激,从而诱导AS等并发症的形成,若初诊时即开始应用有效药物清除AGEs或CML,可有效预防和延缓糖尿病慢性并发症的发生发展。Kizer等[17]发现,CML与急性冠脉综合征(ACS)有密切相关性,其水平可能反映ACS病变严重程度。此外CML能诱导单核巨噬细胞过度分泌生长促进因子,并不断吞噬ox-LDL,同时向内皮下迁移,导致血管内皮细胞增厚、增生,促进AS病变。Wang等[18]认为,CML/RAGE轴可能通过诱导巨噬细胞凋亡及主动脉平滑肌细胞向成骨细胞分化的机制在糖尿病动脉粥样硬化性钙化中发挥重要作用。此外,CML还能与内皮细胞反应,直接改变细胞膜的渗透性,增加血浆蛋白的渗透性,最终引起血栓。
ox-LDL是LDL发生脂质氧化而形成,其仅特异度存在于动脉硬化病灶,而在正常动脉中无表达。ox-LDL能抑制血管内皮细胞的NO合成和释放,降低血管舒张及弹性功能,诱导PECAM-1、sVCAM-1、sICAM-1等血管内皮黏附因子和MCP-1、CCL3L1、CXCL14等趋化因子的表达,抑制抗凝物质的产生,促进AS的形成[19,20]。ox-LDL通过诱导内皮细胞释放IL-1、IL-6、TNF-β等多种细胞因子,从而导致血管斑块破溃、血栓形成,加速AS病变向更为复合的病变发展[21]。ox-LDL还能被巨噬细胞吞噬形成泡沫细胞,后者不断沉积形成脂质条纹,并损伤血管平滑肌细胞和内皮细胞,加速AS的形成[22]。此外ox-LDL还可通过与血小板表面黏附的各类脂质蛋白结合,激活血小板,促使血小板黏附、聚集,最终导致各种动脉粥样硬化性疾病的发生[23]。因而,ox-LDL水平的高低与AS病变发展密切相关[24]。
本研究显示,血管性眩晕组血清CML、ox-LDL水平高于非血管性眩晕组和健康组,且血清CML水平与ox-LDL呈正相关,即血清CML能诱导血ox-LDL表达的上调,因而考虑血清CML与ox-LDL协同参与了血管性眩晕的发生发展。研究[25]表明,CML通过抑制PI3K/Akt信号转导通路,抑制巨噬细胞源性泡沫细胞向外迁移,导致泡沫细胞大量聚集,同时正反馈于ox-LDL,加速其被巨噬细胞吞噬,最终促进AS病变。本研究还显示,血清CML、ox-LDL单独和两者联合检测的ROC曲线下面积均高于0.5,且两者联合检测的特异度和灵敏度均明显高于单独检测,因而表明两者均可作为血管性眩晕诊断的血清学指标,但两者联合检测更加准确。
总之,血管性眩晕患者血清CML、ox-LDL水平升高,检测两指标有助于此病的诊断,且两者联合检测的诊断效能优于单独检测。
