帕金森病患者运动神经电生理特点及其并发周围神经损害危险因素分析
2018-08-03程莉晶李姝戴丹李云
程莉晶,李姝,戴丹,李云
(1大理大学,云南大理671000;2金山医院;3大理大学第一附属医院)
帕金森病(PD)又称特发性帕金森病,是中老年常见的神经系统退行性疾病及锥体外系疾病,多在60岁左右发病。PD患者的临床表现主要包括运动迟缓、姿势步态障碍、静止性震颤和肌强直[1],患者多伴有睡眠障碍、抑郁、便秘等非运动症状。PD患者诉疼痛和感觉障碍者很多,这多是由肌强直、僵硬、神经痛等引起,而感觉障碍多有麻木、烧灼、刺痛等,这种感觉异常与运动障碍严重程度和药物治疗无关,有时可先于运动症状出现[2],是导致患者最苦恼的非运动症状,周围神经病变可能是导致上述感觉异常的原因之一。神经电生理检查是检查周围神经病变的主要检查手段,并且可定位受损神经及神经损害的范围和程度,检查结果客观、可重复,是对神经功能损害评价最有价值的检查手段。目前,国内外大多数研究及重点主要在于改善PD所致的肌强直、震颤等运动症状,但对于PD患者并发周围神经病变的研究至今报道很少。本研究观察了PD患者神经电生理特点,另分析其并发周围神经损害的危险因素,旨在早期对危险因素较多患者进行神经电生理检查、及早发现PD患者周围神经病变,并给予治疗,减轻患者痛苦,提高患者生活质量。
1 资料与方法
1.1 临床资料 选取2015年6月~2017年5月大理大学第一附属医院收治的PD患者63例(观察组),男36例,女27例;年龄(61.8±4.9)岁;诊断均符合2006中华医学会神经病学分会PD的诊断标准,并排除肿瘤、中毒、酗酒、糖尿病、甲状腺疾病等。观察组根据H-Y分级[3]标准分为早期者(1~2.5级)41例及中晚期者(3~5级)22例。另随机选择年龄、性别相匹配的健康成人25例作对照(对照组),男15例,女10例;年龄(59.9±4.5)岁。观察组及对照组均排除其他神经系统疾病及肿瘤、呼吸、消化等其他系统疾病。

1.3 一般资料收集及血液学检测 收集两组入选对象的性别、高龄(≥65岁)、受教育程度高(≥6 a)、高剂量抗PD药物、H-Y分级(中晚期)等资料。入组患者需空腹至少8 h以上,第2天清晨采集空腹血清5 mL行血常规、血生化检测,餐后2 h后再次采集血清2 mL行餐后2 h血糖检测。4 000 r/min离心约5 min,采用样品前处理系统PAM和日立7600生化检测仪进行空腹血糖、谷丙转氨酶、肌酶、肌酐、血脂(TC、TG)进行检测。生化异常标准:根据第七版诊断学标准[5];高血糖标准:未达到糖尿病标准,空腹血糖受损:空腹血糖6.1~7.0 mmol/L或糖耐量异常IGT:餐后2 h血糖7.8~11.1 mmol/L[WHO糖尿病专家委员会(1999)提出的诊断]。高血压标准:未使用降压药的情况下收缩压≥140 mmHg和(或)舒张压≥90 mmHg。

2 结果
2.1 两组运动神经末梢潜伏期比较 运动神经末梢潜伏期比较见表1。
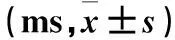
表1 两组运动神经末梢潜伏期比较
注:与正常组比较,aP<0.05;与早期者比较,bP<0.05。
2.2 两组运动神经末梢波幅比较 运动神经末梢波幅比较见表2。
2.3 两组感觉神经传导速度比较 感觉神经传导速度比较见表3。
2.4 两组感觉神经末梢波幅比较 感觉神经末梢波幅比较见表4。
2.5 PD伴周围神经损害单因素分析结果 PD伴周围神经损害、不伴周围神经损害患者中高龄(≥65岁)者分别为25、24例,高血糖者分别为20、16例,高肌酶者分别为18、7例,使用高剂量抗PD药物者分别为19、12例,H-Y分级中晚期者分别为16、9例,两者比较,P均<0.05。PD伴周围神经损害、不伴周围神经损害患者中男性分别为14、22例,受教育程度高(≥6 a)者分别为9、16例,高谷丙转氨酶者分别为14、20例,高肌酐者分别为4、8例,高血脂者分别为8、9例,血常规异常者分别为16、17例,高血压者分别为17、21例,两者比较,P均>0.05。
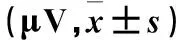
表2 两组运动神经末梢波幅比较
注:与正常组比较,aP<0.05;与早期者比较,bP<0.05。
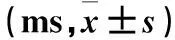
表3 两组感觉神经传导速度比较
注:与正常组比较,aP<0.05;与早期者比较,bP<0.05。
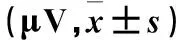
表4 两组感觉神经末梢波幅比较
注:与正常组比较,aP<0.05;与早期者比较,bP<0.05。
2.6 PD伴周围神经损害多因素分析结果 将单因素分析中有统计学差异的结果,即高龄(≥65岁)、高血糖、高肌酶、使用高剂量抗PD药物、H-Y分级中晚期作为自变量放入二分类Logistic逐步回归方程,结果显示H-Y分级中晚期、使用高剂量抗PD药物最终留在了回归方程中,提示中晚期PD患者及使用高剂量抗PD药物对PD患者周围神经损害影响最大。(详见5)。
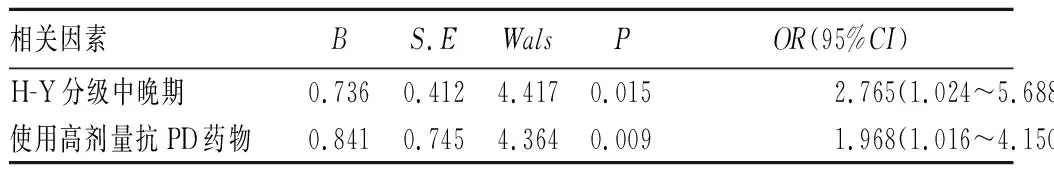
表5 PD伴周围神经损害多因素分析结果
3 讨论
PD的主要病理改变是纹状体DA含量显著性减少,以及黑质残存神经元胞质内出现嗜酸性包涵体,多巴胺能神经元的变性坏死。PD的病因国内外有很多论证,遗传因素、环境因素、脑外伤、氧化应激、不良生活习惯、年龄老化等均可能参与PD发病过程[6]。PD起病隐袭,进展缓慢,主要临床表现包括静止性震颤、肌张力增高、运动迟缓和姿势步态障碍。目前,国内治疗PD应用最为广泛的药物是左旋多巴,而脑深部电刺激是治疗中晚期PD患者最为可行的一种手术治疗方法[7]。大部分治疗方法都是针对PD患者运动症状,但很多患者可伴有认知功能障碍、自主神经功能障碍和感觉障碍等非运动症状[8],且患者主诉神经痛及感觉异常,感觉异常会严重影响患者的生存质量。PD伴发周围神经病变一直没有受到临床医师的重视,相关研究也不多。随着医学的发展和PD患者对生活质量要求的提高,了解PD患者伴周围神经病变的发病机制及危险因素成为预防和治疗PD并发症的关键[9]。一项研究[10]发现,38%的PD患者存在有疼痛主诉。另有研究表明,感觉异常不仅有肢体疼痛,还可伴有麻木、烧灼、刺痛等。同时根据文献[11,12]报道,PD患者除锥体外系受损外,可能还存在中枢神经系统及周围神经受损。PD患者可能表现为一种难以定位的烧灼痛、刀割痛、瘙痒、或难以描述的紧张不适感,基底-丘脑皮质环路多巴胺的缺乏导致疼痛调节异常可能是疼痛产生的基础[13~15]。
PD患者易并发周围神经病变,表现为深浅感觉减退、腱反射减弱以及血管性运动功能障碍,其发病机制可能为神经轴索或髓鞘的施万细胞受损、后根神经节损伤等[16]。研究[17,18]发现,PD患者受到不同程度的周围神经损害。本研究显示,PD患者周围神经病变发生率为42.9%,其中早期者发生率为29.3%、中晚期者发生率为68.2%,对照组发生率为24.0%,中晚期者发生率明显高于早期者及对照组。提示中晚期PD患者更易发生周围神经损害。朱灿敏等[17]还发现,PD患者感觉神经传导速度明显减慢及运动神经运动神经末梢潜伏期明显延长、波幅明显降低。本研究显示,PD患者运动神经末梢潜伏期延长,波幅降低,感觉神经传导速度减慢、波幅下降,而中晚期患者损害更明显。
目前,PD患者周围神经病变的发生机制尚不明确。国外有研究表明,PD患者的丘系感觉传导路径的错误加工,导致感觉运动整合异常[19]。本研究发现,中晚期PD患者、高剂量抗PD药物更易发生周围神经损害。而大量国内外相关报道,长期、高剂量抗PD药物可引起同型半胱氨酸水平升高,叶酸和维生素B12下降[20~22],PD患者周围神经病变与血清叶酸、维生素B12水平呈负相关,血清叶酸、维生素B12水平越低,发生周围神经病变的可能性越大,病情越重[23,24]。而中晚期患者由于病程长、抗PD药物剂量大更易发生周围神经损害。但还有大量研究[10,25,26]认为,PD患者伴周围神经损害可能还与路易小体沉积、多种基因异常、丘系感觉传导路径的错误加工等有关。本研究还发现高龄、高血糖、高肌酶等因素也可能导致PD患者周围神经损害,这可能是由于高龄、高血糖及高肌酶患者体内代谢异常,周围神经髓鞘损伤从而出现周围神经损害,具体原因仍需进一步证实。
总之,PD患者存在周围神经损害,表现为运动神经末梢潜伏期延长、波幅降低,感觉神经传导速度减慢、波幅下降;中晚期及使用高剂量抗PD药物患者更易出现周围神经损害。另本研究由于入组数量较少,实验结果可能存在一定影响。而且条件有限,没有同时检测同型半胱氨酸、叶酸、维生素B12等,PD伴周围神经损害病因及发病机制需进一步探讨。
