FGF4在乳腺癌组织中的表达变化及对乳腺癌细胞株增殖、迁移能力的调控作用
2018-08-03曲杰魏依兰吕喜英李青山
曲杰,魏依兰,吕喜英,李青山
(承德医学院附属医院,河北承德 067000)
乳腺癌是女性最常见的恶性肿瘤之一,已位居妇女恶性肿瘤死因的首位,全世界每年约有120万妇女患上乳腺癌[1]。我国乳腺癌的发病率虽相对于西方欧美国家较低,但随着近年人们生活水平的提高和生活方式的改变,其发病率呈上升趋势。近年来,乳腺癌的诊治取得了长足的进展,尤其是在外科治疗方面的发展取得了较好的效果。与此同时,对乳腺癌生物学行为的认识也不断深入,利用现代分子生物学技术对肿瘤的发生发展进行了进一步的阐述,针对乳腺癌的预后,尤其是已发生侵袭转移的晚期患者预后较差,侵袭转移机制亦已成为当今的研究热点[2]。成纤维生长因子4(FGF4)是被FGF家族基因编码的一种膜蛋白,它参与细胞生长、分化、侵袭以及胚胎发育、肢体发育、骨骼形成、组织修复、肿瘤复发等多种过程[3~5]。FGF4被认为是癌基因之一,其临近的FGF3同样在11号染色体,在很多肿瘤中被证实是扩增的基因。最近研究表明,FGF4高表达于食管鳞状细胞癌。FGF4作为基因组组织器调控大量基因的表达,在肝癌中发挥巨大作用。然而,到目前为止有关FGF4在乳腺癌中的表达情况及相关作用尚不清楚。本研究观察了FGF4在人乳腺癌组织和乳腺癌细胞株中的表达,并在此基础上利用重组质粒和RNA干扰技术构建过表达FGF4、敲除FGF4的稳定细胞株,观察其对乳腺癌细胞株增殖、迁移能力的调控作用。
1 材料与方法
1.1 材料 乳腺癌组织及对应癌旁正常乳腺组织购自西安奥美生物科技有限公司;人正常乳腺细胞株MCF-10A、低转移乳腺癌细胞株T47D、高转移乳腺癌细胞株MDA-MB-231均购于American Tissue Culture Collection(ATCC),在本实验室常规传代;TRIzol、RNA酶抑制剂、RNA逆转录试剂盒及SYBR Green实时定量试剂盒均购自Invitrogen公司;PCR引物、shRNA由华大基因合成;Anti-FGF4抗体购自Proteintech Group;Western ECL发光试剂盒购自武汉三鹰公司;RPMI1640培养基和胎牛血清购自Gibco公司。限制性内切酶EcoRⅠ/XholⅠ、琼脂糖凝胶电泳上样缓冲液购自Thermo 公司;Taq DNA聚合酶、FastPful DNA聚合酶、DNA连接酶购自北京全式金生物技术有限公司;DNA切胶纯化试剂盒、质粒小提试剂盒购自博迈德生物公司;RIPA购自Solibro公司。
1.2 乳腺癌、癌旁组织FGF4 mRNA检测 采用实时定量PCR法。将40例份乳腺癌组织及40例份正常癌旁乳腺组织捣碎、碾碎,分别抽提1 μg总mRNA逆转为cDNA。以SYBR Green为染料,实时定量PCR检测样品FGF4基因在mRNA表达的相对水平。设计并合成引物,以GAPDH作为内基因。FGF4上游引物5′-GAGCAGCAAGGGCAAGCTCTA-3′,下游引物5′-ACCTTCATGGTGGGCGACA-3′;GAPDH上游引物5′-CATCACCATCTTCCAG GAGCG-3′,下游引物5′-TGACCTTGCCC ACAGCCTTG-3′。以95 ℃、10 min,95 ℃、20 s,55 ℃、20 s,72 ℃、20 s为本实验反应条件,共重复40循环,最终以72 ℃、5 min充分延伸。PCR结束采用溶解曲线确定产物特异性。由PCR反应曲线得到阈值循环数(Ct值),FGF4 mRNA相对表达量用2-ΔΔCt法获取。
1.3 MCF-10A、T47D、MDA-MB-231细胞FGF4 mRNA和蛋白检测 ①细胞培养:MCF-10A细胞采用含10%马血清的DMEM培养液进行培养;T47D细胞采用含10%胎牛血清的RPMI1640培养液进行培养;MDA-MB-231细胞含10%胎牛血清的DMEM培养液进行培养。培养条件均为37 ℃、饱和湿度、5% CO2,取对数生长期细胞备用。②FGF4 mRNA检测:采用RT-PCR法。收集MCF-10A、T47D、MDA-MB-231细胞,分别抽提总的mRNA,并分别进行逆转录得到cDNA,以Taq酶为催化剂,PCR检测FGF4基因在mRNA表达的相对水平。所用引物同“1.2”,以95 ℃、10 min,95 ℃、20 s,55 ℃、20 s,72 ℃、20 s为反应条件,共重复32个循环,最后以72 ℃、5 min充分延伸。PCR结束加6×loading buffer震荡混匀,取等量扩增产物进行琼脂糖凝胶电泳,凝胶成像系统拍照,观察比较结果,检测灰度值。实验结果均为3次独立重复实验结果。③FGF4蛋白检测:采用Western blotting法。分别取约106个对数生长期的MCF-10A、T47D、MDA-MB-231细胞,提取各类细胞的总蛋白(加入300 μL RIPA,冰上裂解30 min后,移至1.5 mL的EP管中,以13 000 r/min在4 ℃条件下离心30 min,取上清液),加5×loading buffer[250 mmol/L的Tris-HCl(pH6.8)、10%SDS、0.5%BPB、50%甘油,5%β-巯基乙醇]煮沸10 min,置于-20 ℃保存。BCA法定量。进行SDS-PAGE电泳分离并转至PVDF膜,用新鲜配制的10%脱脂奶粉/TBST摇床上封闭1 h,加入FGF4鼠单克隆抗体(Santa Cruz,1∶1 000)及抗β-actin抗体(1∶20 000),4 ℃反应过夜。TBST液洗涤3次,每次15 min,加入辣根过氧化物酶标记的二抗(1∶5 000)室温孵育1 h,然后用TBST液进行3次洗涤,15 min每次,最后用化学发光法检测,X光片显影记录相应结果,以用灰度值表示。
1.4 过表达FGF4的T47D稳定细胞株T47D-FGF4-oe及只转染pCDNA3.1的细胞株T47D-NC中FGF4蛋白检测和细胞增殖、迁移观察 ①构建过表达FGF4的T47D稳定细胞株:参照文献[6],设计针对FGF4 mRNA全长的引物,上游引物5′-GGGAATTCGCCGCCATGTCGGGGCCCGGGACGGCCGCGGTA-GCGC-3′,下游引物5′-CCCTCGAGGGAGGGTCA-CAGCCTGGGGAGGAAGTGGGTGACCTTC-3。用Fa-
stPful DNA聚合酶扩增出目的基因,对表达载体pCDNA3.1和FGF4基因片段分别进行EcoRⅠ和XholⅠ双酶切,酶连,转化,鉴定获得pCDNA3.1-FGF4重组质粒。因为Neo抗性基因存在于pCDNA3.1上,所以可利用G418(700 μg/mL)筛选FGF4过表达的稳定细胞株和pCDNA3.1空载细胞株,10 d后即可得到表达FGF4的稳定细胞株T47D-FGF4-oe和只转染pCDNA3.1细胞株T47D-NC(作为阴性对照组)。②细胞增殖能力观察:采用MTT实验。分别抽取100 μL的T47D-NC、T47D-FGF4-oe细胞,接种于96孔板中,并于每孔中加入完全培养基;每种细胞铺3个复孔。在培养各类细胞0、24、36、72 h分别加10 μL/孔的MTT溶液(5 mg/mL用PBS配制,pH7.4),继续4 h后停止培养,吸弃孔内上清液。每孔加DMSO 150 μL,避光摇床振荡15 min,让结晶物充分融解。在酶联免疫检测仪上取490 nm波长处测定各孔的OD值,记录结果,横坐标是时间,纵坐标是OD值,绘制细胞生长曲线。③迁移能力观察:采用细胞划痕实验。在6孔板上分别接种T47D-NC、T47D-FGF4-oe细胞,待细胞贴壁长满后,划痕,用PBS冲洗2~3遍,换培养基为无血清培养基,并在0、24 h时分别拍照记录,观察划痕愈合的情况。
1.5 敲除FGF4的细胞株MDA-MB-231-FGF4-si及只转染pCDNA3.1细胞株MDA-MB-231NC中FGF4蛋白检测和细胞增殖、迁移观察 ①敲除FGF4构建稳定表达FGF4-shRNA的细胞株:参照文献[6],采集MDA-MB-231,构造针对FGF4的siRNA序列,根据已发表文献有较好干扰效果的siRNA序列[7]:5′-CGAUGAGUGCACGUUCAAGdTdT-3′,3′-dTdTGCUA-CUCACGUGCAAGUUC-5′,将其克隆到pGFP-V-RS载体上,用Puromincin(2 μg/mL)筛选,过程同“1.4”获得稳定表达FGF4-shRNA的细胞株,即MDA-MB-231-FGF4-si,只转染pCDNA3.1的细胞株MDA-MB-231NC(作为对照组)。②增殖能力观察:采用MTT实验。分别抽取100 μL的MDA-MB-231-NC、MDA-MB-231-FGF4-si细胞,接种于96孔板中,并于每孔中加入完全培养基;每种细胞铺3个复孔。在培养各类细胞0、24、36、72 h时分别加10 μL/孔的MTT溶液(5 mg/mL用PBS配制,pH7.4),继续4 h后停止培养,吸弃孔内上清液。每孔加DMSO 150 μL,避光摇床振荡15 min,让结晶物充分融解。在酶联免疫检测仪上取490 nm波长处测定各孔的OD值,记录结果,横坐标是时间,纵坐标是OD值,绘制细胞生长曲线。③细胞迁移能力观察:采用细胞划痕实验。在6孔板上分别接种MDA-MB-231-NC、MDA-MB-231-FGF4-si细胞,待细胞贴壁长满后,划痕,用PBS冲洗2~3遍,换培养基为无血清培养基,并在0、24 h时分别拍照记录,观察划痕愈合的情况。

2 结果
2.1 乳腺癌、癌旁组织中FGF4 mRNA比较 乳腺癌、癌旁组织中FGF4 mRNA相对表达量分别为1.68±0.13、0.32±0.12,两者比较,P<0.05。
2.2 MCF-10A、T47D、MDA-MB-231细胞FGF4 mRNA和蛋白灰度值比较 MCF-10A、T47D、MDA-MB-231细胞FGF4 mRNA灰度值分别为0.27±0.11、1.26±0.13、1.87±0.15,MCF-10A、T47D细胞分别与MDA-MB-231细胞比较,P均<0.05。MCF-10A、T47D、MDA-MB-231细胞FGF4蛋白灰度值分别为0.23±0.06、1.03±0.10、1.72±0.17,两两比较,P均<0.05。
2.3 T47D-FGF4-oe细胞及T47D-NC细胞的FGF4蛋白表达和细胞增殖、迁移能力比较 T47D-FGF4-oe、T47D-NC细胞FGF4蛋白灰度值分别为1.27±0.10、0.55±0.08,两者比较,P<0.05。T47D-FGF4-oe、T47D-NC细胞增殖能力比较见表1,由表1可知,T47D-FGF4-oe细胞的增殖速度高于T47D-NC细胞。T47D-FGF4-oe、T47D-NC细胞迁移能力比较见图1,由图1可知,T47D-FGF4-oe细胞的划痕距离小于T47D-NC细胞。
2.4 MDA-MB-231-FGF4-si细胞及MDA-MB-231-NC细胞的FGF4蛋白表达和细胞增殖、迁移能力比较 MDA-MB-231-FGF4-si、MDA-MB-231-NC细胞FGF4蛋白灰度值分别为0.61±0.07、1.89±0.14,两者比较,P<0.05。MDA-MB-231-FGF4-si、MDA-MB-231-NC细胞增殖能力比较见表1,由表1可知,MDA-MB-231-FGF4-si细胞的增殖速度低于MDA-MB-231-NC细胞。MDA-MB-231-FGF4-si、MDA-MB-231-NC细胞迁移能力比较见图2,由图2可知,MDA-MB-231-FGF4-si细胞的划痕距离大于MDA-MB-231-NC细胞。

表1 细胞增殖能力比较
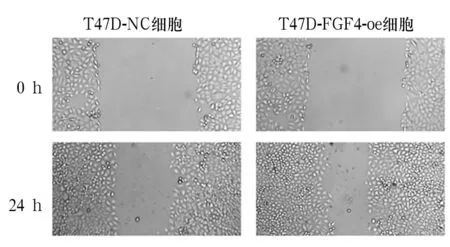
图1 过表达FGF4对T47D细胞迁移能力的影响
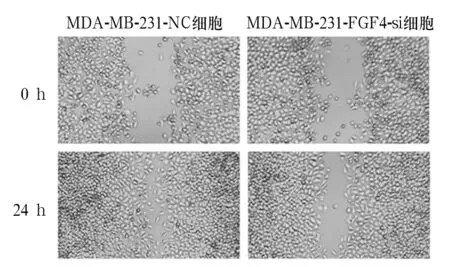
图2 干扰FGF4对MDA-MB-231细胞迁移能力的影响
3 讨论
乳腺癌是源于乳腺腺上皮组织的恶性肿瘤,女性占99%,是威胁女性生命健康最为频发的恶性肿瘤之一。乳腺癌发病率呈攀升趋势,并向年轻化发展(<35岁),影响人类发展,外科手术治疗仍是早、中期乳腺癌患者的首选治疗方式[8,9]。而乳腺癌细胞的早期转移和复发是引起乳腺癌患者死亡的主要原因,也是乳腺癌治疗中的最大难题之一。乳腺癌转移是恶性肿瘤最基本的生物特征,是一个极其复杂、涉及肿瘤与宿主之间相互作用的多步骤的过程,受许多相关基因(CXCR4、CYP1A1、COMT等)的调控[10~12],所以研究肿瘤转移发生过程中的潜在分子机制具有重要意义[13]。
成纤维细胞生长因子(FGFs)是一类由FGF基因家族编码的结构相关的蛋白质,到目前为止FGF家族已发现至少有23种。FGFs和存在于细胞表面的FGFs受体(FGFRs)结合,将信号传递到胞内,进而激活RAS-MAPK、PI3K-AKT、PKC等信号通路,来调控细胞复制、存活、迁移和分化过程。并介导无数的生物学和病理生理学过程,包括血管生成、伤口愈合、胚胎发育、代谢调节和肿瘤增殖、转移等[14~19]。近年研究者发现了FGF家族基因编码的一种膜蛋白FGF4,它涉及到肿瘤细胞分裂、生长、侵袭及胚胎发育、组织修复、肿瘤复发等[20~22]。
Wang等[23]首次发现人乳腺癌细胞系表达FGF4,转染FGF4的HBL100能使裸鼠成瘤,但没有深入研究。后来有学者发现,FGF4作为癌基因在食管鳞状细胞癌、卵巢癌[24]、肝细胞癌[25]、肺腺癌[26]等中高表达。为了检测FGF4在乳腺癌中的表达情况,本文通过实验发现乳腺癌组织中FGF4 mRNA表达高于癌旁组织;T47D、MDA-MB-231细胞中FGF4蛋白和mRNA表达水平也高于MCF-10A,MDA-MB-231表达高于T47D。研究结果证明,FGF4与乳腺癌的增殖和转移密切相关。为进一步检测FGF4对乳腺癌细胞增殖和转移的影响,我们利用构建过表达FGF4的T47D稳定细胞株和敲除FGF4的MDA-MB-231稳定细胞株进行MTT和划痕实验,实验证实FGF4对癌细胞的生长及转移有显著正向调控作用。
总之,FGF4在乳腺癌中呈高表达,并有促进乳腺癌细胞株增殖、转移能力的作用。但具体调控的基因和分子机制尚不清楚,有待于进一步研究。本文了解并研究FGF4与乳腺癌侵袭转移的关系,将有望以其作为治疗靶点及生物标志物,控制乳腺癌转移,提高患者生存质量,具有良好的临床应用前景。
