低氧环境下中等强度运动对老年T2DM大鼠骨密度、胰岛素敏感性影响研究
2018-08-02程加秋张庭然
程加秋 张庭然
1. 重庆幼儿师范高等专科学校,重庆 404047
2. 西南大学体育学院国家体育总局体质评价与运动机能监控重点实验室,重庆 400715
我国于2010年由老龄化社会进入深入老龄化社会,2020年预计会进入“超级老龄化”社会。在此背景下各种慢性代谢疾病发病率持续上升,JAMA杂志报道,我国成人2型糖尿病(type 2 diabetes mellitus,T2DM)患病率高达10.9%,糖尿病前期流行率达到35.7%,糖尿病不仅危害人民健康,还令整个社会背上巨大经济包袱,糖尿病的高发已经成为严重的社会问题。糖尿病是由于胰岛素分泌缺陷和其生物学作用障碍引起的以高血糖为主要特征的代谢性疾病[1]。糖尿病主要分1 型糖尿病 (type 1 diabetes mellitus, T1DM)、2型糖尿病、其他特殊类型和妊娠糖尿病、继发性糖尿病。大量研究证实2型糖尿患者进行长期规律运动能够改善糖尿病导致的代谢紊乱、提高其胰岛素敏感性。所以目前运动处方主要在2型糖尿病临床治疗中使用。近年来许多研究显示低氧环境下的持续运动能缓解胰岛素抵抗现象、改善糖脂代谢,促进胰岛素敏感性恢复[2]。其机制可能是低氧刺激诱发神经反射、激素分泌等应激变化,导致人体优先利用糖进行供能[3]。当机体处于低氧环境,由于空气中氧含量较低,出现氧供不足,机体产生应激反应,无氧糖酵解供能比例提升、脂肪有氧供能比例下降。氧利用率提升,ATP合成速度增加。Kurtoglu SI[4]研究表明,低氧环境运动能够提升糖尿病患者糖代谢能力、增加胰岛素、胰岛素受体及由胰岛素-胰岛素受体介导的葡萄糖转运速率。王宁琦[5]研究显示低氧和运动的双因素诱导下糖尿病患者体内葡萄糖转运蛋白(GLUT)表达和转位、转运能力、糖代谢酶的活性均显著增强。Mackenzie等[6]发现低氧结合中等强度运动能有效改善糖尿病人糖耐量,提高胰岛素的敏感性。利用模拟低氧环境运动改善糖尿病人代谢紊乱、提高胰岛素敏感性、降低对药物和人工胰岛素的依赖程度已经成为糖尿病辅助治疗方面的热点,在糖尿病治疗方面有广阔的前景。但是低氧环境存在风险,大量研究证实高原低氧地区居民年老后在受高原缺氧影响与平原地区居民相比,骨量丢失明显,骨质疏松症发病机率较高[7]。虽然目前低氧诱发骨质疏松形成的作用机制尚不明确,但低氧环境已经被公认为是骨质疏松发生、发展的重要环境因素。众所周知,骨质疏松是2型糖尿病常见并发症,且糖尿病诱发的骨质疏松具有性别特征,研究显示2型糖尿病男女患者骨质疏松发病率分别为38.0%和65.3%,女性糖尿病患者的骨质疏松患病率明显高于男性糖尿病患者。在低氧环境能够改善糖尿病患者内分泌和胰岛素敏感性,但其是否会加剧糖尿病患者骨量丢失、增加其骨质疏松风险,目前尚不明确,国内外亦未见相关研究。本研究拟通过建立老年T2DM大鼠模型,并进行为期12周的低氧环境运动干预,观察大鼠糖代谢、胰岛素敏感性、骨密度等相关指标,进一步明确低氧环境运动对糖尿病大鼠糖代谢、胰岛素敏感性的影响和评价其对糖尿病大鼠骨量丢失和骨质疏松的风险。为日后低氧环境运动作为糖尿病患者运动处方的施用提供参考。
1 材料与方法
1.1 材料
1.1.1实验动物:本实验采用SPF级雌性55月龄SD大鼠72只,体重180 g~190 g,由重庆医科大学重庆国家生物产业基地实验动物中心,许可证编号: SCXK(渝) 2017-0023,分笼饲养,自由饮水,饲养环境保持22±3 ℃,相对湿度45%~60%,明暗期12 h/12 h,并对大鼠进行饮食量、饮水量、动物背毛日常观察。实验过程中对动物处置符合科学技术部发布的《关于善待实验动物的指导性意见》。
1.1.2实验试剂:高脂饲料由福贝世亨生物医药有限公司提供,热量5.5 kcal/g,其中脂肪含量为60%,碳水化合物为25%,蛋白质为15%。葡萄糖注射液由四川科伦药业提供。链脲佐菌素(Streptozotocin,STZ)由深圳兴博盛ENZO公司提供。大鼠胰岛素酶联免疫分析ELISA 试剂盒由厦门慧佳生物科技有限公司提供。柠檬酸盐缓冲液由南通市飞宇精细化学品公司提供。葡萄糖氧化酶活性检测试剂盒由美国SIGMA公司提供。
1.1.3实验设备:-80 ℃冰箱(国产HaierDW-86L626)、血液分析仪(美国产贝克曼库尔特COULTER©LH 750)、分光度计(国产上海谱元Alpha1860S) 等,全自动生化分析仪(日本产HITACHI-7000),低温离心机(国产凯达rt-35),酶标仪(国产Bio-TekELX800),双能 X 线骨密度仪(Faxitron ultrafocus100,USA),材料试验机(意大利 GALDABINI,SUN1000 V669),低氧舱 (美国产Oxycycler ModelA84XO BioSpherix Instruments),动物跑台(国产赛昂斯SANS-sa101)。
1.2 方法
1.2.1实验设计与流程:1)对所有大鼠(n=72)进行为期1周的适应性饲养;2)随机将大鼠分为普通饲料喂养对照组(Normal control group,NC组,n=24),高脂饲料喂养组(High-fat dits,HF组,n=48),进行为期8周喂养,8 周后HF组注射小剂量链脲佐菌素,构建老年T2DM动物模型,期间HF组大鼠维持高脂喂食,4周后对所有大鼠进行葡萄糖耐量试验(Intraperitoneal glucose tolerance test,IPGTT)、骨扫描评价胰岛素敏感性指标、糖代谢指标、骨密度进行检测;3)模型构建完成后,NC组随机分为常氧对照组(Normal Oxygen control,NC组,n=12),低氧对照组(Low Oxygen control,LC组,n=12),HF组随机分为低氧糖尿病组(Low Oxygen T2DM,LT组,n=12)、低氧糖尿病运动组(Low Oxygen T2DM Sport,LTS组,n=12)、常氧糖尿病组(Normal Oxygen T2DM, NT组,n=12)、常氧糖尿病运动组(Normal Oxygen T2DM Sport,NTS组,n=12)进行为期12周干预,在干预期间,停止高脂饲料喂食,各组大鼠均进行普通饲料正常喂食;4)干预结束后对所有大鼠进行胰岛素敏感性指标、糖代谢指标、骨密度、股骨生物力学指标检测。
1.2.2动物模型构建与分组:1)T2DM大鼠模型建造:所有大鼠进行适应性喂养 1 周后,随机将大鼠分为普通饲料喂养对照组(NC组,n=24),高脂饲料喂养组(HF组,n=48),NC组大鼠用普通饲料进行喂养,HF组大鼠用高脂高糖饲料进行喂养。HF组高脂饲料喂养8 周后,对大鼠按照30 mg/kg的标准进行1次腹腔注射STZ, NC组大鼠按照1 mL/kg标准进行腹腔注射1次柠檬酸盐缓冲液。在注射STZ 后第4周,所有大鼠禁食12 h,进行2次空腹血糖测试。
2)T2DM大鼠模型判定:测试结果血糖空腹血糖浓度(fasting plasma glucose,FPG)≥7.0 mmol/L,被认为是T2DM大鼠模型造模成功。本研究高脂组大鼠造模成功48只。
3)具体分组:将对照组大鼠随机分常氧对照组(NC组,n=12),低氧对照组(LC组,n=12),造模成功的糖尿病大鼠随机分为低氧糖尿病组(LT组,n=12)、低氧糖尿病运动组(LTS组,n=12)、常氧糖尿病组(NT组,n=11)、常氧糖尿病运动组(NTS组,n=11)。所有大鼠在干预期间进行正常饲料喂食,自由饮水。LC组、LT组、LTS组执行低氧方案、NC组、NT组、NTS组进行常氧方案、NTS组和LTS组执行运动方案、LC组、LT组、NC组、NT组大鼠在笼中正常饲养,不进行活动。
1.2.3干预方案:1)低氧方案:LC组、LT组、LTS组执行低氧方案,目前公认高原运动海拔上限2 400 m,参照谢宜轩低氧方案[8],利用美国产Oxycycler ModelA84XO低氧舱制造人工常压低氧环境,氧体积分数为16%,相当于海拔2 400 m。
2)常氧方案:NC组、NT组、NTS组进行常氧方案,该方案在重庆万州执行,海拔325 m。
3)运动方案:NTS组和LTS组执行运动方案,运动方案参照张荷研究方案中通过动物跑执行,常氧和低氧运动组大鼠需要执行每周4次,每次60 min、速度为20 m/min的跑台运动。各组具体干预方案参见表1。
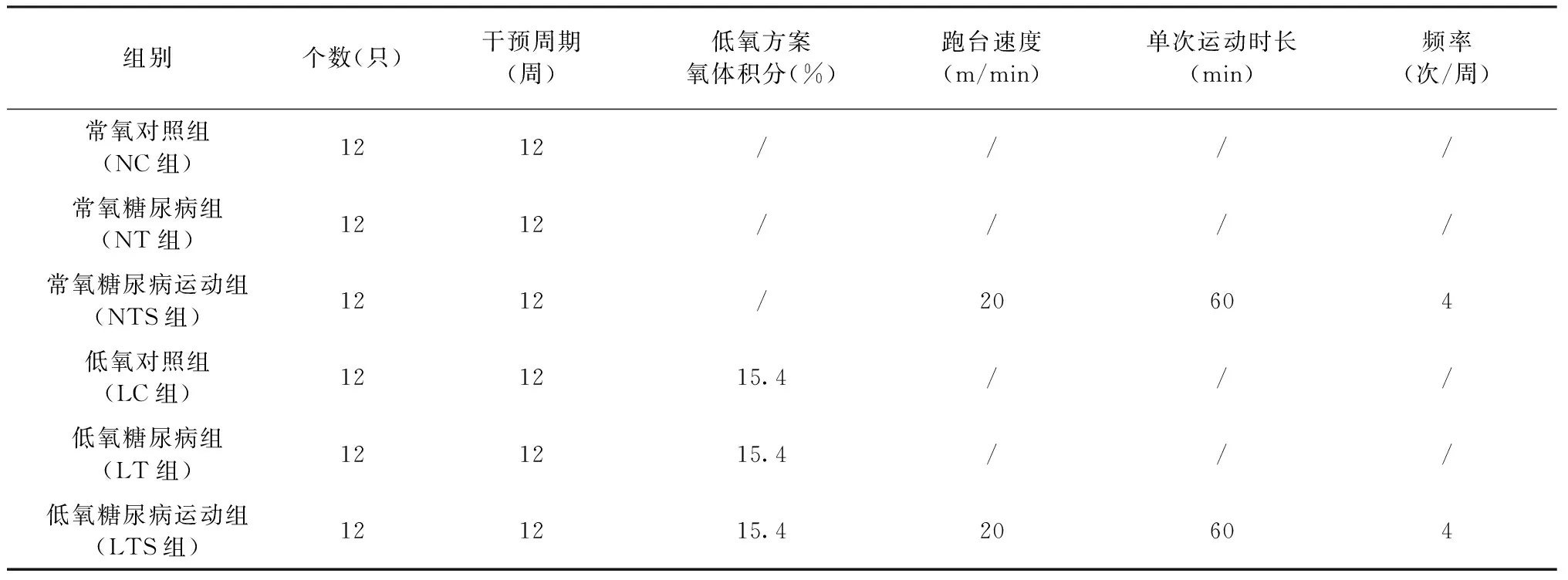
表1 各组干预方案明细Table 1 Details of the intervention program in each group
1.2.4大鼠状态记录观察:专人负责观察实验周期内所有实验大鼠体重、精神状态、饮食、排便等情况,并且进行记录。
1.2.5取材:造模结束后对所有大鼠进行腹腔注射葡萄糖耐量试验(IPGTT),第2天所有大鼠保持禁食12 h,后抽取腹部主动脉血3 mL,在常温下静置 30 min 后,利用低温离心机以4 000 r /min 离心10 min,提取血清,置于-20 ℃冰箱进行保存。8周的干预结束后对所有大鼠进行 IPGTT 试验,次日所有大鼠禁食 12 h取腹主动脉血,取血结束后,处死大鼠,剥离大鼠双侧股骨,去除股骨结缔组织和骨骼肌。进行称取双侧股骨鲜重,分别用浸透生理盐水的纱布包裹每侧股骨,进行标记,置于-80 ℃冰箱进行保存。
1.2.6糖代谢与胰岛素:葡萄糖耐量试验(IPGTT):IPGTT测试对大鼠依照每千克体重 2 g 的剂量予以腹腔注射50% 浓度葡萄糖溶液。在完成注射葡萄糖溶剂后 0 min、30 min、60 min、120 min 对大鼠采集尾静脉血,利用强生one touch血糖仪测定血糖浓度,按照张家庆研究中[9]的算法计算血糖曲线下面积(Area under the curve of blood glucose,AUCBG)。
糖代谢指标检测:IPGTT,第2天所有大鼠保持禁食12 h,后抽取腹部主动脉血3 mL,在常温下静置 30 min 后,利用低温离心机以4 000 r /min 离心10 min,提取血清,置于-20 ℃冰箱进行保存。将血利用酶联免疫分析ELISA法检测空腹胰岛素水平(fasting serum insulin,FINS)、葡糖糖氧化酶法测定空腹血糖浓度(FPG),胰岛素抵抗指标以稳态模型的胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR) 表示、胰岛素敏感性指数(insulin sensitive index,ISI)。
股骨骨密度检测:股骨骨密度测定从-80 ℃冰箱中取出各组大鼠左侧股骨,室温放置,待其自然解冻后,检测使用美国产Faxitron ultrafocus100双能X线骨密度仪测量各组股骨远端骨密度。
股骨生物力学的检测:将置于-80 ℃冰箱保存大鼠股骨取出,置于常温环境直至自然解冻。材料试验机的两立柱间距调整为20 mm,将接受生物力学检测的大鼠股骨置于两立柱之间,两立柱支撑股骨两端,所有股骨样本摆放的方向、位置保持一致,以降低系统测量误差, 控制材料试验机上压头接近股骨, 使上压头以 1 mm /min速度匀速下降, 进行三点弯曲试验, 直至股骨发生骨折,通过SMD数字信号采集测试系统以10次/秒的采样频率记录实验数据,在软件中自动保存。软件记录最大载荷、断裂载荷、最大应力、弹性模量等指标。
1.3 统计分析
本研究利用SPSS22.0统计软件进行统计分析。本研究数据均以平均数±标准差形式进行表达, 利用独立样本T检验对大鼠体重进行前后比较分析、利用单因素方差分析、LSD检验对大鼠FPG、FINS、HOME-IR、AUCBG、ISI、骨密度、最大应力、最大载荷、断裂载荷、弹性模量指标进行多组均数比较和组间两两比较。本研究显著水平定为α<0. 05。
2 结果
2.1 T2DM大鼠模型验证
表2显示:NC组与HF组在FINS、FPG、HOMA-IR、AUCBG指标上差异有统计学意义(P<0.01),在ISI指标上差异有统计学意义(P< 0.05)。该结果表明HF组胰岛素敏感性与NC组比较显著降低,可以认为经过8周高脂喂食,HF组大鼠呈胰岛素抵抗状态,建模成功。

表2 对照组与糖尿病模型组糖代谢和胰岛素敏感性指标对比Table 2 Comparison of glucose metabolism and insulin sensitivity indexes between control group and diabetic model group
注:*表示组间差异具有统计学意义P<0.05;**表示组间具有非常显著差异P<0.01
2.2 大鼠体重变化结果
表3显示:1)所有组别在造模前体重差异无统计学意义(P>0.05),可以排除造模前初始体重差异的影响。2)NC组和LC组大鼠体重显著低于NT组、NTS组、LT组、LTS组大鼠体重差异具有统计学意义(P<0.05)。3)经过12周干预后NTS组和LTS组大鼠体重显著低于干预前体重(P<0.05),NT组和LT组大鼠体重显著高于干预前体重(P<0.05),NC组和LC组干预前后差异无统计学意义(P<0.05)。4)经过12周干预后NTS组大鼠显著低于NT组和LT(P<0.05)且显著高于NC组、LC组、LTS组大鼠体重(P<0.05)。LTS组大鼠体重显著低于LTS组、NT组和LT(P<0.05)且显著高于NC组、LC组大鼠体重(P<0.05)。NC组大鼠体重显著高于LC组(P<0.05),NT组大鼠体重显著高于LT组(P<0.05)。
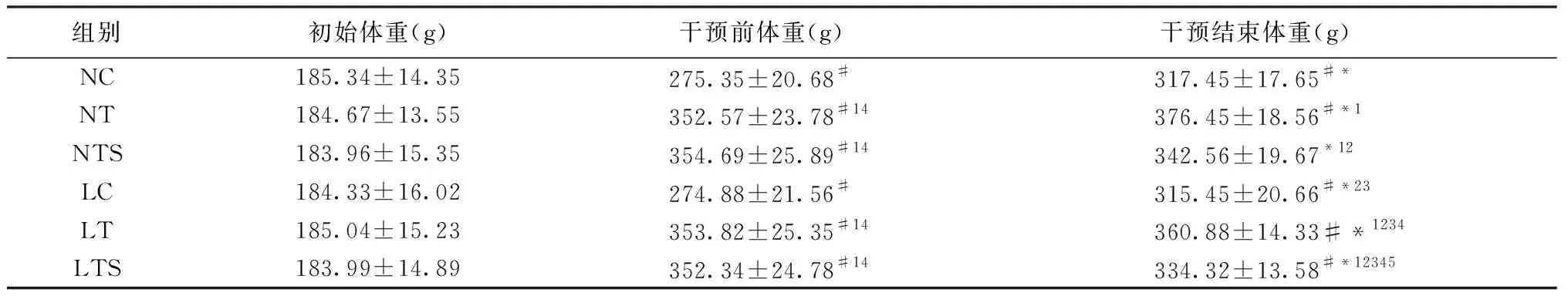
表3 各组大鼠体重变化Table 3 Changes in body weight of rats in each group
注:#表示与造模前体重差异有统计学意义,P<0.05;*表示与干预前体重差异有统计学意义,P<0.05;1)表示与NC组差异有统计学意义P<0.05;2)表示与NT组差异有统计学意义P<0.05;3)表示与NTS组差异有统计学意义P<0.05;4)表示与LC组差异有统计学意义P<0.05;5)表示与LT组差异有统计学意义P<0.05
2.3大鼠胰岛素敏感性及代谢指标变化
表4显示:1)FINS方面,LTS组显著低于NTS组、LT组和NT组(P<0.05),LTS组与NC组、LC组组间差异无统计学意义(P>0.05),LC组低于NC组但差异无统计学意义(P>0.05),LT组显著低于NT组(P>0.05)。
2)FPG方面,LTS组显著低于NTS组、LT组和NT组(P<0.05),LTS组与NC组、LC组组间差异无统计学意义(P>0.05),LC组低于NC组但差异无统计学意义(P>0.05),LT组低于NT组但差异无统计学意义(P>0.05)。
3)HOMA-IR方面,LTS组显著低于NTS组、LT组和NT组(P<0.05),LTS组显著高于NC组、LC组(P<0.05),LC组低于NC组但差异无统计学意义(P>0.05),LT组低于NT组但差异无统计学意义(P>0.05)。
4)ISI方面LTS组显著低于NTS组、LT组和NT组(P<0.05),LTS组显著高于LC组(P<0.05),与NC组差异无统计学意义(P>0.05),LC组显著低于NC组(P<0.05),LT组显著低于NT组(P<0.05)。
5)AUGBG方面,LTS组显著低于NTS组、LT组和NT组(P<0.05),LTS组显著高于LC组(P<0.05),与NC组差异无统计学意义(P>0.05),LC组显著低于NC组(P<0.05),LT组显著低于NT组(P<0.05)。
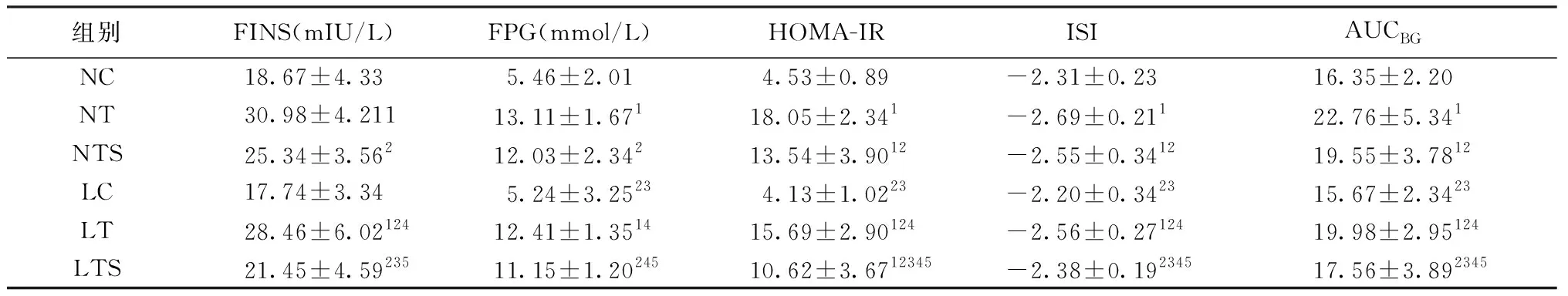
表4 大鼠胰岛素敏感性和代谢指标变化Table 4 Changes of insulin sensitivity and metabolic-related indicators in rats
注:1)表示与NC组具有显著性差异P<0.05;2)表示与NT组差异有统计学意义P<0.05;3)表示与NTS组差异有统计学意义P<0.05;4)表示与LC组差异有统计学意义P<0.05;5)表示与LT组差异有统计学意义P<0.05
2.4 大鼠股骨重、骨密度变化结果
表5显示:1)在造模完成后进行干预前NC组和LC组大鼠骨密度与NT组、NTS组、LT组、LTS组大鼠骨密度差异有统计学意义(P<0.05),表明糖尿病大鼠出现骨密度下降。
2)NTS组和LTS组干预后大鼠骨密度显著高于干预前骨密度(P<0.05),且NTS组和LTS组干预后大鼠骨密度差异无统计学意义(P>0.05)。
3)NTS组和LTS组干预后大鼠骨密度显著高于NT组和LT组大鼠骨密度(P<0.05),显著低于NC组和LC组大鼠骨密度(P<0.05),NC组大鼠骨密度显著高于LC组(P<0.05)。
4)NTS组和LTS组干预后大鼠鲜股骨重显著高于NT组和LT组(P<0.05),显著低于NC组和LC组(P<0.05),NC组大鼠鲜股骨重显著高于LC组(P<0.05),NTS组和LTS组干预后大鼠鲜股骨重差异无统计学意义(P>0.05)。

表5 大鼠鲜股骨重、骨密度变化Table 5 Changes of femoral bone weight and bone mineral density in rats
注:*表示与干预前骨密度差异有统计学意义,P<0.05;1)表示与NC组差异有统计学意义P<0.05;2)表示与NT组差异有统计学意义P<0.05;3)表示与NTS组差异有统计学意义P<0.05;4)表示与LC组差异有统计学意义P<0.05;5)表示与LT组差异有统计学意义P<0.05
2.5 大鼠股骨骨生物力学指标变化
表6显示:1)最大应力方面,LTS组、NTS组显著低于LC组和NC组(P<0.05),显著高于NT组和LT组(P<0.05),LTS组与NTS组间差异无统计学意义(P>0.05),LT组与NT组间差异有统计学意义(P<0.05)。
2)最大载荷方面LTS组、NTS组显著低于NC组(P<0.05),显著高于NT组和LT组(P<0.05),LTS组、NTS组、LC组组间差异无统计学意义(P>0.05),LT组与NT组间差异无统计学意义(P<0.05),LC组与NC组间差异无统计学意义(P<0.05)。
3)断裂载荷方面LTS组、NTS组显著低于NC组(P<0.05),显著高于NT组和LT组(P<0.05),LTS组、NTS组、LC组组间差异无统计学意义(P>0.05),LT组与NT组间差异有统计学意义(P<0.05),LC组与NC组间差异有统计学意义(P<0.05)。
4)弹性模型方面LTS组、NTS组显著低于LC组、NC组(P<0.05),显著高于NT组和LT组(P<0.05),LTS组、NTS组、组间差异无统计学意义(P>0.05),LT组与NT组间差异有统计学意义(P<0.05),LC组与NC组间差异有统计学意义(P<0.05)。
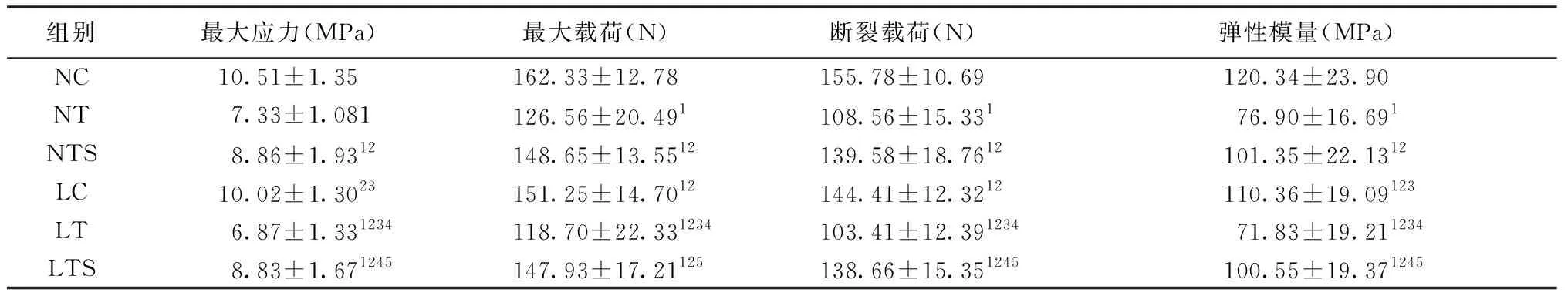
表6 大鼠股骨骨生物力学指标变化Table 6 Changes of femoral bone biomechanics in rats
注:1)表示与NC组差异有统计学意义P<0.05;2)表示与NT组差异有统计学意义P<0.05;3)表示与NTS组差异有统计学意义P<0.05;4)表示与LC组差异有统计学意义P<0.05;5)表示与LT组差异有统计学意义P<0.05
3 讨论
3.1 低氧环境下中等强度运动对老年T2DM胰岛素敏感性影响
中等强度运动被认为是对糖利用较为充分且容易坚持的运动方式[10]。Polak J[11]研究发现老年糖尿病患者经过9周60%Hrmax的跑步运动,胰岛素敏感性显著提升。Stevens AL[12]对老年2型糖尿病大鼠进行速度为15 m/min的跑台发现大鼠胰岛素抵抗现象得以缓解。所以中等强度运动能够降低糖尿病患者血糖、缓解其胰岛素抵抗、提高其胰岛素敏感性。研究认为糖尿病患者至少要连续8周中强度运动才能达到对胰岛素敏感性的改善作用[13]。潘志军[14]认为运动强度与对胰岛素敏感性改善程度没有线性关系。中等强度运动为提升糖尿病患者胰岛素敏感性的适应负荷。而运动对糖尿病患者高胰岛素敏感性提高机制可能与糖原合成有关。Jung SH[15]研究发现,大鼠经过连续8周、每天60 min的中强度运动后,其与糖原合成相关的多种酶活性均显著提高,当与糖原合成有关酶的活性提升时,机体肌糖原和肝糖原的合成会加快,糖转化为糖原形式后,血液中糖浓度会下降。也有研究认为运动对糖尿病患者高胰岛素敏感性提高与运动导致糖胰岛素的信号传导增强有关。Kum[16]研究发现糖尿病大鼠经过8周跑台运动后其骨骼肌中PKB 磷酸化水平显著高于运动干预前,与不运动组相比差异亦有统计学意义。Bernard[17]研究中对糖尿病大鼠进行12 周跑台训练干预,发现大鼠骨骼肌中胰岛素刺激的 PI3K和 Akt 的活性显著增高。本研究中运动干预的LTS组和NTS组在FINS、FPG、HOMA-IR、ISI、AUCBG等指标上均显著优于未进行运动的LT组、NT组,P<0.05。该结果与先前学者的研究结果一致,再次验证中等强度运动有助胰岛素敏感性的提升。
近年来,研究显示低氧环境下的持续运动能改善胰岛素抵抗大鼠糖代谢,促进胰岛素敏感性提升,以及缓解胰岛素抵抗。而本研究中进行低氧干预的LC组、LT组和LTS组在经过12周的干预,在与胰岛素敏感性和糖代谢有关的FINS、FPG、HOMA-IR、ISI、AUCBG方面与对应的NC组、NT组和NTS组相比均出现下降趋势。LTS组显著低于NTS组、LT组和NT组(P<0.05)。本研究表明中低氧因素在改善老年T2DM大鼠胰岛素敏感性、糖代谢方面具有显著作用,且低氧因素与运动因素能够产生叠加效应,低氧环境下的中强度运动能够更为明显地提升。
大鼠的胰岛素敏感性被认为其机制与体重变化、糖利用率、葡萄糖转运有关。研究显示持续低氧环境或长时间进行低氧运动能显著降低人或动物的体重,且低氧运动降低体脂的效果优于相同强度的常氧运动。低氧能刺激机体产生应激,肾上腺素、甲状旁腺激素、去甲肾上腺素分泌增加,基础代谢率提高,同时低氧会刺激下丘脑“食欲调节网络”,产生食欲抑制,故低氧运动可增加能耗、减少摄食量,降低体重以及优化体成分。Hu G[18]研究指出,低氧运动比常氧运动能更有效降低肥胖青年体重和体脂。鲁世金[19]等研究发现低氧运动可以增加下丘脑瘦素,降低T2DM大鼠食量,加速骨骼肌和脂肪组织中的脂肪动员和分解,促进IGF-1和胰岛素分泌。有学者认为,低氧刺激诱发神经反射、激素分泌等应激变化,导致人体优先利用糖进行供能[6]。当机体处于低氧环境,由于氧供不足,机体产生应激反应,糖比例提升,氧利用率提升,ATP合成加剧。有学者研究发现,低氧环境下机体对于糖的摄取、利用率及氧化作用均有所变化。细胞膜上葡萄糖转运蛋白 (Glucose transporter type,GLUT) 的数量和转运能力被认为是影响细胞内葡萄糖的跨膜转运的关键因素,葡萄糖只有通过 GLUT的转运才能被机体利用。GLUT的数量被认为与胰岛素抵抗程度呈负相关。Kurtoglu SI[4]研究证明,大鼠对低氧产生适应后,其骨骼肌细胞膜上与葡萄糖转运蛋白-4(Glucose transporter type -4,GLUT-4)的结合位点增多,葡萄糖转运能力增强,机体对于葡萄糖利用率增加。谢宜轩等[8]研究发现经过低氧运动大鼠体能与糖代谢有关酶含量增加且活性显著提高。但也有报道指出低氧干预虽会减少皮下脂肪堆积,但会增加血脂,降低胰岛素敏感性。长期处于低氧环境会诱发脂联素、瘦素和抵抗素等与脂代谢相关的细胞因子分泌失调,加剧T2DM大鼠胰岛素抵抗[20]。本研究结果显示低氧环境有利于在改善老年T2DM大鼠胰岛素敏感性、糖代谢方面,低氧环境下中等运动能够更为显著的提升老年T2DM大鼠胰岛素敏感性。造成不同研究结果差异的原因可能与不同研究采用的运动干预方式、低氧环境氧浓度、大鼠年龄差异有关。
综上所述,低氧环境能够改善老年T2DM大鼠的糖代谢和胰岛素敏感性,但低氧环境结合中等强度运动能够产生叠加增强效应。
3.2 低氧环境下中等强度运动对老年T2DM大鼠骨密度和骨生物力学性质影响
骨密度是反映骨皮质厚度、骨小梁结构和骨量的重要指标,也是评价骨丢失程度的指标之一。骨能承受的最大应力、最大载荷、弹性模量等是骨生物力学性能指标,能够直接反映强度、韧性、刚度以及稳定性,常被用于对骨骼质量的评价。流行病学调查发现高海拔地区生活的人群平均骨密度低于平原地区人群,45岁以上人群的骨密度差距尤为明显。低氧暴露被公认为是人和动物骨量丢失、骨质疏松的高危因素。先前研究基本认为,低氧因素对大鼠骨代谢有较明显的影响,诱发骨吸收加剧、骨形成作用抑制、骨量丢失加速、骨密度下降导致骨质疏松的发生。Stevens AL[21]研究认为低氧暴露不仅会导致骨量流失而且会改变骨小梁结构,骨盆和腰椎骨微结构改变尤为明显。有研究显示2 型糖尿病患者骨质疏松的发病率虽显著低于1型糖尿病患者但其骨折发病率仍是非糖尿病患者的3~5倍。乔林[22]等研究中发现低氧环境T2DM大鼠骨密度下降较正常大鼠更为严重且骨量丢失更迅速。糖尿病导致的高血糖内环境可诱发渗透性利尿, 导致血清磷、钙浓度显著降低, 而低血钙会反馈导致甲状旁腺机能亢进, 甲状旁腺素分泌过量, 破骨细胞活性显著增加, 进而导致磷、钙动员增加,骨质脱钙,骨量流失,形成骨质疏松。此外高血糖还会抑制胰岛素样生长因子1(insulin-like growth factors-1,IGF-1)的合成和释放, 使 IGF-1浓度下降, 而 IGF-1 具有激活成骨细胞的活性作用, 加速骨胶原形成。糖尿病病程长短与骨密度下降程度高度相关。本研究发现在未进行运动干预的糖尿病大鼠中,LT组大鼠骨密度、鲜骨重、最大应力、最大载荷、弹性模量等指标均显著低于NT组(P<0.05),不进行运动干预的正常大鼠中LC组大鼠骨密度、鲜骨重、最大应力、最大载荷、弹性模量等指标均低于NC组,但差异无统计学意义(P>0.05)。该结果表明,低氧环境因素对大鼠骨量丢失和骨生物力学性质的改变具有显著影响。低氧环境因素对于糖尿病大鼠在骨密度和骨生物力学指标表面的影响显著大于普通正常大鼠。这与乔林[22]的研究中发现的低氧环境对T2DM大鼠骨密度影响大于正常大鼠的现象吻合。所以低氧暴露作为糖尿病患者致骨质疏松的危险因素,其机制可能是低氧因素诱发骨质代谢有关的细胞因子产生应激反应,进而使破骨细胞活性增加, 骨吸收作用加剧,最终导致骨密度下降。但是本研究在运动干预的糖尿病大鼠中LTS组与NTS组大鼠骨密度、鲜骨重、最大应力、最大载荷、弹性模量等指标差异均无统计学意义(P>0.05),这表明运动干预可以显著降低低氧因素对糖尿病大鼠造成的骨密度下降和骨生物力学性质改变的风险。Liu X[23]研究证实跑步运动对于人或动物骨密度甚至骨结构具有正向效应。跑步动作过程中,自重对地面产生压力而根据牛顿定律地面会向人体产生反作用力也就是对骨骼造成自下而上的冲击力。跑步过程中人体肌肉通过离心-向心收缩对骨骼产生二次压力负荷,产生压电效应刺激成骨细胞的活性和骨的生成从而增加肌力和促进成骨生长,改善骨结构,进而增加骨密度[24]。也有研究认为,跑步过程中肌肉被动进行收缩,而且有较长时间的等长和离心收缩,此收缩模式可以加速局部血液循环,刺激运动部位充血引起骨血灌注量增加[25]。研究证实,运动能够刺激生物体内IGF-1的分泌,IGF-1在骨骼生长发育、骨量和骨密度维持方面起非常关键的作用。IGF-1 与其受体结合,可以调节细胞的生长、增殖与代谢。IGF-1在 OB 和破骨细胞 (OC) 上均存在受体,在骨吸收过程被大量释放,是使骨形成和骨吸收达到紧密偶联最重要的生长因子,血液中的IGF-1 水平在骨量的生成和维持上起到非常关键的作用[26]。
综上所述,低氧环境能够造成老年T2DM大鼠骨密度下降和骨生物力学性质的改变,但是在低氧环境结合中等强度运动则可以维持老年T2DM大鼠骨密度和骨生物力学性质。
4 结论
低氧环境能够显著改善老年2型糖尿病大鼠胰岛素敏感性,但也能够诱发其骨密度下降和骨生物力学性质改变。在低氧环境下进行中等强度运动则能够有效改善老年T2DM大鼠胰岛素抵抗、提高胰岛素敏感性,同时增加骨密度、改变骨生物力学性质。因此,低氧干预有助于糖尿病患者胰岛素敏感性的提高,同时,结合中等强度运动能够有效防止低氧干预对糖尿病患者造成的骨密度下降和骨生物力学性质的改变。
