鸭疫里默氏杆菌ERIC-PCR基因分型
2018-08-02杨旭夫
彭 凌,杨旭夫
(韶关学院英东生命科学学院∕中国农业科学院哈尔滨兽医研究所-韶关学院动物疫病诊断中心联合实验室,韶关512005)
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)可引起鸭、火鸡和其他鸟类的接触性传染病,即鸭疫里默氏杆菌病[1-2],又称为鸭传染性浆膜炎,曾称为鸭败血症、新鸭病、鸭疫综合症和鸭疫巴氏杆菌病等。雏鸭易感染,环境条件恶劣可以增加发病率,常呈急性或慢性败血症,主要病理变化是纤维素性心包炎、气囊炎、脑膜炎、肝周炎、干酪样输卵管炎等,发病率为5%—90%,病死率高达80%,常引起小鸭的大批发病、生长迟缓和死亡[3]。随着规模化饲养,养殖密度增加,过去散发的传染病变为大面积群发[4]。鸭疫里默氏杆菌病成为目前危害养鸭业的主要传染病之一[5],免疫接种是控制该病的一种有效的措施。由于鸭疫里默氏杆菌的血清型越来越趋向多样化,迄今为止,国际上报道RA血清型就有21种[6-7],绝大部分血清型间缺乏交叉保护,而免疫预防应有血清型针对性才能奏效,这就需要开展RA血清学调查。实际上并非每个实验室都拥有RA的全部血清型,当血清型不齐备时,传统的血清学诊断方法就无能为力;并且,在血清型鉴定过程中,有很多原因会造成分型上的混淆,如不同的试验方法以及菌株之间的血清学相关性等[8]。有研究表明,同一血清型的不同分离株,其在生化特性、致病性或抗原性等方面均存在着差异[9],因此,为准确掌握 RA的流行病学情况,本研究采用肠杆菌基因间重复一致序列RCR(Enterobacterial repetitive intergenic consensus,ERIC-RCR)对广东地区16个鸭场分离到的48株RA进行基因分型,寻找该地区的优势菌株,深入了解RA的流行病学分布,并通过对分离菌株的ERIC-RCR指纹图谱的聚类分析,探讨分离菌株间的亲缘关系及进化关系,为更好地防治该病奠定基础。
1 材料与方法
1.1 供试菌株
为本实验室2011—2013年从广东地区16个发病鸭场中疑似患鸭疫里默氏杆菌病的3—4周龄鸭的脑组织中分离所得,经过培养特性与生化特性鉴定为RA,共48株分离株。
1.2 供试试剂
TaKaRa Taq enzyme购自宝生物工程(大连)有限公司。
1.3 RA基因组DNA的提取
参考参考文献[10],采用传统的酚氯仿法抽提细菌基因组DNA。
1.4 PCR鉴定
按文献[11]报道的序列,设计上游引物(5’-TTACCGACTGATTGCCTTCTAG-3’)和下游引物(5’-AGAGGAAGACCGAGGACATC-3’),由上海生工生物工程有限公司合成。目的片段大小为546 bp。反应体系(总体积为 25 μL)含:10 mmol∕L Tris-HCl(pH 8.3),10 mmol∕L KCl,2.5 mmol∕L MgCl2,0.4 mmol∕L dNTR,上下游引物各0.5 μmol∕L,基因组DNA 100 ng,Taq酶1.5 U。扩增程序为:94℃ 预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,35个循环;最终72℃延伸6 min。扩增产物经琼脂糖凝胶电泳后观察结果。
1.5 ERIC-PCR
按文献[12]报道的序列,设计引物ERIC-1R(5’-ATGTAAGCTCCTGGGGATTCAC-3’)和ERIC-2R(5’-AA GTAAGTGACTGGGGTGAGCG-3’),由上海生工生物工程有限公司合成。经筛选优化,反应体系(总体积为 25 μL)含:10 mmol∕L Tris-HCl(pH 8.3),10 mmol∕L KCl,2.5 mmol∕L MgCl2,0.4 mmol∕L dNTR,引物各1.0 μmol∕L,基因组DNA 100 ng,Taq酶1.5 U。扩增程序确定为:94℃ 预变性2 min;94℃变性30 s,50℃退火30 s,72℃延伸6 min,35个循环;最终72℃延伸6 min。扩增产物经琼脂糖凝胶电泳后观察结果。
1.6 指纹图谱统计分析
以所有分析菌株为变量,不同的扩增条带为样本,统计扩增结果。根据所有供试菌株ERIC-RCR电泳图谱上的不同条带获得相似性矩阵,依据相似系数计算出遗传距离,经SRSS 10.0软件根据欧氏遗传距离矩阵,采用最短距离法进行聚类分析,绘出48株RA菌株间亲缘关系树状图。
2 结果与分析
2.1 PCR鉴定
48株RA分离株的RCR鉴定结果如图1所示,可以看出,本研究中的48株RA分离菌株均能扩增出546 bp的目的条带。
2.2 ERIC-PCR指纹图谱
采用ERIC-RCR方法对48个RA分离株进行分析,得到了清晰的电泳图谱,且重复性较好。结果表明:RCR产物大小在500—3000 bp,DNA多态性良好,各分离菌株均扩增出4—10个条带,最大接近3000 bp,最小稍大于500 bp(图2)。根据每个菌株扩增产物中DNA条带的差异,48株菌株可直观分为16种指纹图谱即16个基因型(表1)。1型有1株:H1large;2型有2株:H4、H1;3型有1株:DD4;4型有5株:H5、HC3、HY7、H6、HY4;5型有1株:HC4;6型有1株:tnLarge1;7型有1株:ZL2;8型有8株:ws1、DD2、cn4、dn1、ZL1、Large1、JS6、JS8;9 型有2 株:HR2、ws2;10 型有1 株:HY5;11 型有7 株:cn3、HR1、HR3、HR5、JS1、HN4、dn2;12 型有4 株:1、5、7、9;13 型有6 株:01、02、05、06、09、012;14 型有1 株:ZL9;15 型有2株:14、12;16 型有5 株:Large5、ZL12、SK5、Large2、SK6。

图1 48株RA分离株PCR鉴定结果Fig.1 Identification of 48 RA isolates by PCR

图2 48株RA分离株ERIC指纹图谱Fig.2 ERIC-PCR fingerprints of 48 RA isolates

表1 48株RA分离株的基因型Tab.1 The genotypes of 48 RA isolates
2.3 聚类分析
48株RA分离株的ERIC-RCR聚类分析结果如图3所示,其分型结果与视觉分型结果相同。从1、2、3、5、6鸭场分离基因型1、12—16聚为一大类,说明这些鸭场分离的菌株亲缘关系近,可能有着相同的起源;而从1、3、4、7—16鸭场分离的基因型2—11聚为另一大类,说明这些菌株有着另外的起源。
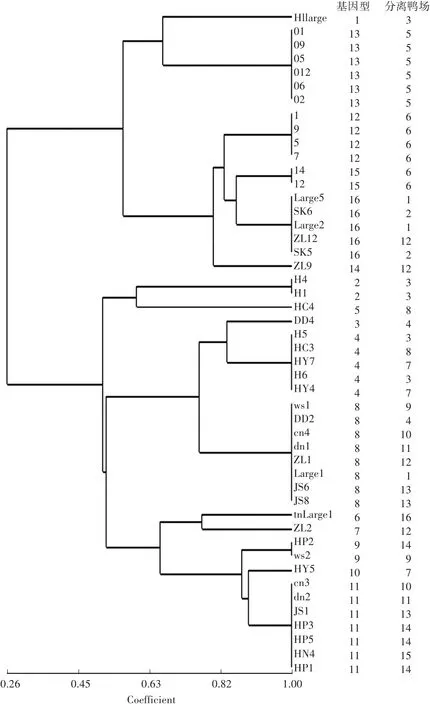
图3 48株RA分离株ERIC-PCR指纹图谱的聚类分析Fig.3 Cluster analysis based on ERIC-PCR fingerprints of 48 RA isolates
3 结论与讨论
本研究为确定广东地区的RA病流行情况,首先从广东各地16个发病鸭群分离鉴定得到48株RA,进一步对48个菌株进行了RCR鉴定,扩增到了特异性条带,从分子生物学水平上验证了RA常规鉴定的准确性。
采用ERIC-RCR对48个分离株进行基因分型,区分这些不同来源的野外分离株。研究结果表明:各鸭场RA流行情况复杂,同一鸭场流行多种基因型并且不同鸭场流行基因型不一致。16个鸭场除4个只有1个基因型外,其他12个鸭场流行的基因型均在2个以上,个别鸭场流行的基因型达4种。流行最多的基因型为8型,共有8株,7个鸭场存在基因型8型,也就是说占被调查鸭场数43.75%。其次为11基因型有7株,6个鸭场有该型,占调查鸭场数37.5%。虽然13基因型有6株,但只分布在1个鸭场;12基因型有4株也仅分布在1个养鸭场,该场还存在15基因型。基因型4型有5株分布在3个鸭场,占调查鸭场数量的18.75%。16型5株,分布在3个养鸭场。从分离菌株的数量看,基因型8型和11型最多,但两个基因型菌株仅覆盖被调查鸭场数的56.25%,二者仅交叉覆盖3个鸭场。还有基因型1、3、5、6、7、10和14型各为1株,分布在不同的养鸭场。说明该地区RA病流行情况复杂,流行菌株呈多元化。
本研究对48株RA分离株的ERIC-RCR聚类分析表明,从本地区分离到的菌株被聚为两大类。除鸭场1和3同时流行两类菌株外,其余14个鸭场只流行一类菌株。根据聚类分析结果,可以从两个聚类中各选1—2个强毒株作为候选疫苗株,制备多价疫苗,以期获得良好的免疫效果。
RA的血清学分型广泛用于RA的流行病学调查,但随着分子生物学技术的发展,血清学分型方法也出现了一定的局限性。李文阳等[9]认为具有相同血清型的不同分离株,在生化特性、致病性或抗原性等方面可能存在一定的差异。Rimler等[13]对从不同国家分离的RA菌株的基因组DNA指纹图谱研究表明,来源不同的RA,其基因型可能有着明显的差异;即使自同一地区分离的相同血清型RA菌株,其DNA指纹图谱也可能会有所不同。Kiss等[14]进一步证实了这点,并认为利用DNA指纹图谱技术对RA进行流行病学调查可以弥补血清分型的缺点,减少RA在群之间传播,从而降低该病原引起的损失。这些研究均表明,RA的血清学分型方法已不完全适合于RA的流行病学调查,以及对RA病的特异性防治研究。而开展RA的基因分型研究更有利于 RA病的特异性防治。本研究利用 ERIC引物,以 RA的基因组DNA为模板进行扩增,得到了重复性好且清晰的电泳图谱,不同菌株之间可见明显差异。ERIC-RCR作为一种实用的分子生物学方法,可在流行病学调查中对RA分离株进行基因分型。
