c-Myc转录上调长链非编码RNA ZEB1-AS1促进结直肠癌细胞增殖
2018-08-01汤锐明邱惠思潘辉林宋慧胜吴华振冯正富
汤锐明,邱惠思,黄 岩,潘辉林,宋慧胜,王 馨,吴华振,冯正富
广州医科大学附属第六医院//清远市人民医院放疗科,广东 清远 511518
长链非编码RNAs(lncRNAs)是一类无蛋白质编码功能且长度大于200 nt的转录本,近年来陆续发现一些lncRNAs参与结肠癌发生发展[1-2]。机制研究发现MALAT1可结合到SFPQ上,释放PTBP2,进而促进细胞增殖和转移[3]。CASC11在结直肠癌组织中高表达,与瘤体大小、淋巴结转移和TNM分期正相关[4]。本研究重点关注位于10号染色体的lncRNA ZEB1-AS1,生物信息学分析发现其表达与结直肠癌患者预后相关,探讨ZEB1-AS1在结直肠癌中的作用及相关分子机制,目前尚无相关报道。本研究为结直肠癌发生发展机制研究提供新的理论依据,为临床结直肠癌治疗提供新的潜在靶点。
1 资料与方法
1.1 细胞及培养
人正常结肠上皮细胞NCM460及结直肠癌癌细胞HT29、LOVO、SW480、SW620和HCT116均由本实验室保存。将细胞接种于含10%胎牛血清的1640培养液中,在37 ℃、5% CO2的培养箱中培养。
1.2 资料收集
21例结直肠癌癌患者手术标本及配对的癌旁组织是在患者知情同意的的情况下术后收集。手术标本做好标记后,保存于–80 ℃超低温冰箱。
1.3 RNA提取及逆转录
将30 mg组织用液氮多次研磨粉碎(或将细胞用预冷的PBS洗涤1次,离心弃上清),加入RTK裂解液700 μL,混匀后,加入700 μL无水乙醇,混匀,12 000 g,4 ℃离心15 min。取上清上柱,离心。弃废液,用RW1洗涤柱子1次,离心。用RW2洗涤柱子2次。空甩,12 000 g,3 min。用水溶解RNA,静置2 min。离心12 000 g,2 min。将RNA样品置于–80 ℃保存。
使用lnRcute lncRNA First-Strand cDNA Synthesis Kit(广州天根生物有限公司)逆转录,按照说明书配置反应体系。PCR运行程序如下:42 ℃ 15 min,95 ℃3 min。待PCR反应结束后,将样品保存在–20 ℃冰箱。
1.4 实时荧光定量PCR
购买天根生物有限公司的lnRcute lncRNA qPCR Detection Kit用于qRT-PCR。引物序列见表1。根据说明书配置PCR反应体系。PCR运行程序如下:95 ℃3 min, 95 ℃ 5 s,60 ℃ 15 s(38个循环)。根据2–ΔΔct值计算相对表达量。

表1 引物序列
1.5 载体构建
提取细胞基因组DNA,作为启动子扩增模板。使用TaKaRa的LA premix聚合酶进行PCR扩增。将目标片段与pMD20-T载体连接,送至华大基因有限公司测序。测序正确的克隆命名pMD20-wt-ZEB1-AS1。同时使用TaKaRa的定点突变试剂盒Mutant BEST进行c-Myc位点缺失的报告基因载体构建。按照说明书操作,并将测序正确的克隆命名为pMD20-del-ZEB1-AS1。使用限制性内切酶XhoⅠ和HindⅢ消化pGL4、pMD20-wt-ZEB1-AS1和pMD20-del-ZEB1-AS1,并用T4 DNA连接酶连接载体和目标片段,阳性克隆命名pGL4-wt-ZEB1-AS1和pGL4-del-ZEB1-AS1。
1.6 双荧光素酶报告基因
将NCM460细胞以10 000细胞/孔的密度接种96孔板,次日使用Lipofectamine 3000进行脂质体转染。细胞分为4组:共转c-Myc过表达质粒和野生型报告基因载体pGL4-wt-ZEB1-AS1;共转过表达对照质粒和野生型报告基因载体pGL4-wt-ZEB1-AS1;共转c-Myc过表达质粒和缺失型报告基因载体pGL4-del-ZEB1-AS1;共转过表达对照质粒和缺失型报告基因载体pGL4-del-ZEB1-AS1。48 h后,按照Promega的Dual-luciferase report assay试剂盒说明书操作,对上述细胞行双荧光素酶报告基因检测。每个孔荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
1.7 Westwen blot
蛋白裂解液处理细胞后,立即用BCA法测定总蛋白浓度。35 mg上样量将目标蛋白置于点样孔,待电泳结束,将其转移至PVDF膜上,5%牛奶封闭2 h,一抗4 ℃孵育过夜(antiGAPDH, 1:1000;anti-c-Myc,1:500),HRP偶联的辣根过氧化酶二抗孵育2 h,采用BioRad公司的ECL进行化学发光。
1.8 MTS实验
将目标细胞以1000细胞/孔的密度接种24孔板,细胞总体积为500 μL。待细胞贴壁后,加入50 μL MTS,在37 ℃、5% CO2的培养箱中孵育3 h。吸取200 μL培养基上清于96孔板,测量各孔0 d的绝对吸光值A490 nm。同样的,测量1、2、3、4、5、6 d的各孔绝对吸光值,统计分析各组细胞的活力。
1.9 统计学方法
所有实验均需重复3次,数据采用均数±标准差表示。采用统计学软件包SPSS 19.0进行分析,两组间比较用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ZEB1-AS1在结直肠癌中高表达
通过采用在线软件CPAT和CPC预测ZEB1-AS1的蛋白编码能力,两种软件均显示ZEB1-AS1无蛋白质编码功能(图1A)。实时荧光定量PCR结果显示ZEB1-AS1在结直肠癌细胞中的表达量高于正常结肠上皮细胞,其在LOVO中的表达量最高(图1B)。图1C显示ZEB1-AS1在21对结直肠癌组织中的表达量明显高于其配对的癌旁组织(P=0.0188)。最后,本研究选取132例ZEB1-AS1高表达的结直肠癌患者和132例ZEB1-AS1低表达的结直肠癌,通过oncoLnc预测了ZEB1-AS1表达量与结直肠癌患者预后的相关性,结果显示ZEB1-AS1高表达与结直肠癌患者较差的预后正相关(图1D)。
2.2 c-Myc转录上调ZEB1-AS1
在 生 物 学 网 站 Ensemble genome broswer 90(http://www.ensembl.org/index.html)上获取ZEB1-AS1 5'UTR 1000 bp序列作为其启动子,用在线软件JASPAR预测该启动子上可能的转录因子结合位点。结果发现c-Myc在ZEB1-AS1启动子上存在一个结合位点(图2A)。在NCM460细胞中过表达c-Myc,发现ZEB1-AS1表达量增高(图2B)。反之,在LOVO细胞中用shRNA敲低c-Myc蛋白水平的表达量,发现ZEB1-AS1表达也降低(图2C)。最后,将野生型及缺失型报告基因载体和c-Myc过表达质粒共转NCM460细胞,双荧光素酶报告基因结果提示c-Myc明显增加野生型报告基因载体的荧光素酶活性,而对缺失型报告基因载体无影响(图2D)。
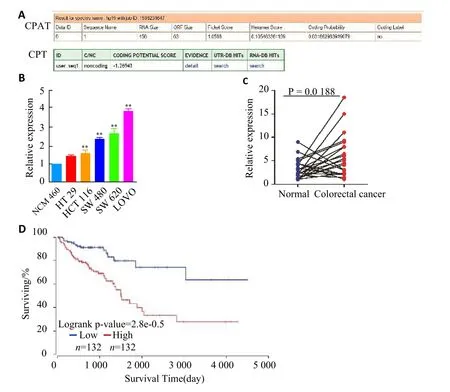
图1 ZEB1-AS1在结直肠癌中的表达量及临床意义
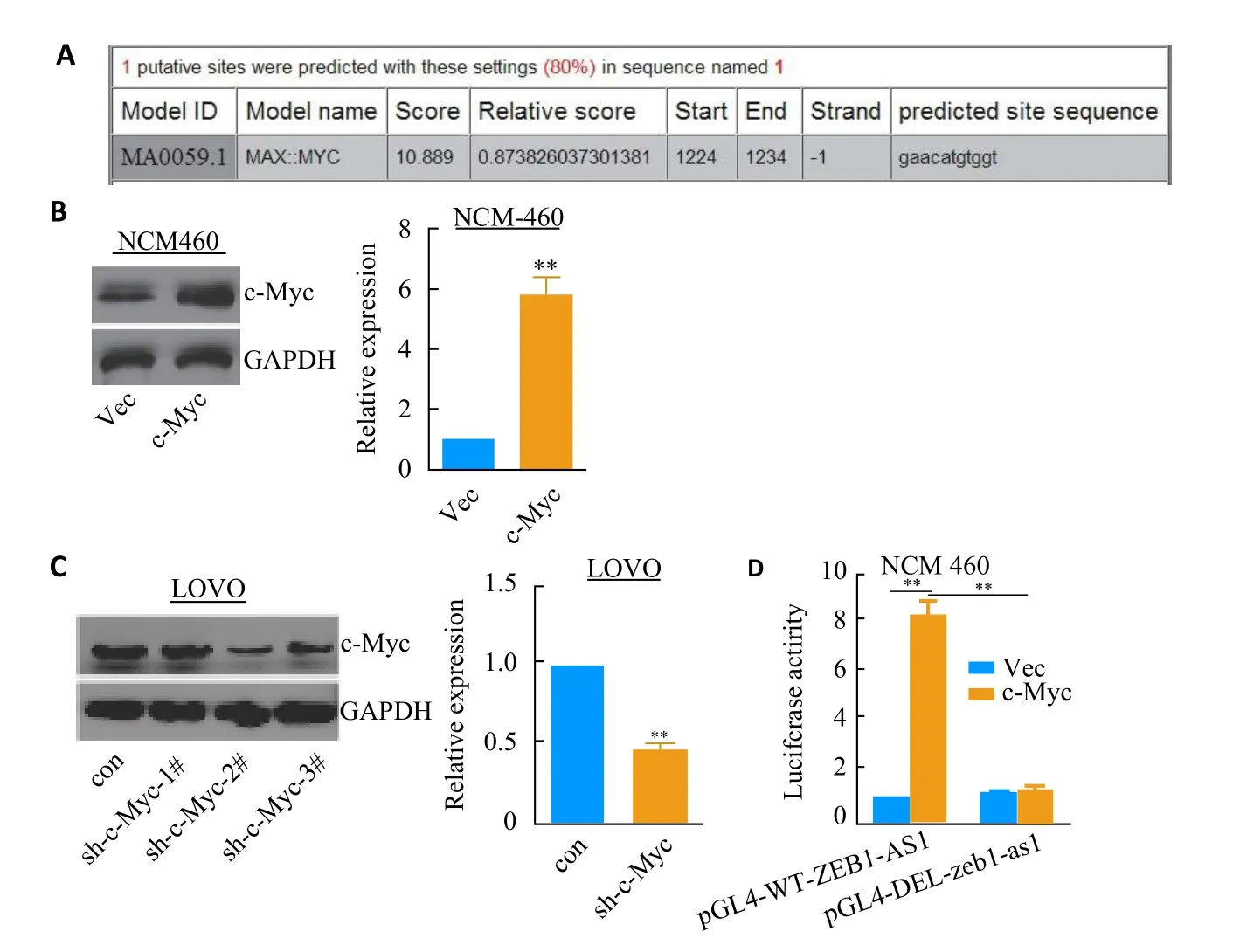
图2 c-Myc转录调控ZEB1-AS1的表达
2.3 ZEB1-AS1促进结直肠癌细胞增殖
过表达ZEB1-AS1后,NCM460细胞较对照组增殖能力增加,且具有显著性差异(图3A)。在结直肠癌细胞LOVO中转染靶向ZEB1-AS1的shRNAs,实时荧光定量PCR结果提示sh-1#对ZEB1-AS1具有较好的沉默效果,因此用于后续研究。MTS结果证实敲低ZEB1-AS1后细胞活力明显较对照组下调(图3B)。
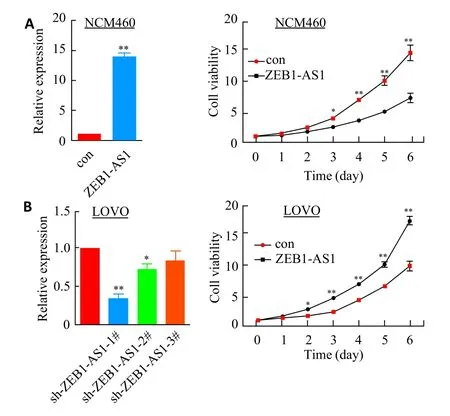
图3 ZEB1-AS1促进结直肠癌细胞增殖
3 讨论
目前关于ZEB1-AS1在肿瘤中的作用研究,主要集中在肝癌、膀胱癌、胶质瘤、骨肉瘤等肿瘤中[5-7]。ZEB1-AS1在骨肉瘤细胞和组织中高表达,且与瘤体大小、远端转移及较差的预后正相关,敲低ZEB1-AS1可抑制骨肉瘤细胞增殖和迁移[8-9]。ZEB1-AS1可促进膀胱癌细胞增殖和迁移[10]。本研究在结直肠癌中发现ZEB1-AS1具有相似的原癌功能,采用qRTPCR方法检测后发现ZEB1-AS1在结直肠癌细胞和组织中显著高表达。生物信息学预测发现ZEB1-AS1的表达量与结直肠癌患者预后正相关。本研究通过后期的功能实验发现ZEB1-AS1可促进结直肠癌细胞增殖。多项研究发现ZEB1-AS1可通过同源性竞争RNA的方式改变ZEB1的表达,进而发挥其原癌基因的功能[11-15]。
基因的表达受到多方位(如表观遗传学、转录水平、翻译水平和翻译后修饰等多个层次)的调控[16-17]。为探究ZEB1-AS1在结直肠癌中高表达的原因,本文重点研究了ZEB1-AS1的转录调控机制。采用生物信息学方法发现ZEB1-AS1启动子上有原癌基因c-Myc的结合位点,根据这一预测结果开展了双荧光素酶报告基因实验,结果证实c-Myc可转录上调ZEB1-AS1。c-Myc是一个原癌转录因子,在多种肿瘤中畸高[18-20]。c-Myc可在乳腺癌细胞、胶质瘤细胞和成纤维细胞中上调lncRNA H19[21]。ChIP实验证实c-Myc转录上调lncRNA BCYRN1[22]。
综上所述,ZEB1-AS1在结直肠癌细胞和组织中显著高表达,c-Myc转录上调ZEB1-AS1并促进结直肠癌细胞增殖。后期本研究将一方面扩大标本量,分析ZEB1-AS1的表达与临床病理特征的相关性;另一方面将深入探讨ZEB1-AS1推进结直肠癌的分子机制。
