两个一维之字链异三金属配位聚合物的合成、结构和磁性
2018-08-01王振平王庆伦仝玉章
刘 杨 王振平 王庆伦 仝玉章 杨 春*,
(1河北工业大学化工学院,天津 300130)
(2南开大学化学学院,天津 300071)
高阻塞温度的单分子磁体有望应用于超高密度信息存储元件,因此近20多年来合成新的单分子磁体已经成为分子磁学领域的热门课题。稀土离子因为具有大的磁矩和磁各向异性在合成高阻塞温度的单分子磁体方面扮演着重要角色,如双甲板式配合物[Tb(Pc)(Pc′)]的逆转能垒达到 652 cm-1[1-2]。
选择3d-4f异金属体系是设计合成新型单分子磁体的有效途径之一,理由是:容易设计合成能进一步与稀土离子发生配位反应的包含3d金属离子的配合物配体[3-4];容易用较少数目的3d和4f金属离子获得分子的高自旋基态[5];容易从稀土离子获得分子的磁各向异性[6]。例如,3d-4f单分子磁体[FeⅡ2DyⅢ]的各向异性能垒(Ueff)达到 319 cm-1(459 K)[7]。
近年来,基于隔室席夫碱配体的3d-4f异金属配合物引起人们的浓厚兴趣,常见的隔室席夫碱配体的结构和缩写如图1所示。以基于隔室席夫碱配体的3d-4f双核单元为构筑模块,选用[Cr(CN)6]3-[8-9]、[Fe(CN)6]3-[10-12]、[FeTp*(CN)3]-(Tp*=hydridotris(3,5-dimethylpyrazol-1-yl)borate)[13]、 [Fe(AA)(CN)4]-[14]、 [Co(CN)6]3-[15-16]、[Mo(CN)8]3-/[Mo(CN)8]4-[17-19]、[W(CN)8]3-[17-18]、[W(bipy)(CN)6]-[20]、N3-[21]、草酸根[8]和有机自由基[22]等不同的桥联配体进行自组装,人们得到了不同核数、维数和性质的体系。

图1 隔室席夫碱配体的结构Fig.1 Structures of the compartmental Schiff bases
我们基于隔室席夫碱配体N,N′-双 (3-甲氧基-水杨醛)缩-2,2-二甲基-1,3-丙二胺(H2Me2valpn),选用具有姜-泰勒效应的Cu(Ⅱ)和具有显著磁各向异性的Dy(Ⅲ)和Tb(Ⅲ)合成3d-4f构筑模块 [Cu(Me2valpn)Ln],再以[Fe(CN)6]3-为桥联配体,得到了2个结构新颖的氰根桥联一维链状3d-3d′-4f三金属配位聚合物{[Cu(Me2valpn)Dy(DMF)2(H2O)Fe(CN)6]·1.5H2O·0.5CH3OH}n(1)和{[Cu(Me2valpn)Tb(DMF)2(H2O)Fe(CN)6]·H2O·CH3OH}n(2),对2个配合物进行了单晶结构和红外光谱表征,并研究了配合物1的磁学性质,分析了其磁性与结构之间的关系。
1 实验部分
1.1 主要试剂与仪器
所用试剂均为市售分析纯。Vector-22傅立叶红外光谱仪;Bruker Smart 1000 CCD型X射线单晶衍射仪(德国 Bruker 公司);Quantum Design MPMS-7 SQUID型磁强计(美国Quantum Design公司);Perkin-Elmer 240C元素分析仪。
1.2 配体和配合物的合成
配体H2Me2valpn按照文献[23-24]方法合成:在三口烧瓶中加入3.043 0 g(20 mmol)邻香兰素,用150 mL甲醇溶解,再加入 1.022 0 g(10 mmol)2,2-二甲基-1,3-丙二胺,回流4 h,待反应液冷却到室温后,减压过滤,以冷的甲醇洗涤沉淀,真空干燥,得到3.163 0 g配体H2Me2valpn,产率85.28%。
配合物1和2均采用分步法合成[25],以配合物1为例介绍如下。在圆底烧瓶中加入1.852 0 g(5 mmol)H2(Me2valpn),用50 mL甲醇溶解后,逐滴加入浓度为 0.333 3 mol·L-1的 Cu(OAc)2·H2O 水溶液 15 mL,有绿色沉淀析出,搅拌反应6 h,过滤,得到1.825 0 g绿色微晶产物[Cu(Me2valpn],产率84.48%。
将0.05 mmol[Cu(Me2valpn)]溶解在15 mL甲醇中,搅拌下向上述甲醇溶液中逐滴加入浓度为0.010 0 mol·L-1的 Dy(NO3)3乙腈溶液 5 mL,搅拌 1 h 后,再逐滴加入浓度为0.025 0 mol·L-1的 K3[Fe(CN)6]水溶液2 mL,继续搅拌2 h后,滴入 2 mL DMF,搅拌 2 h。过滤,滤液常温缓慢挥发,几天后得到适合X射线单晶衍射分析的配合物1的绿色方块状晶体0.032 44 g,产率32%。元素分析结果,C67H90Cu2Dy2Fe2N20O18(2 027.36, 括号内为理论值,%):C,39.51(39.69);H,4.30(4.47);N,14.04(13.82)。 配合物 2 的合成方法和配合物1相同,只是把Dy(NO3)3·6H2O换成 Tb(NO3)3·6H2O,产量 0.029 50 g,产率 29%。 元素分析结果,C68H92Cu2Tb2Fe2N20O18(2 034.23,括号内为理论值,%):C,39.64(40.15);H,4.65(4.56);N,13.83(13.77)。
1.3 配合物的晶体结构测定
单晶X射线衍射结构测定在Bruker Smart 1000 CCD衍射仪上进行。在113 K下,用经过石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)以ω-2θ扫描方式收集衍射数据。晶体结构用直接法解出,然后用最小二乘法对全部非氢原子坐标及其温度因子进行精修。氢原子的位置由理论加氢得到。所有的计算使用SHELXS-97和SHELXL-97程序包进行[26-27]。配合物1和2的具体晶体学数据和结构精修参数列于表1。主要的键长和键角列于表2。
CCDC:1815462,1;1815483,2。

表1 配合物1和2的晶体学和结构精修参数Table 1 Crystal data and structure refinement for complexes 1 and 2
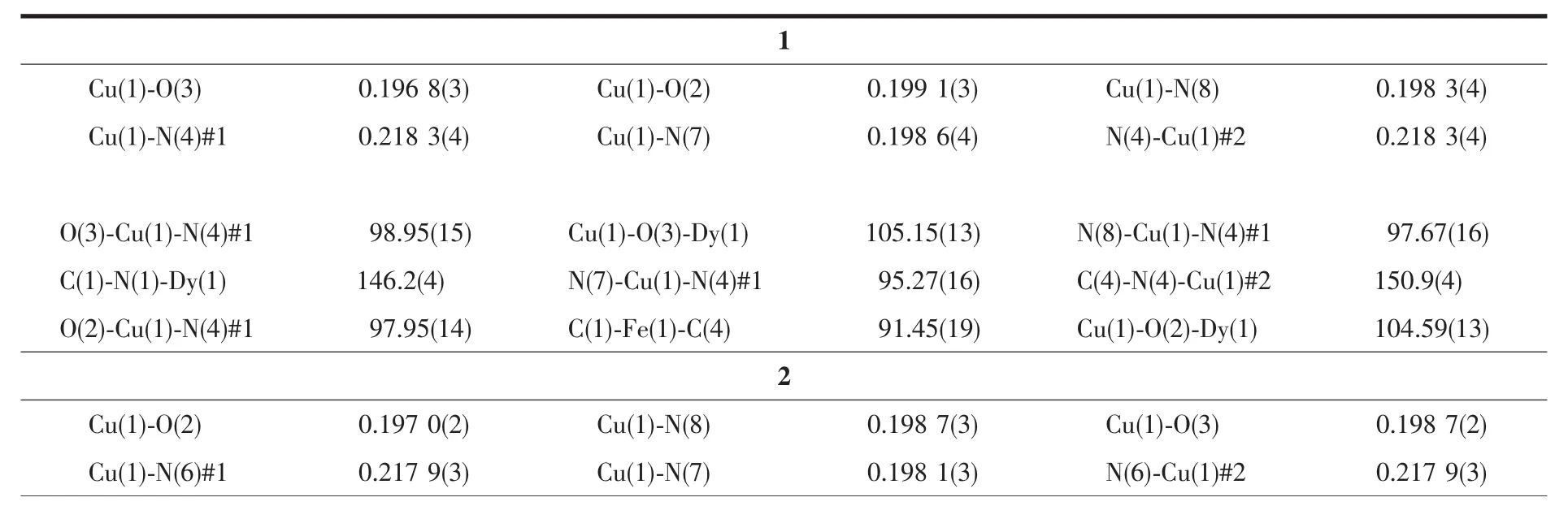
表2 配合物1和2的部分键长(nm)和键角(°)Table 2 Selected bond lengths(nm)and angles(°)for complexes 1 and 2
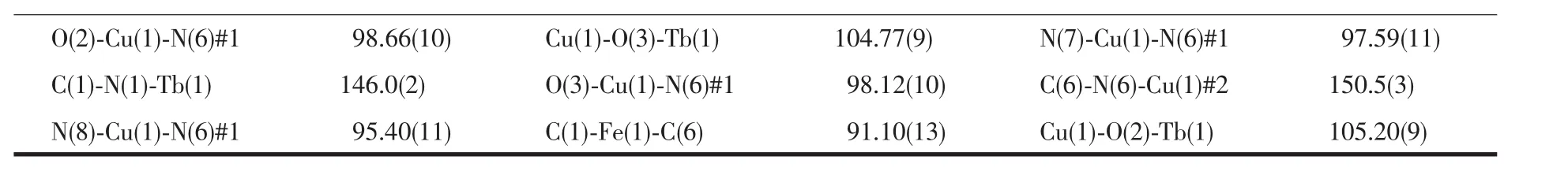
续表2
2 结果与讨论
2.1 配合物1和2的晶体结构
配合物1和2是同构的,以配合物1为例说明其晶体结构。如图2所示,在配合物1的[Cu(Me2valpn)Dy(H2O)(DMF)2Fe(CN)6]单元中,Cu2+首先和来自Me2valpn2-配体内室的N2O2配位(2个亚胺氮原子 Cu(1)-N(7)0.198 6 nm,Cu(1)-N(8)0.198 3 nm,2个酚氧 Cu(1)-O(2)0.199 1 nm,Cu(1)-O(3)0.196 8 nm),亲氧的Dy3+除了和来自Me2valpn2-配体外室的O2O2配位之外 (2个氧原子来自酚氧基Dy(1)-O(2)0.230 9 nm,Dy(1)-O(3)0.231 5 nm,另外2个氧原子来自甲氧基Dy(1)-O(1)0.256 9 nm,Dy(1)-O(4)0.254 8 nm),还与2个DMF分子的O原子(Dy(1)-O(5)0.227 6 nm,Dy(1)-O(6)0.233 2 nm)、1个配位 H2O 分子的 O原子(Dy(1)-O(7)0.232 4 nm)以及1个[Fe(CN)6]3-的氰根C(1)≡N(1)的N原子配位(Dy(1)-N(1)0.243 1 nm),从而形成NO7的八配位模式。Cu2+和Dy3+通过双酚氧桥连接,2个酚氧桥桥联键角Cu(1)-O(2)-Dy(1)和Cu(1)-O(3)-Dy(1)分别为 104.59°和 105.15°,Cu(1)O(2)O(3)与Dy(1)O(2)O(3)两个平面的二面角为 16.9°,明显比配合物{[CuⅡ(valpn)LnⅢ(H2O)3(μ-NC)2FeⅢ(phen)(CN)2{(μ-NC)FeⅢ(phen)(CN)3}]NO3·7H2O}n中的相应二面角8.47°大[14],单元内Cu…Dy距离为 0.340 76 nm,与文献值一致[28]。Fe3+与6个氰根配位而处在八面体的配位环境中,6个Fe-C≡N键角在173.1°~179.0°范围内,其中的 C(1)≡N(1)和 C(4)≡N(4) 处在顺式位置上(∠C(1)-Fe(1)-C(4)=91.45°)。
如图3所示,[Cu(Me2valpn)Dy(H2O)(DMF)2Fe(CN)6]单元之间通过来自[Fe(CN)6]3-的氰根 C(4)≡N(4)与Cu(Ⅱ)轴向配位形成之字形1D链,从而使Cu(Ⅱ)的配位数增加到5,在CuN3O2四方锥配位多面体中,赤道平面上Cu-N/O键长在0.196 8~0.199 1 nm之间,轴向的配位键(Cu(1)-N(4)#1 0.218 3 nm)明显比赤道平面内的配位键长,说明Cu(1)-N(4)#1方向是Cu(Ⅱ)的姜-泰勒轴的方向[10,16]。需要说明的是,配合物1中的轴向Cu-N配位键明显比梯字形1D链配合物[Cu(valen)Sm(H2O)3Fe(CN)6]2·6H2O 和[Cu(valen)2Pr(H2O)Fe(CN)6]2·4H2O 中的 Cu-N 键(0.258 2 nm)短[11]。 总结发现,基于多氰根配合物[M(CN)6]3-(M=Fe,Co,Cr)或[Fe(Tp*)(CN)3]-与[M′(L)(Ln)]3+或{[M′(L)]2(Ln)}3+(M′=Cu(Ⅱ),Ni(Ⅱ),L=隔室席夫碱配体)的1D链状配位聚合物,除了每个[M(CN)6]3-提供3个氰根作为桥联配体形成的梯形链外[8,10-11,15-16],还有反式的2个氰根只与相邻单元的M′(Ⅱ)配位的{[Cu2(Me2valpn)2Ln(H2O)Fe(CN)6]·xH2O·yCH3CN}n[29],只与相邻单元的 Ln(Ⅲ)配位的[(Mevalen)Cu(H2O)Ln(MeOH)(H2O)2(μ-CN)2Fe(CN)4]·2H2O[28],分别与相邻单元的M′(Ⅱ)和Ln(Ⅲ)配位的{[Cu(valen)Sm(H2O)4][Cr(CN)6]·CH3OH·3H2O}n[30]; 也有顺式的2个氰根只与相邻单元的M′(Ⅱ)配位的{[Ni(valpn)Ln(NO3)2(H2O)Fe(Tp*)(CN)3]·2CH3CN·CH3OH}n[13]。但就我们所知,配合物1和2是首例来自[Fe(CN)6]3-的顺式的2个氰根分别与相邻单元的Cu(Ⅱ)和Dy(Ⅲ)或Tb(Ⅲ)配位的1D链状配位聚合物。这是由配体的空间位阻、稀土离子半径的大小、原料物质的量之比和溶剂体系等因素决定的[12]。
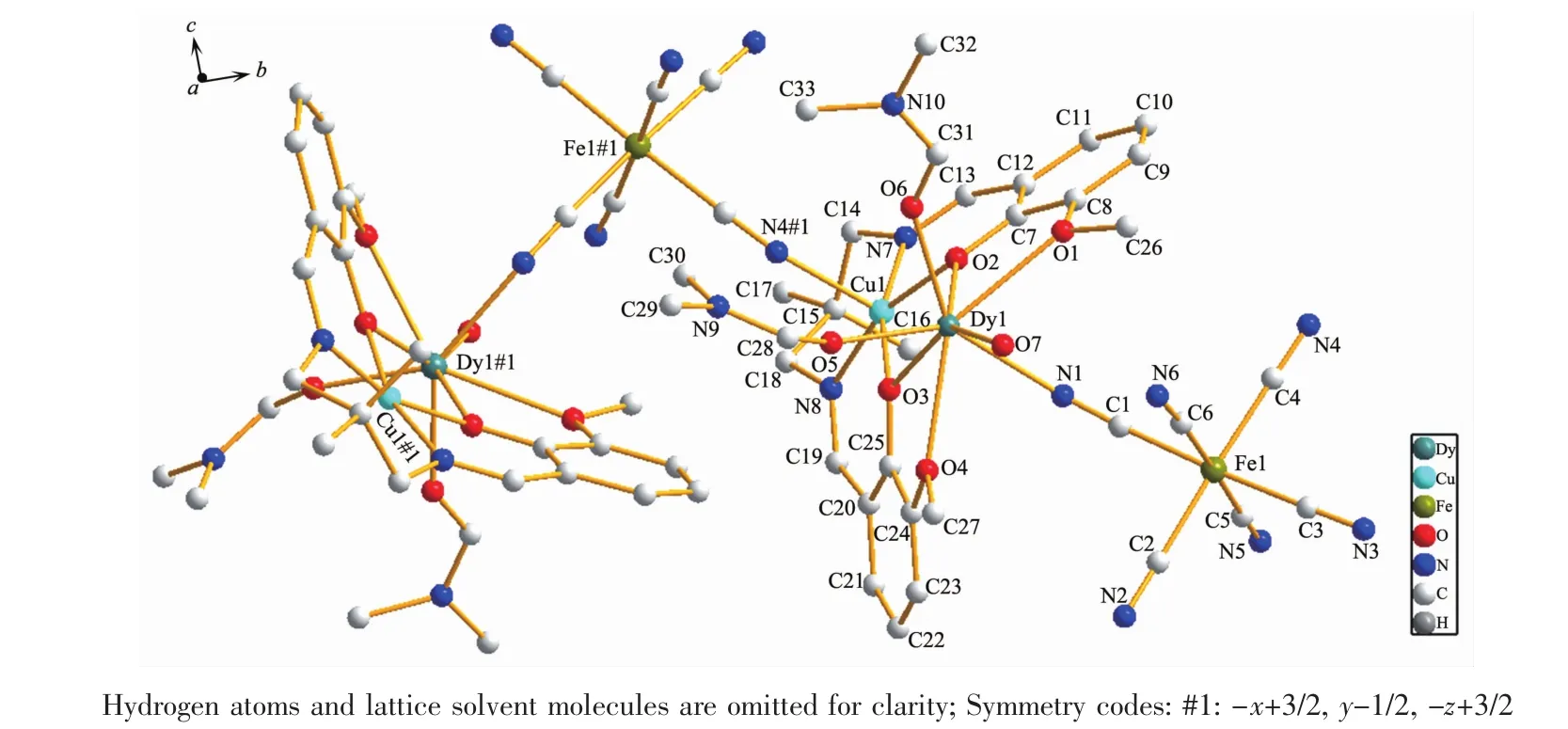
图2 配合物1中Cu(Ⅱ)和Dy(Ⅲ)的配位环境图Fig.2 View of the coordination environment of the Cu(Ⅱ) and Dy(Ⅲ) ions
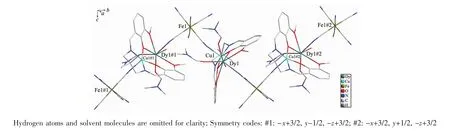
图3 配合物1的一维之字链结构Fig.3 One-dimensional zig-zag chain structure of complex 1
在氰根桥联结构Fe(Ⅲ)-C≡N-Dy(Ⅲ)和Fe(Ⅲ)-C≡N-Cu(Ⅱ)中,Fe(Ⅲ)…Dy(Ⅲ)和Fe(Ⅲ)…Cu(Ⅱ)距离分别为0.522 1和0.509 3 nm,均与文献值一致[14]。氰根桥联键角 C(1)-N(1)-Dy(1)和 C(4)-N(4)-Cu(1)#2分别为146.2°和 150.9°,明显偏离 180°。配合物 1中四方锥构型的Cu(Ⅱ)的孤电子对位于dx2-y2轨道,来自氰根的氮原子坐落在Cu(Ⅱ)的姜-泰勒轴方向,氰根桥联键角 C(4)-N(4)-Cu(1)#2 为 150.9°,使 Cu(Ⅱ)的 dx2-y2轨道和低自旋的Fe(Ⅲ)的dxy轨道重叠成为可能,从而使Cu(Ⅱ)-Fe(Ⅲ)通过氰根可能传递反铁磁相互作用[29]。晶体中相邻的一维链间Fe(Ⅲ)…Fe(Ⅲ)、Dy(Ⅲ)…Dy(Ⅲ)和Cu(Ⅱ)…Cu(Ⅱ)最近距离分别为 0.996 4、0.899 6和0.904 3 nm。
2.2 配合物1和2的红外光谱
在室温下,对配合物1和2进行固态红外光谱测试(KBr压片)。红外光谱中,自由的[Fe(CN)6]3-中的C≡N伸缩振动峰在2 119 cm-1。在2 114和2 111 cm-1处的中等强度吸收峰被分别指认为配合物1和2中[Fe(CN)6]3-的C≡N伸缩振动峰。自由Schiff base配体的C=N伸缩振动在1 675~1 600 cm-1间。在1 633和1 630 cm-1处的强吸收峰可分别指认为配合物1和2的C=N伸缩振动峰[8,29]。
2.3 配合物1的磁学性质
配合物1在2~300 K范围内的变温磁化率如图4所示,其χMT-T曲线变化趋势与之字形一维链的配合物{[Cu2(Me2vapln)2Dy(H2O)Fe(CN)6]·5.5H2O·2.5CH3CN}n和[LCu(H2O)Gd(MeOH)(H2O)2(μ-CN)2Fe(CN)4}]·2H2O 相似[28-29]。 在300 K时,配合物1的χMT值为 31.825 cm3·mol-1·K,略高于 2 个孤立的 Cu2+离子、2个孤立Dy3+离子和2个低自旋Fe3+离子的χMT的加和值 29.84 cm3·mol-1·K(gCu=gFe=2.00,gDy=4/3,JDy=15/2),这与低自旋Fe(Ⅲ)的一级轨道角动量有关[16,28-29]。 随着温度降低,χMT 值逐渐增大,在 9.5 K时达到最大值 53.158 cm3·mol-1·K,我们认为尽管配合物1中Cu(1)O(2)O(3)与Dy(1)O(2)O(3)两个平面的二面角较大(16.9°),可能意味着Cu(Ⅱ)和Dy(Ⅲ)之间通过双酚氧桥传递的铁磁相互作用较弱[14],但这种铁磁相互作用仍然在配合物中起主导作用[19,21,28-29,31]。从9.5 K开始,χMT随着温度降低突然减小,2 K时减小为 42.046 cm3·mol-1·K, 这可能是由于 Dy3+离子Stark亚能级分裂或链间的反铁磁相互作用造成的[12,14,29]。在9.5~300 K温度范围内,对配合物1的磁化率数据用 Curis-Weiss定律 χM=C/(T-θ)拟合得到C=31.86 cm3·mol-1,θ=13.17 K。Weiss常数 θ为正值,也表明配合物1内的顺磁离子间在高温区整体表现为铁磁相互作用[29]。

图4 配合物1的 χM-T和χMT-T曲线图Fig.4 Plots of χMT vs T and χMvs T for complex 1
如图5所示,在2 K时随着外磁场增强,配合物1的磁化强度逐渐增大。当外磁场为8 T时,配合物1的磁化强度增加到10.9NμB,但远没有达到配合物1的理论饱和值24NμB,这是由于晶体场效应引起的磁各向异性造成的[28,31]。
在零直流外场和交流磁场的强度为3.0 Oe、交流磁场频率分别为100和1 000 Hz的条件下,对配合物1进行了低温交流磁化率的测试。如图6所示,在100和1 000 Hz两种频率的交流磁场下,配合物1虚部交流磁化率数值均接近于零,表明配合物在该条件下不具有单分子磁体行为。证明Fe(Ⅲ)-C≡NDy(Ⅲ)桥联结构对成就单分子磁体或单链磁体具有不利影响[28-29]。配合物 1 中含有 Cu2+、Dy3+、Fe3+三种自旋载体,双酚氧桥和氰根桥2种桥联模式,顺磁离子间的磁相互作用复杂,为了更准确地研究其磁性,还有待选用抗磁离子Y3+、La3+或磁各向同性离子Gd3+代替Dy3+,或以抗磁性的[Co(CN)6]3-代替顺磁性的[Fe(CN)6]3-,合成一系列同构的配合物,以便详细研究体系的磁学性质[9]。
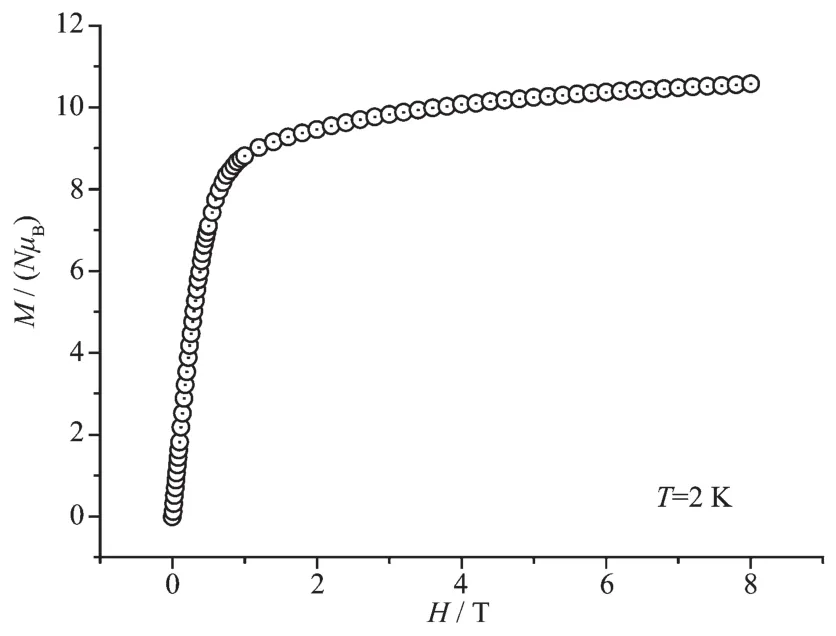
图5 配合物1的磁化强度随外场的变化曲线图Fig.5 Magnetization as a function of the applied magnetic field for complex 1

图6 配合物1的交流磁化率的实部(χ′)和虚部(χ″)随温度和交流磁场频率的变化曲线图Fig.6 Temperature and frequency dependence of the in-phase(χ′)and out-of-phase(χ″)components of the AC magnetic susceptibility for complex 1 with a 3.0 Oe oscillating AC field and a zero static DC field
3 结 论
在CH3OH-CH3CN-DMF介质中,采用分步法合成了2个基于隔室席夫碱配体H2Me2valpn的氰根桥联配位聚合物{[Cu(Me2valpn)Dy(DMF)2(H2O)Fe(CN)6]·1.5H2O·0.5CH3OH}n(1)和{[Cu(Me2valpn)Tb(DMF)2(H2O)Fe(CN)6]·H2O·CH3OH}n(2)。 晶体结构解析表明配合物1和2均属于三斜晶系,P21/n空间群。晶体中[Cu(Me2valpn)Ln(H2O)(DMF)2Fe(CN)6]单元之间通过来自[Fe(CN)6]3-的氰根与Cu(Ⅱ)轴向配位形成之字形1D链,是首例来自[Fe(CN)6]3-的顺式的2个氰根分别与相邻的[Cu(Me2valpn)Ln]3+单元的Cu(Ⅱ)和Dy(Ⅲ)或Tb(Ⅲ)配位的1D链状配位聚合物。这为设计合成新的低维异三金属配位聚合物提供了有益的信息。变温磁化率测试表明,在9.5~300 K,配合物1中Cu(Ⅱ)和Dy(Ⅲ)之间通过双酚氧桥传递的铁磁相互作用起主导作用;磁饱和曲线测试表明配合物1具有显著的磁各向异性;交流磁化率测试表明,在零直流外场和交流磁场强度为3.0 Oe,交流磁场频率分别为100和1 000 Hz的条件下,配合物1没有表现出缓慢磁弛豫现象。
