HMGB1及TLR4与Ⅱ型糖尿病及肥胖症的相关性研究①
2018-08-01王献春刘国燕宋向凤
刘 帅 王献春 杨 灿 刘国燕 丁 宇 宋向凤
(新乡医学院第三附属医院输血科,新乡 453003)
Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)和(Obesity,OB)是与生活方式紧密相连的内分泌代谢性疾病,二者发病机制复杂,至今仍未完全阐明,近年来炎症反应病因学理论受到广泛关注,该理论认为,T2DM是一种慢性低度炎症性疾病,炎症因子可通过增加胰岛素抵抗,促进T2DM的发生和发展;OB患者脂肪组织中的T细胞和巨噬细胞含量明显增加,二者通过影响前脂肪细胞和脂肪细胞的功能引起炎症因子表达上调,诱导并参与机体的炎症反应,因此,肥胖也被认为是一种自然免疫和全身低度慢性炎症性疾病[1]。
高迁移率族蛋白B1(High mobility group box-1,HMGB1)作为近年来发现的重要新型晚期炎症介质,是高迁移率族蛋白B家族中唯一可释放到细胞外并具有细胞因子活性的蛋白分子,可介导多种急慢性炎症性疾病[2]。前期研究显示,高脂饮食诱导的肥胖小鼠脂肪组织和外周血中HMGB1表达水平增高,但关于HMGB1及TLR4与T2DM及OB的相关性研究还未见报道,HMGB1及TLR4与T2DM及OB的发生发展是否有关也待进一步研究。
1 资料与方法
1.1资料
1.1.1实验对象 本次实验选取2017年1月至8月新乡医学院第三附属医院内分泌科住院患者以及同期在我院健康体检中心体检人员共80例作为研究对象,其中男40例,女40例。根据T2DM诊断标准和口服葡萄糖耐量试验(Oral glucose tolerance,test,OGTT)结果判断标准以及OB的诊断标准,按2×2析因实验设计方法将研究对象分为T2DM-OB组、T2DM-NOB组、NGT-OB组、NGT-NOB组,共4组,每一组为20例,男10例,女10例。4组受检者的性别构成及年龄间具有均衡性(P>0.05)。
1.1.2实验试剂 TrizolReagent购自Gibco公司;SYBG Green PCR Master Mix购自ABI公司;PBS缓冲液由新乡医学院免疫学研究中心配制;RBC Lysis Buffer(10×)购自上海嵘崴达实业有限公司;异丙醇购自天津博迪化工股份有限公司;三氯甲烷购自烟台市双双化工有限公司;无水乙醇购自天津市德恩化学试剂有限公司;dNTPs、随机引物、核糖核酸酶抑制剂(RNase inhibitor)、5 × Reverse transcriptase buffer购自TaKaRa;HMGB1 ELISA检测试剂盒购自武汉云克隆科技股份有限公司。
1.2方法
1.2.1ELISA 将各浓度标准品液、空白孔液、待测标本均100 μl加入相对应的酶标孔板底部,不要产生气泡,轻轻混匀,封膜,37℃温育1 h。甩去孔内液体,加100 μl/孔检测试剂A,封膜,37℃温育1 h。加350 μl/孔稀释洗涤液(1×),静置1~2 min,甩去孔内液体,洗板3次,最后一次在吸水纸上拍干。加100 μl/孔检测试剂B,封膜,37℃温育30 min。洗板5次。加90 μl/孔底液,换膜封板,37℃避光温育10~20 min。加终止液50 μl/孔,混匀后即刻在酶标仪450 nm波长处测量各孔光密度值(OD值)。
1.2.2细胞总RNA提取及qPCR 首先利用红细胞裂解液(10×RBC Lysis buffer)将红细胞裂解,用Trizol提取总RNA,逆转录合成cDNA,取cDNA2.1 μl、SYBR Select Master Mix 20 μl、引物18.9 μl(由原液稀释20倍后的工作液),总体积为41 μl,混匀后每个20 μl分别加样在1主孔和1副孔,上机进行PCR反应,反应条件为:50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1 min扩增40个循环,以GAPDH作为内参,进行结果分析。Real-time qPCR所用的引物序列见表1。
1.2.3相关生化指标的测定 空腹血糖(Fasting plasma glucose,FPG)、三酰甘油(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、高密度脂蛋白(High density lipoprotein,HDL)、低密度脂蛋白胆固醇(Low density lipoprotein,LDL)等生化指标均在日立7600-020全自动生化分析仪上进行检测,步骤略。
表1Real-timequantitativePCR引物
Tab.1Real-timequantitativePCRprimers
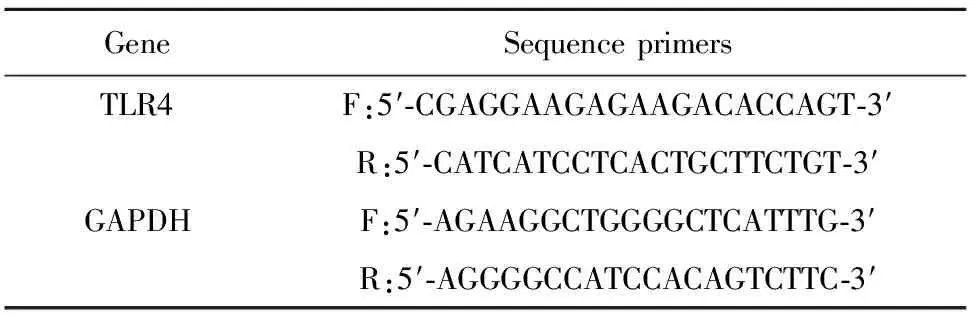
GeneSequenceprimersTLR4F:5′⁃CGAGGAAGAGAAGACACCAGT⁃3′R:5′⁃CATCATCCTCACTGCTTCTGT⁃3′GAPDHF:5′⁃AGAAGGCTGGGGCTCATTTG⁃3′R:5′⁃AGGGGCCATCCACAGTCTTC⁃3′
2 结果
2.1HMGB1浓度在不同组的比较分析 T2DM-OB组浓度高于T2DM-NOB组(P<0.05),差异具有统计学意义;NGT-OB组浓度高于NGT-NOB组(P<0.05),差异具有统计学意义;T2DM-OB组浓度高于NGT-OB组(P<0.001),差异具有显著统计学意义;T2DM-NOB组浓度高于NGT-NOB组(P<0.001),差异具有显著统计学意义,见图1和表2。
2.2不同组的TLR4表达水平的比较分析 qPCR检测显示,T2DM-OB组表达水平高于T2DM-NOB组(P<0.001),差异具有显著统计学意义;NGT-OB组表达水平高于NGT-NOB组(P<0.001),差异具有显著统计学意义;T2DM-OB组表达水平高于NGT-OB组(P<0.001),差异具有显著统计学意义; T2DM-NOB组表达水平高于NGT-NOB组(P<0.001),差异具有显著统计学意义,见图2和表3。
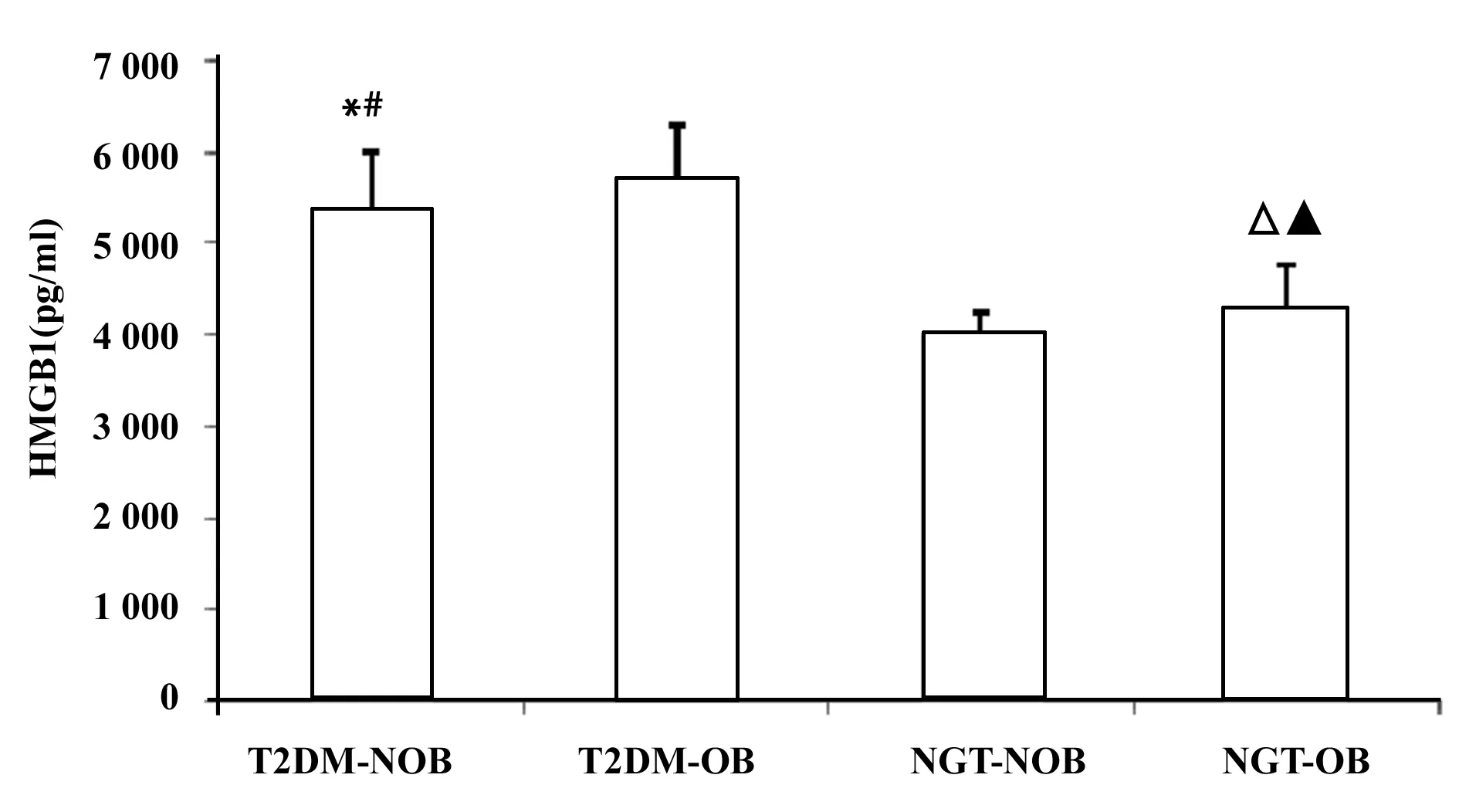
图1 HMGB1浓度Fig.1 Concentration of HMGB1Note:Compared with T2DM-OB,*.P<0.05,#.P<0.001;compared with NGT-NOB,△.P<0.001,▲.P<0.05.
表2HMGB1浓度
Tab.2ConcentrationofHMGB1
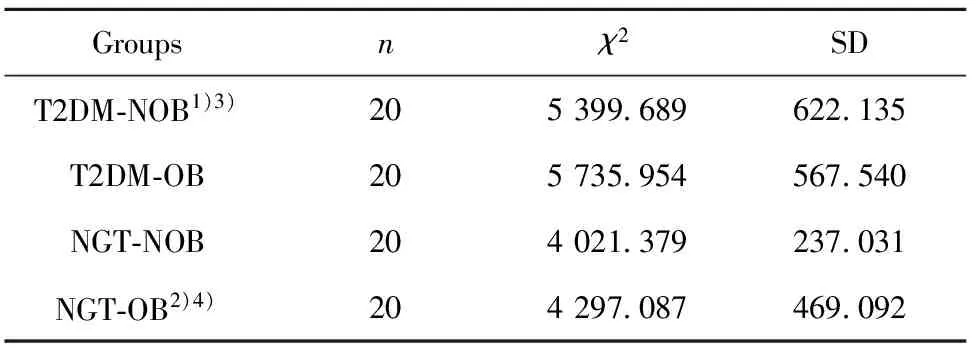
Groupsnχ2SDT2DM⁃NOB1)3)205399 689622 135T2DM⁃OB205735 954567 540NGT⁃NOB204021 379237 031NGT⁃OB2)4)204297 087469 092
Note:Compared with T2DM-OB,1)P<0.05,2)P<0.001;compared with NGT-NOB,3)P<0.001,4)P<0.05.
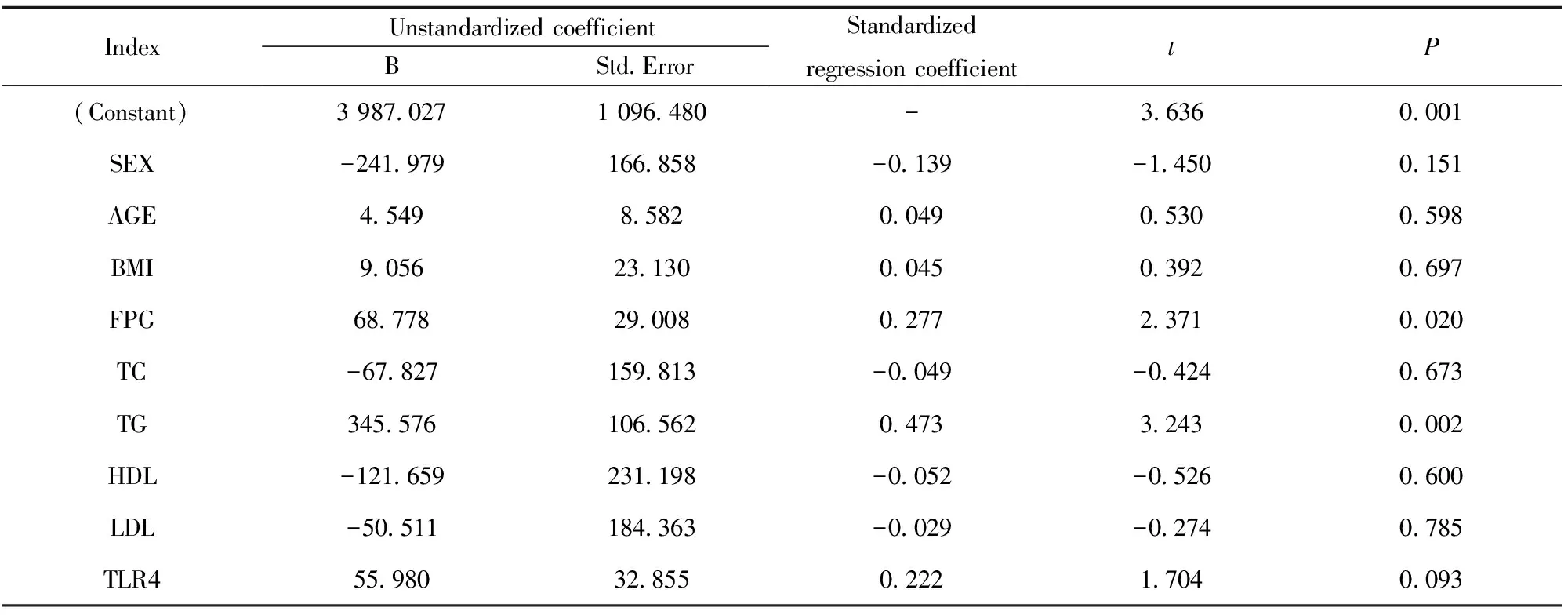
2.3HMGB1与各指标的相关性分析 相关性分析结果显示,HMGB1和TLR4呈正相关(r=0.549,P<0.001),具有显著统计学意义,见图3;HMGB1和BMI(r=0.386)、TG(r=0.621)、FPG(r=0.543)均呈正相关(P<0.001),而和HDL呈负相关(r=-0.255),P<0.05, 见图4~7。以HMGB1为因变量,以性别、年龄、BMI、FPG、TC、TG、HDL和LDL等因素为自变量,拟合多元线性回归模型,模型的拟合优度R2=0.465,拟合优度较好,自变量对因变量的解释程度较高。利用方差分析对HMGB1多元回归分析模型进行检测,得出回归模型P<0.001,说明该模型有显著的统计学意义。通过回归分析的结果显示,自变量中只有FPG和TG的回归系数有统计学意义(P<0.05),两指标对HMGB1有预测作用,见表4。
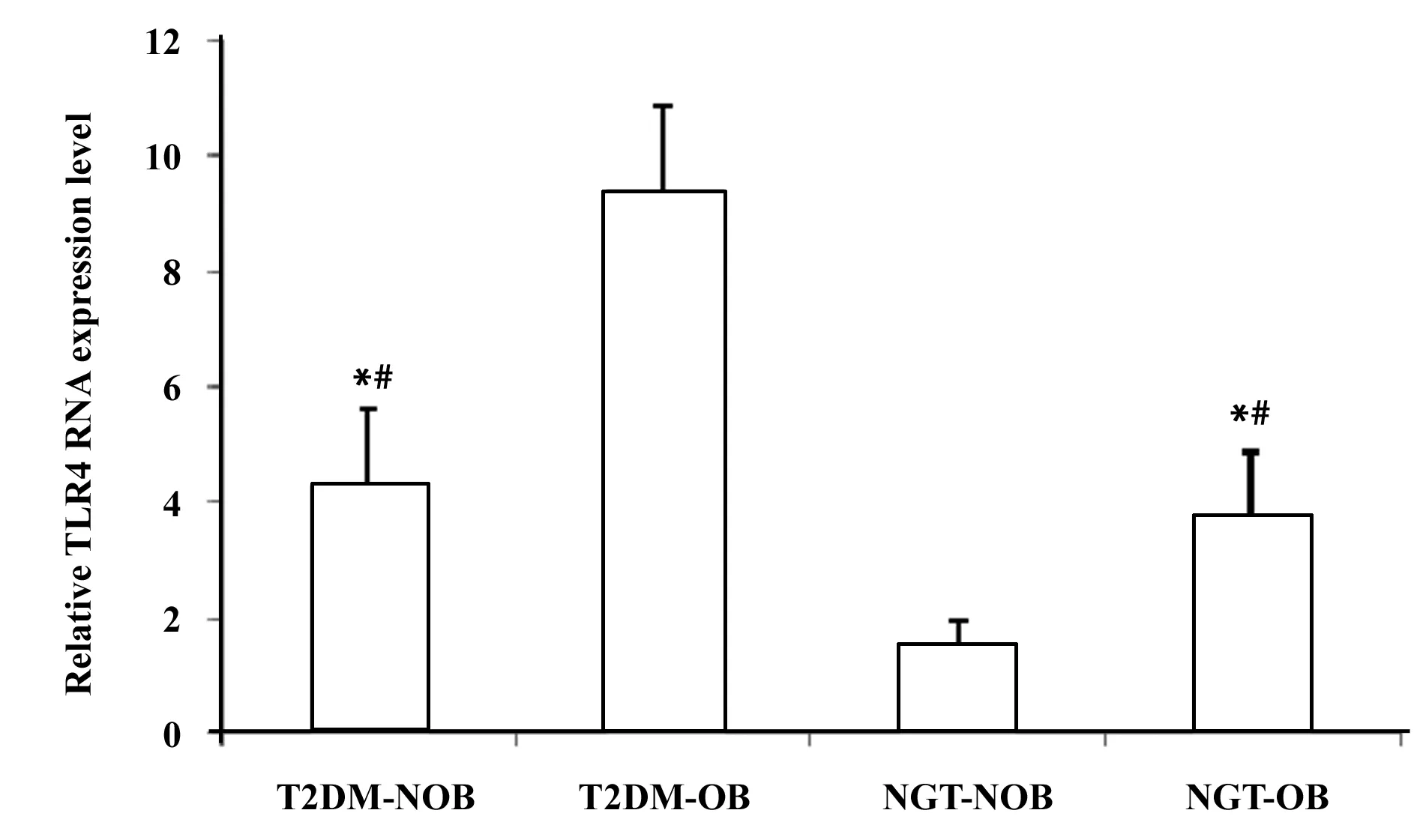
图2 TLR4表达水平Fig.2 Expression levels of TLR4 Note:Compared with T2DM-OB,*.P<0.001;compared with NGT-NOB,#.P<0.001.
表3TLR4表达水平
Tab.3ExpressionlevelsofTLR4
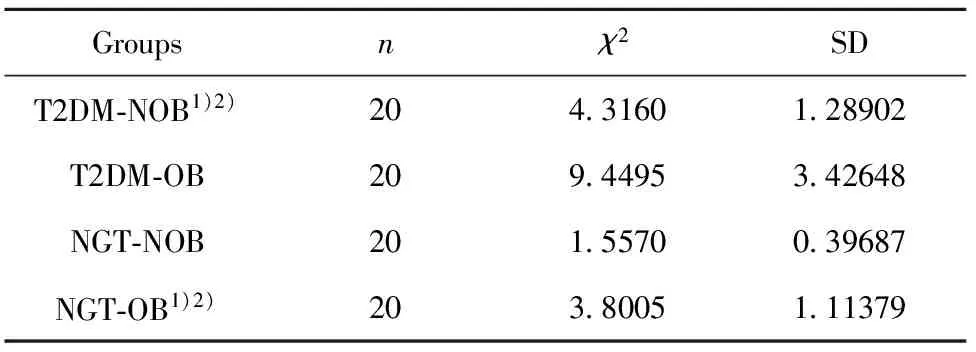
Groupsnχ2SDT2DM⁃NOB1)2)204 31601 28902T2DM⁃OB209 44953 42648NGT⁃NOB201 55700 39687NGT⁃OB1)2)203 80051 11379
Note:Compared with T2DM-OB,1)P<0.001;compared with NGT-NOB,2)P<0.001.
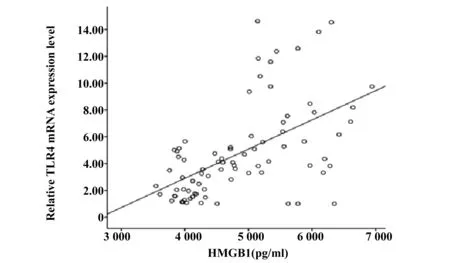
图3 HMGB1和TLR4的相关性(r=0.549,P<0.001)Fig.3 Linear correlation analysis between HMGB1 and TLR4(r=0.549,P<0.001)
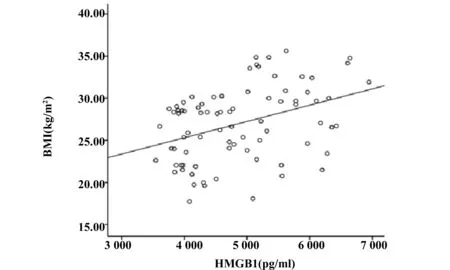
图4 HMGB1和BMI的相关性(r=0.386,P<0.001)Fig.4 Linear correlation analysis between HMGB1 and BMI(r=0.386,P<0.001)
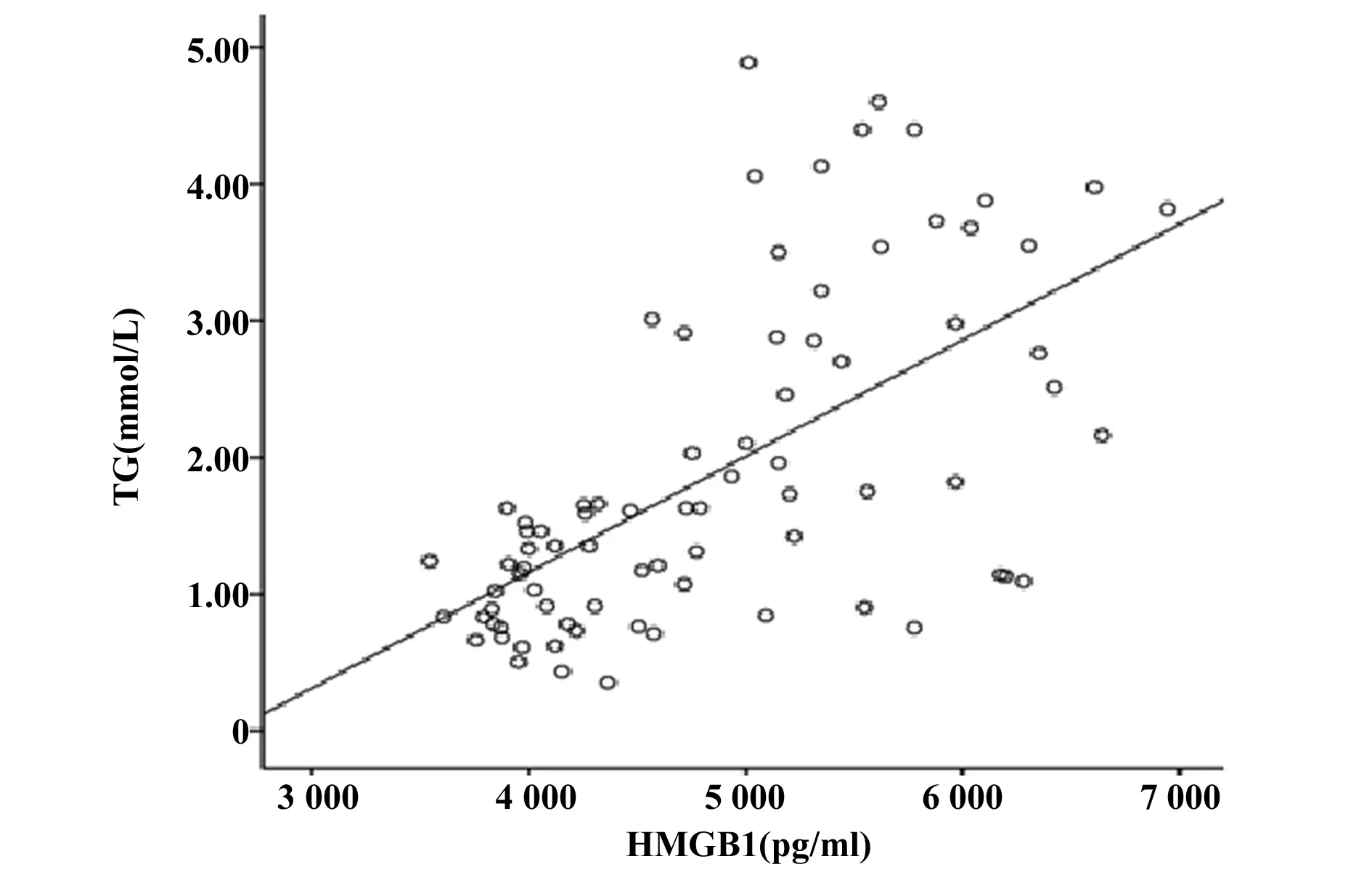
图5 HMGB1和TG的相关性(r=0.621,P<0.001)Fig.5 Linear correlation analysis between HMGB1 and TG(r=0.621,P<0.001)
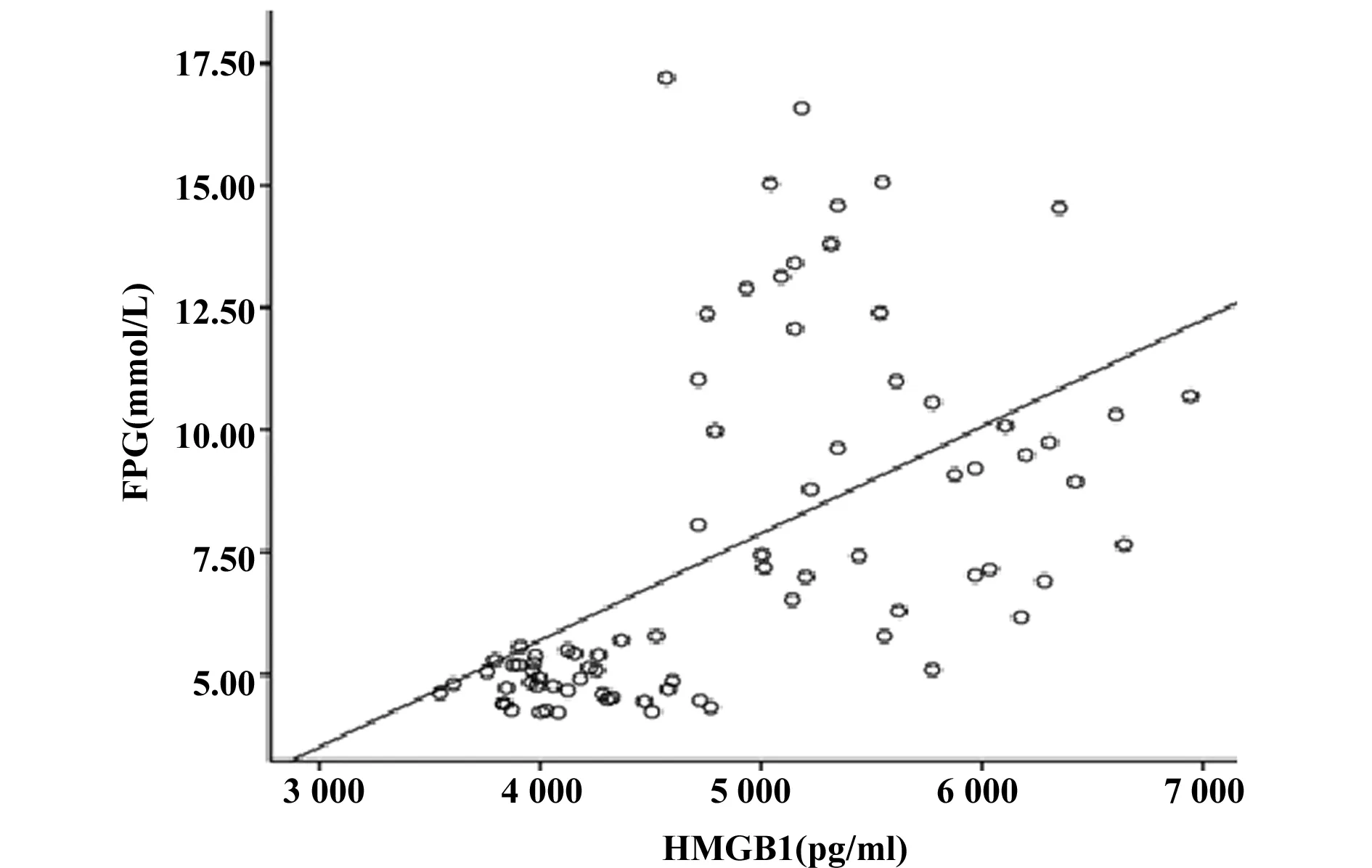
图6 HMGB1和FPG的相关性(r=0.543,P<0.001)Fig.6 Linear correlation analysis between HMGB1 and FPG(r=0.543,P<0.001)
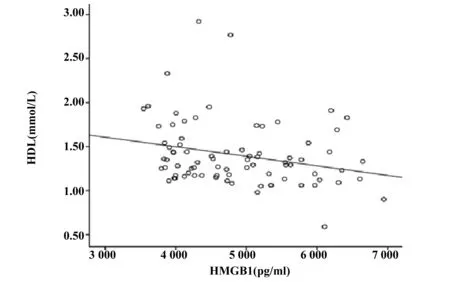
图7 HMGB1和HDL的相关性(r=-0.255,P<0.001)Fig.7 Linear correlation analysis between HMGB1 and HDL(r=-0.255,P<0.001)
表4HMGB1多元回归分析
Tab.4MultiplelogisticregressionanalysisofHMGB1
IndexUnstandardizedcoefficientBStd ErrorStandardizedregressioncoefficienttP(Constant)3987 0271096 480-3 6360 001SEX-241 979166 858-0 139-1 4500 151AGE4 5498 5820 0490 5300 598BMI9 05623 1300 0450 3920 697FPG68 77829 0080 2772 3710 020TC-67 827159 813-0 049-0 4240 673TG345 576106 5620 4733 2430 002HDL-121 659231 198-0 052-0 5260 600LDL-50 511184 363-0 029-0 2740 785TLR455 98032 8550 2221 7040 093
Note:Only the regression cofficients of FPG and TG were statistically significant(P<0.05),and the two indicators have predictive effect on HMGB1.
3 讨论
HMGB1是高迁移率族蛋白家族的重要一员,传统观点认为HMGB1是低分子量的非组蛋白染色体蛋白质,但近年研究发现,核内的HMGB1可由免疫细胞在应对感染、损伤或其他炎症刺激时主动或被动地释放至胞外,作为一种炎性细胞因子发挥重要作用[3]。HMGB1一旦被释放到细胞外,通过结合受体,诱导活化核因子(Nuclear factor,NF)-κB转位,致使炎性细胞因子分泌,从而引发炎症免疫反应[4]。TLRs作为HMGB1的受体是公认的促进炎症的先天免疫受体,尤其是TLR4,可以通过机体内毒素的激活,进而引起核因子的活化以及炎性细胞因子的释放[5,6]。
T2DM和OB是严重危害人类健康、影响生活质量的常见疾病,近年来的研究表明T2DM和OB不仅是代谢性疾病,而且是一种与炎症有关的疾病,促炎细胞因子的过度表达与T2DM和OB有着紧密的联系[7]。对T2DM和OB患者的研究表明:白细胞计数、C反应蛋白(C reactive protein,CRP)和炎性细胞因子的表达水平增加引起系统性炎症和脂质的积累,最终导致肥胖、胰岛素抵抗等代谢综合征疾病[8,9]。目前大多数学者认为T2DM和OB是一种慢性低度炎症性疾病,慢性低度炎症是T2DM和OB的中心环节。
本实验将HMGB1浓度在T2DM-OB组与NGT-OB组、T2DM-NOB组与NGT-NOB组分别进行比较,结果显示前者的HMGB1浓度均显著高于后者(P<0.001),这一实验结果表明糖代谢紊乱可以增加HMGB1的浓度。实验研究发现,肾小管上皮细胞在高血糖的刺激下释放HMGB1并结合、活化TLR4[10]。最近的动物实验研究表明,Ⅰ型糖尿病小鼠血清HMGB1浓度与对照组相比表达水平显著升高[11]。将TLR4表达水平在T2DM-OB组与NGT-OB组、T2DM-NOB组与NGT-NOB组分别进行比较,前者的表达水平均显著高于后者(P<0.001),进一步将HMGB1浓度与TLR4表达水平进行相关性分析发现二者呈明显的正相关(P<0.001),说明HMGB1及TLR4对T2DM具有明显的影响,在患T2DM后HMGB1及TLR4的表达水平会明显升高;相关性分析显示HMGB1浓度与FPG呈正相关(P<0.001),通过回归分析发现FPG对血浆HMGB1的表达水平有预测作用,说明HMGB1与机体是否糖耐量异常存在密切的关系。根据这次实验结果以及相关实验证据得出:HMGB1通过结合TLR4诱导胰岛细胞凋亡及胰岛素抵抗并进一步促进T2DM的发生与发展。
本实验我们将HMGB1浓度在T2DM-OB组与T2DM-NOB组、NGT-OB组与NGT-NOB组分别进行比较,结果显示前者浓度均大于后者(P<0.05),证明HMGB1浓度与肥胖症存在一定的关系。Guzman-Ruiz等[12]研究表明肥胖患者血浆HMGB1水平增加但脂肪组织中mRNA水平降低,据此他们得出一个结论:脂肪组织不是HMGB1诱导炎症的主要促进者。随后的实验研究显示皮下脂肪组织分泌HMGB1增加,但皮下脂肪组织HMGB1的分泌量与血浆含量没有相关性(r=0.10,P=0.58),HMGB1表达水平的这种差异被认为是炎症触发来源于脂肪组织的脂肪间质细胞,后者进一步分泌HMGB1,而成熟脂肪细胞对HMGB1的分泌没有促进作用[13,14]。本实验通过将TLR4表达水平在T2DM-OB组与T2DM-NOB组、NGT-OB组与NGT-NOB组分别进行比较发现,前者的表达水平均高于后者(P<0.05);HMGB1浓度与TLR4表达水平进行相关性分析发现二者呈正相关(P<0.001),说明HMGB1及TLR4对肥胖症有影响,在患OB后HMGB1及TLR4的表达水平明显升高,这一实验结果表明:HMGB1介导的脂肪组织炎症反应极有可能是通过TLR4途径发挥作用。有研究指出,HMGB1通过结合TLR4引起NF-κB核易位从而诱导促炎细胞因子和黏附分子的转录并最终导致炎症的发生[15]。本次实验相关性分析还发现HMGB1表达水平与TG、BMI呈正相关(P<0.001),进一步回归分析提示TG对HMGB1有一定的预测功能,这表明HMGB1表达水平受脂质代谢的影响。有实验研究表明在囊性纤维化糖尿病患者发病期间HMGB1表达水平的增加与糖尿病患者的BMI有关[16,17]。
综上所述,通过对T2DM和OB患者HMGB1及TLR4表达水平的检测发现:T2DM及OB患者体内HMGB1、TLR4的表达水平明显增高,HMGB1表达水平与糖脂代谢紊乱存在相关性,HMGB1与TLR4结合后通过相应的途径参与T2DM及OB的病理生理发展过程。