科罗索酸通过抑制Hippo-YAP信号转导通路促进非小细胞肺癌细胞的凋亡
2018-08-01杨生辉莫安薇
杨生辉 莫安薇 王 琳
(海南省人民医院肿瘤内科,海口 570000)
肺癌是世界上最常见的恶性肿瘤之一[1]。尽管目前治疗手段有所改善,但是由于肺癌发生发展的相关分子机制尚未被完全阐明,肺癌的死亡率仍然居高不下[2]。肺癌分为小细胞肺癌与非小细胞肺癌,非小细胞肺癌包括大细胞癌(15%~30%)、鳞癌(20%~25%)、腺癌(50%~60%),其5年生存率均低于5%[3]。肺癌治疗困难归因于缺乏有效的治疗药物。
中医药学历史悠久,源远流长,以辨证施治的整体理论应用于各种疾病的中医临床治疗中[4]。中医药在改善生活质量、减弱放化疗毒副反应、延长患者存活时间等方面都有着西医治疗无法比拟的优势[5,6]。在江浙一带,中草药猫人参是一种临床常用药,有祛风除湿、消肿散疖等多种功效,经常与其他中药配伍,治疗肿瘤及麻风病等各种疾病[7]。科罗索酸(Corosolic acid,CA)是应用多相色谱分离技术从猫人参中提取获得的化合物,分子式:C30H48O4,分子结构如图1[8]。近年研究表明,CA对血糖水平、肝癌细胞和白血病细胞都有一定程度的抑制作用[9-12]。然而CA是否对肺癌细胞有生长抑制作用尚未阐明。
Hippo信号转导通路在肿瘤的发生和发展过程中扮演着重要的角色[13]。Yes相关蛋白(Yes-associated protein,YAP)在细胞内调控下游基因的转录共激活过程,在肺癌患者的血清和组织中表达量都明显升高,促进肺癌细胞的增殖与转移[14,15]。临床研究表明某些临床常用药物(如维替泊芬)就是通过调控Hippo-YAP信号转导通路的活性来抑制肿瘤的发生、生长和转移[16]。本研究试图阐明科罗索酸对非小细胞肺癌是否具有抑制作用,并对CA是否通过Hippo-YAP信号转导通路作为靶点对肺癌细胞起抑制作用进行探讨,对于临床非小细胞肺癌的防治可提供新的治疗策略和依据。
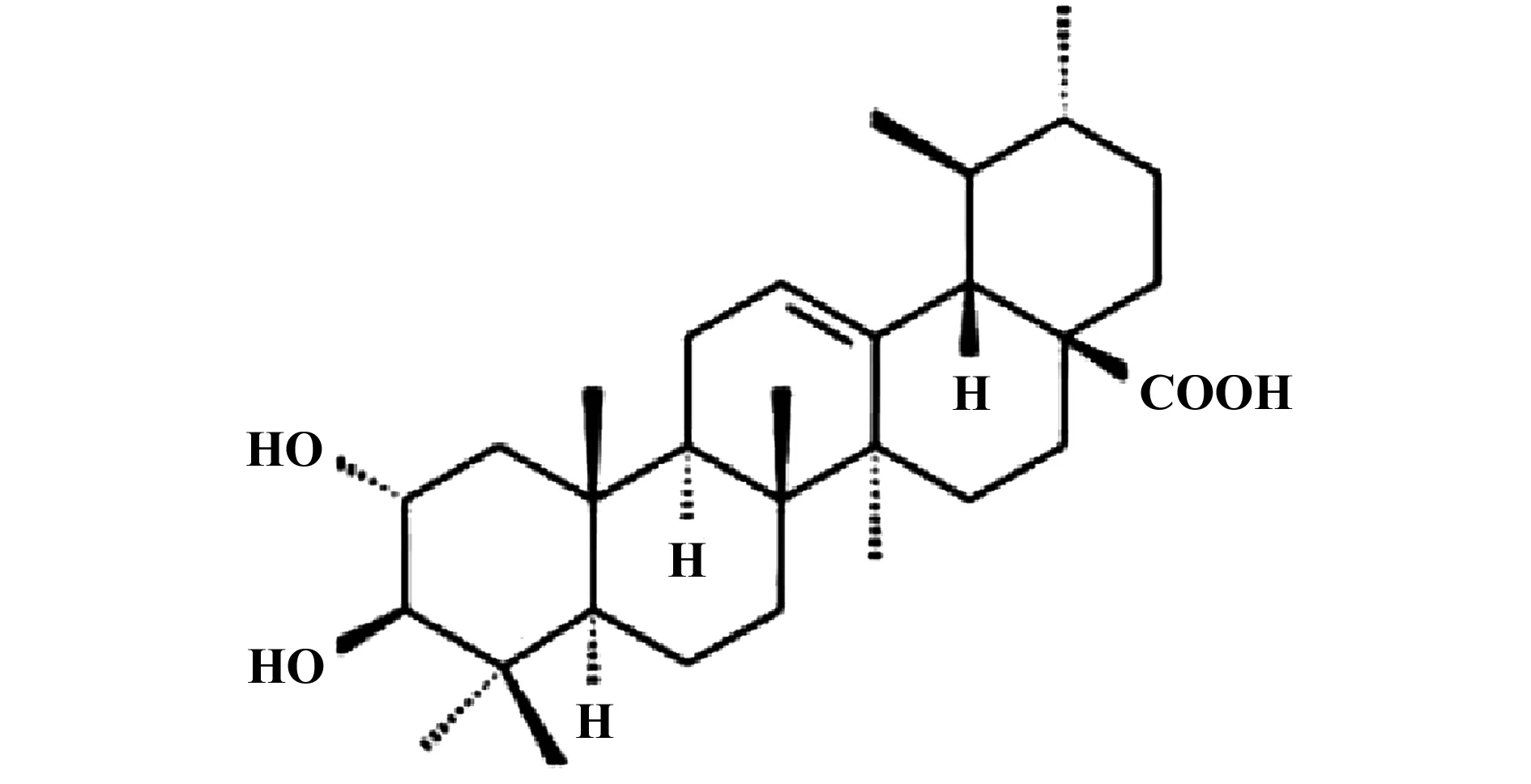
图1 科罗索酸的化学分子结构Fig.1 Corosolic acid molecular structure
1 材料与方法
1.1材料
1.1.1主要抗体 YAP(美国Abcam公司);GAPDH(美国Abcam公司)。
1.1.2主要试剂 胎牛血清FBS(美国Gibco公司);科罗索酸(美国Abcam公司);Western blot/IP裂解液(海门市碧云天生物技术研究所); Caspase-Glo 3/7 Kit(美国Promega公司);RT Reagent Kit(美国TaKaRa公司);蛋白合成抑制剂CHX(瑞士Roche公司);MTT Kit(美国Sigma公司)。
1.1.3主要仪器 CO2培养箱(日本三洋电气公司);双人超净工作台(苏州净化设备公司);倒置相差显微镜(德国Leica公司);电泳仪(上海天能科技有限公司);多功能酶标仪(德国 Biometra 公司);实时荧光定量PCR仪(瑞士Roche公司);高速离心机(美国Thermo公司)。
1.2方法
1.2.1细胞培养 将A549细胞株在完全培养基(100 mg/L链霉素、100 U/ml青霉素10%胎牛血清),5%CO2,37℃饱和湿度的恒温培养箱中培养。在细胞铺满瓶底时,用含EDTA的胰酶消化后,进行细胞传代。
1.2.2MTT法检测CA对肺癌A549细胞增殖的影响 将A549细胞以每孔10 000个接种于48孔板中,加入不同CA浓度(0、20、40、60、80、160 μmol/L)的培养基200 μl。24 h后每孔加入5 mg/ml,200 μl MTT溶液,当出现肉眼可见的深色沉淀时即终止反应;每孔加入150 μl DMSO溶液,在避光摇床上震荡使深色结晶充分溶解;随后用酶标仪在595 nm波长处检测各孔吸光值(OD),并计算6个复孔的平均值。细胞存活率(%)=实验组OD均值/空白对照组OD均值×100%。
1.2.3Caspase 3/7活性检测CA对A549细胞凋亡的影响 将A549细胞以10 000个/孔接种于96孔板中,加入不同CA浓度(0、20、40、60、80、160 μmol/L)的培养基200 μl。24 h后加入100 μl Caspase-Glo 3/7试剂混合液。然后用移液枪吹打细胞至脱离板壁,在37℃培养箱中孵育30 min。用酶标仪测定每孔的OD值,实际测得的Caspase3/7活性数值即为每孔的OD值减去空白对照的OD值。细胞凋亡率(%)=实验组OD值/空白对照组OD值×100%。
1.2.4Western blot(WB)检测CA对肺癌细胞蛋白表达的影响 将收集到的细胞进行裂解后,应用BCA法测定蛋白浓度,并计算上样量。按照 25 g/泳道加入对应样本的蛋白和5×蛋白Loading Buffer,电泳后使用NC膜进行蛋白转移。随后将NC膜依次放于一抗和二抗稀释液中,分别37℃孵育1 h,使用ECL发光试剂盒在暗室内进行显影、定影等过程。最后用扫描仪将条带扫描,应用Image J软件分析并统计各条带的灰度值。
1.2.5免疫荧光实验对YAP的细胞定位进行检测 将待测细胞以1×104个/孔放入,细胞爬片过夜。4%多聚甲醛将细胞固定后,封闭(1.5 ml FBS,50 μl Triton X-100和5%山羊血清,用PBS配至50 ml)1 h。封闭液稀释一抗和二抗,分别37℃孵育1 h。DAPI封片后在共聚焦或荧光显微镜下观察细胞形态。
1.2.6RT-PCR检测YAP的mRNA表达 用Trizol抽提液抽提细胞总RNA,YAP上游引物5′GCTTGTTCCCATCCATCAGGAAG3′,下游引物5′GCAGGTTGGGAGATGGCAAAGAC3′;内参GAPDH基因上游基因5′-GAAGGTGATAGTCGGAGTCA-3′,下游基因5′-GAAGATGGTGCTGGGATTTC-3′。使用反转录试剂盒合成cDNA,再进行PCR扩增实验。PCR反应条件为:预变性95℃ 30 s,95℃ 30 s进行40个循环。PCR扩增结束后,记录Ct,用2-ΔΔCt法计算mRNA的相对表达水平,实验重复6次,取均值。
1.2.7CHX实验检测YAP蛋白的降解速率及半衰期 将CHX(50 μg/ml)加入A549细胞株抑制细胞内蛋白的产生,间隔0、1、2、4、8、24 h后分别收集细胞,直至将所有细胞收集完毕。进行Western blot检测YAP的表达量,最后根据不同时间的蛋白含量绘制蛋白降解曲线。
1.3统计学方法 实验数据都采用统计软件SPSS17.0进行统计分析,实验均进行至少3次以上。各组间如果方差不齐则采用非参数法比较。两组间比较采用t检验,两样本率的比较采用χ2检验。并设定P<0.05表示差异有统计学意义,P<0.01有显著统计学意义。
2 结果
2.1CA抑制肺癌细胞A549的增殖 为了探究CA对A549细胞增殖的影响,我们将CA溶解于甲醇中配置成不同浓度的药物培养基,采用不同浓度的CA(0、20、40、60、80、160 μmol/L)作用于A549细胞24 h后,用MTT实验检测CA对A549细胞增殖方面的影响。结果如图2所示,在不同浓度的CA作用下细胞的存活率与CA的浓度呈负相关性,20、40、60、80、160 μmol/L的CA药物培养液中存活的活细胞分别为对照组(只加甲醇处理)的85.6%、51.1%、22.4%、11.7%、6.8%,由此可见CA能抑制肺癌细胞增殖,并呈浓度依赖性。以无CA培养基中生长的肺癌细胞作为对照组,CA浓度为40 μmol/L,24 h后肺癌细胞存活率约为正常细胞的一半,因此MTT实验结果显示,CA对A549细胞的24 h 半抑制浓度约为40 μmol/L。
2.2CA促进A549肺癌细胞的凋亡 为了进一步确认CA对肺癌细胞的抑制作用,我们采用不同浓度的CA(0、20、40、60、80、160 μmol/L)分别处理A549肺癌细胞24 h后,用Western blot实验在蛋白水平上对凋亡蛋白酶作用底物进行了检测,并且检测Caspase3/7的酶活性。
如图3所示,我们首先通过Western blot技术检测了Caspase底物水平,不同浓度的CA作用于A549肺癌细胞后,在一定浓度范围内,随着CA浓度增加,Caspase底物的表达水平逐步增加,在CA浓度为80 μmol/L时,Caspase底物浓度达到最大值,在浓度约为40 μmol/L时,凋亡底物浓度达到最大值的一半。
随后,我们用Caspase-3/7试剂盒对Caspase-3/7酶活性进行检测。结果如图4所示,随着CA浓度的增大,Caspase-3/7的酶活性逐渐增加,在CA浓度约为80 μmol/L时酶活性达到最大值,在CA浓度约为40 μmol/L,酶活性达到最大浓度的一半。值得注意的是Caspase-3/7活性分析以及Western blot实验结果都显示:在CA浓度为160 μmol/L时,Caspase-3/7的酶活性以及凋亡蛋白酶底物浓度都显著降低,我们猜测这是由于CA浓度过高,药物培养基过度毒性导致肺癌细胞大量死亡,由于肺癌细胞数量的急剧降低,导致Caspase底物的表达水平以及Caspase-3/7的酶活性均出现显著降低的现象。
2.3CA抑制A549肺癌细胞的Hippo信号通路 接下来我们为了明确CA是否以Hippo信号通路为靶点调控肺癌细胞的增殖与凋亡,我们首先用40 μmol/L的CA处理A549肺癌细胞(对照组用等量的甲醇处理)24 h后,Western blot实验检测两组细胞YAP表达水平。结果如图5所示,发现CA处理过后的肺癌细胞中的YAP表达水平显著降低,明显低于对照组。
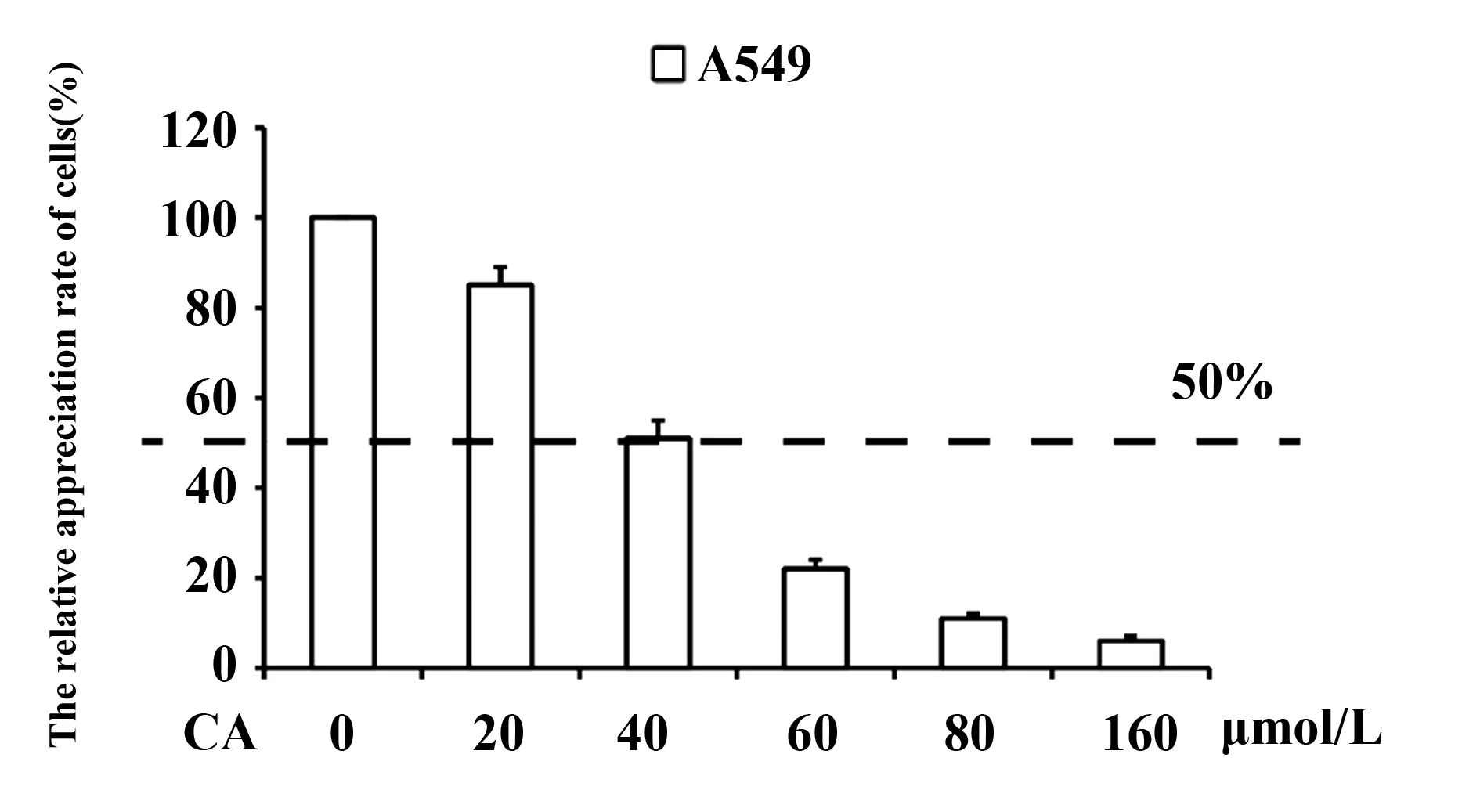
图2 MTT法检测细胞存活率Fig.2 MTT assay was used to detect cell viability
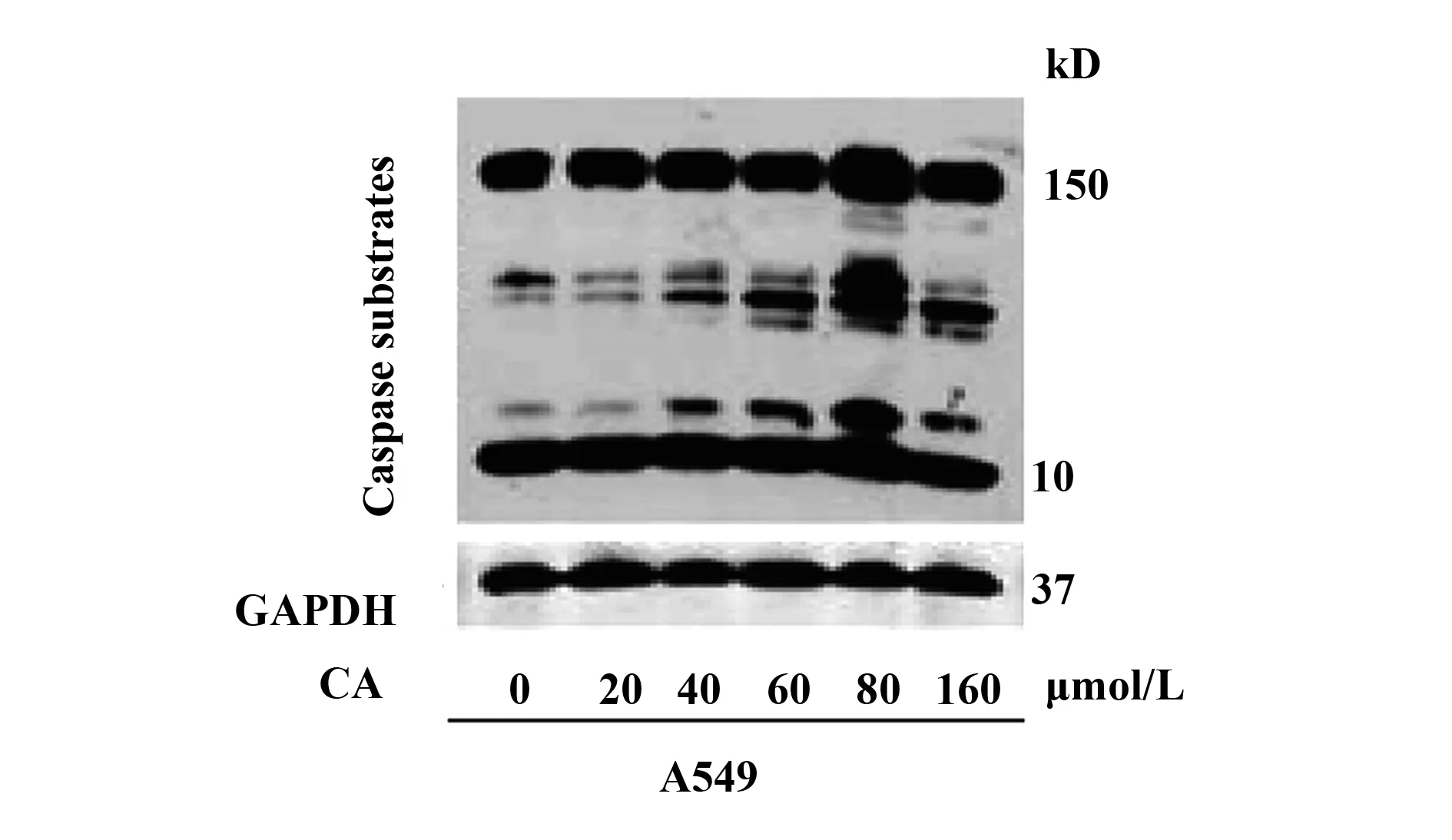
图3 Western blot实验检测Caspase底物表达水平Fig.3 Expression level of Caspase substrate was detected by Western blot
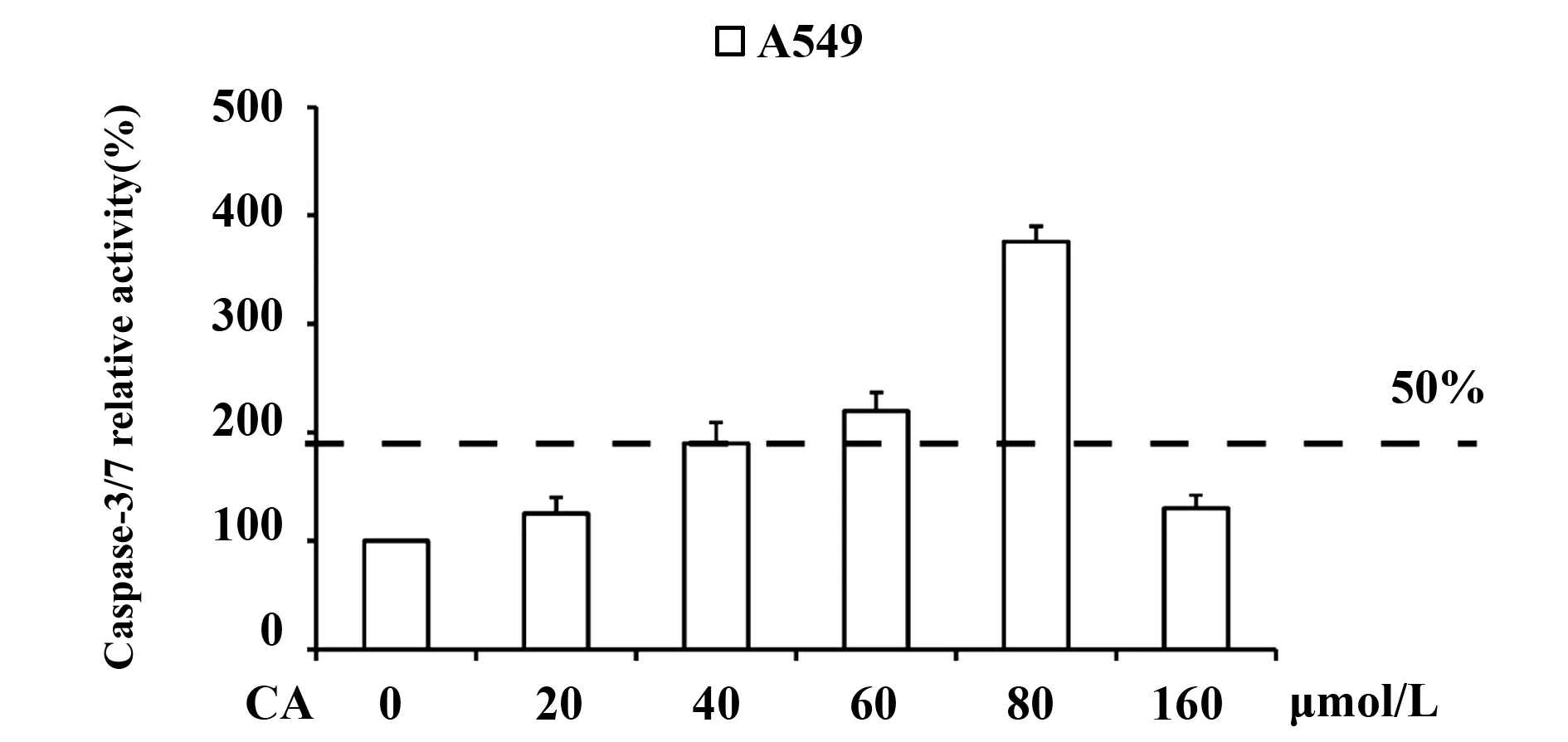
图4 Caspase-3/7活性分析实验检测Caspase-3/7酶活性Fig.4 Caspase-3/7 activity analysis of Caspase-3/7 enzyme activity
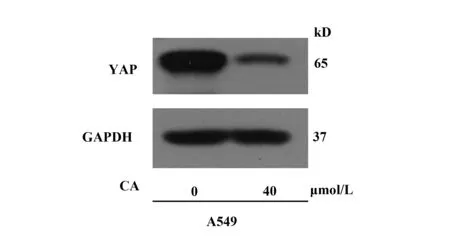
图5 Western blot实验检测YAP蛋白表达水平Fig.5 Expression level of YAP protein was detected by Western blot
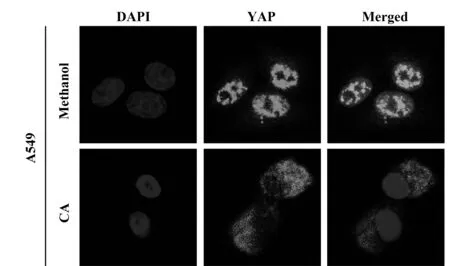
图6 免疫荧光实验对YAP在肺癌细胞内的定位Fig.6 Localization of YAP in lung cancer cells by immunofluorescence assay
随后,我们应用免疫荧光试验对A549肺癌细胞的YAP进行定位检测,结果如图6所示,对照组YAP定位于细胞核中,但在CA(40 μmol/L)处理24 h后,YAP出现从细胞核转移到细胞浆中的现象。不仅如此,实验结果还明显显示出,CA处理肺癌细胞后,YAP的荧光强度与对照组相比明显减弱。由以上结果我们推断CA对肺癌细胞的抑制作用可能是通过Hippo信号通路调控的。
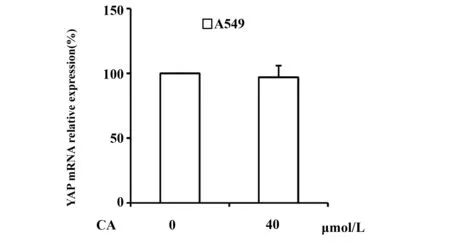
图7 PCR检测CA对YAP mRNA水平的影响Fig.7 Effect of CA on YAP mRNA level was detected by PCR
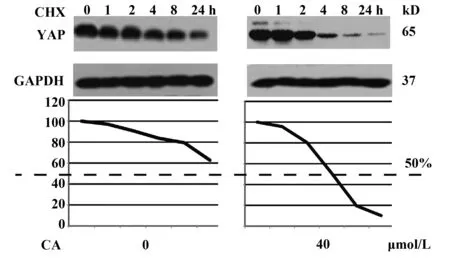
图8 YAP蛋白半衰期变化Fig.8 Half-life of YAP protein
2.4CA通过促进YAP的蛋白降解下调其表达 为了明确CA下调YAP表达的机制,随后我们检测了CA作用于肺癌细胞后YAP的mRNA 表达情况,结果如图7所示,40 μmol/L的CA对肺癌细胞中YAP的mRNA表达并没有明显的影响,因此我们排除了CA通过抑制YAP基因转录下调YAP蛋白表达量的可能性。
接下来,我们采用CHX实验确定CA对于YAP蛋白降解半衰期的影响。我们对A549细胞株进行CA(40 μmol/L)处理后,再加入终浓度为50 μg/ml的CHX,并分别在加药后0、1、4、8、24 h收集细胞,进行Western blot检测YAP表达水平,并根据结果计算灰度值,绘制YAP降解曲线,如图8所示,CA能够明显缩短YAP的半衰期,即CA在蛋白水平上促进了YAP的降解,进而导致YAP表达量下调。
3 讨论
全球癌症统计数据显示,肺癌是男性癌症死亡的主要原因,也是女性癌症死亡的第二大原因,每年约有180万的新发病例和160万的死亡案例[17,18]。肺癌的发病原因可能与吸烟、大气污染、老龄化、遗传等多种因素密切相关[19]。由于在肺癌发病的早期阶段缺乏特异性临床症状,大约40%的肺癌患者在确诊时即已发生远处器官转移,导致许多患者丧失手术切除机会,因此目前化疗是治疗肺癌的主要手段[20]。寻找特异性强、敏感性高、毒性小、抗肿瘤作用强的新型化学药物是肺癌临床治疗的下一步研究方向。
CA是中草药猫人参中提取的主要药效成分。近年来,CA在降血糖、消炎、抗氧化应激及抗肿瘤等方面都有诸多研究。Li等[21]认为,CA通过促进浆膜上的葡萄糖转运蛋白4(GLUT4)转移至细胞外膜上,使细胞对葡萄糖的摄取利用率增加,从而降低血糖水平;Xu等[22]发现CA通过上调Bax的表达,增加Bax/Bcl-2的比率,从而诱导肿瘤细胞周期阻滞。然而关于CA对肺癌细胞的影响还尚未有报道。本实验探究了CA 对肺癌细胞株A549增殖和凋亡的影响,首先我们发现CA抑制A549的增殖,促进其凋亡,并且均呈剂量依赖性。此外我们还确认了CA作用于A549细胞时的半抑制浓度,该浓度的确认能够指导后续实验的用药浓度。
Hippo-YAP信号转导通路在果蝇体内最先发现,在细胞中调节各类转录因子,调控细胞的增殖和凋亡。该通路一旦发生调控异常,就会诱导YAP介导的多种下游靶基因激活并调节肿瘤细胞的增殖和迁移,从而对患者的治疗和预后产生影响[23]。Wang等[24]发现在肺癌细胞中过表达YAP蛋白可显著促进细胞的增殖能力。Zhang等[25]认为Hippo信号转导通路新发现的成员VGLL4能与YAP竞争性结合下游转录因子TEADs,进而抑制YAP的生物学作用,抑制了肺癌细胞的增殖和肿瘤的生长;Yuan等[26]研究发现Hippo信号转导通路中YAP的异常激活可促进YAP下游基因Survivin、CTGF等生长基因的表达,促进肺癌细胞的增殖和肿瘤的生长。根据以上研究结果,我们有理由认为Hippo-YAP信号转导通路可能成为肺癌治疗的新型潜在靶点。接下来我们试图探究CA对肺癌细胞A549的抑制是否通过Hippo-YAP信号转导通路介导的。实验结果显示CA能明显下调YAP在肺癌细胞中的表达并促进YAP由胞核转移到胞浆。Kim等[27]研究报道,在肺癌细胞中,YAP主要定位在细胞核中,通过调控多种转录因子发挥其促癌作用。实验结果显示在CA作用后,YAP主要在细胞浆中表达。由此我们猜测CA通过促进YAP出核,切断了其在细胞核中的作用途径,无法实现其对肺癌细胞增殖和转移的调控,从而促进了细胞凋亡。
为了进一步确认肺癌细胞A549中YAP下调的机制,我们进行了YAP的蛋白质层面和mRNA层面的分析。我们发现CA对肺癌细胞YAP的mRNA表达并没有明显的影响。但是通过对YAP蛋白半衰期的检测,我们发现CA处理肺癌细胞后,YAP蛋白的半衰期明显缩短。因此,我们证实CA并非通过抑制YAP基因的转录来下调YAP的表达量,而是通过促进YAP蛋白降解来抑制YAP蛋白的表达。
上述实验结果表明,CA是一个潜在的抗肺癌药物,可能通过Hippo-YAP信号转导通路起抑制作用,为以后CA用于肺癌的治疗提供了理论依据,为肺癌的预防和分子治疗方面提供了新的思路和方向。但是关于本实验中YAP蛋白降解的精确分子机制仍有待进一步探究。总的来说,本实验揭示科罗索酸对肺癌细胞的抑制作用及其机制,对筛选新的抗肺癌免疫新型药物等方面具有十分重要的意义。