高压静电场激励裙带菜配子体的生物效应研究
2018-07-31李晓丽芦莹胡玉才孙丕海邢冬飞
李晓丽,芦莹,胡玉才,孙丕海,邢冬飞
(1.大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023;2.大连海洋大学 理学院,辽宁 大连 116023;3.大连海洋大学 科技园有限公司,辽宁 大连 116023)
裙带菜Undariapinnatifida是中国北方沿海大规模栽培的经济褐藻,2017年栽培面积为7200余hm2,年产鲜品裙带菜20余万t,其中辽宁省大连市是中国裙带菜栽培生产的主要基地,生产量占全国总产量的80%以上,裙带菜栽培业已经成为大连沿海渔业的重要支柱产业,也是出口创汇最重要的水产品之一[1]。目前,裙带菜产业中的苗种生产主要采用全人工育苗和半人工育苗两种方式,但全人工育苗使用的种菜逐年反复利用会导致近交衰退,半人工育苗方式会导致海上栽培品种和野生群体的混杂,栽培品种在使用数年之后,产量、质量、抗病能力均大幅度下降[2],因此,亟须开展裙带菜优良品种的选育工作,培育出适合大连当地海域条件的养殖品种。
当前裙带菜品种选育主要依靠选择育种和杂交育种两种方式,已有“海宝1号”和“海宝2号”两个新品种,但是同样存在着选育周期长、工作量大的问题[2],而诱变育种能快速地筛选经济性状优良的品种,在辐射诱变中一般是以60Co-γ射线为辐射源对植物进行诱变,但因其设备价格昂贵、辐射伤害人体,生产中应用有限。研究表明,使用构造简单、操作方便、安全系数大的高压静电场处理可以获得同样的诱变效果[3],如在黑曲霉[4]、大肠杆菌K12[5]的诱变中作用效果显著,此外,高压静电场处理还具有提高种子活力、促进种子发育生长、提高种子品质等作用[6-10]。因此,笔者所在的科研团队于2014—2016年,对优选的DL18品系裙带菜配子体进行高压静电场处理,再将处理后的配子体进行采苗及育苗,观察配子体的生长、成熟和孢子体的生长发育情况,比较F1代孢子体的经济性状,并对F1代配子体进行rbcL-sp-S基因序列分析。本试验中,激励裙带菜配子体,根据试验结果,掌握了适宜的处理强度和处理时间,可为高压静电场在裙带菜的育种和品质改良中的应用提供基础数据。
1 材料与方法
1.1 材料
1.1.1 藻种及保存条件 在大连地区养殖成熟的日本北方型种源裙带菜中,挑选具有优良性状的种菜,采集游孢子,获得不同品系的裙带菜配子体,其中以DL18品系裙带菜藻体最大(图1),因此,本研究中以DL18品系的雌、雄配子体为试验材料,保存培养温度为18~20 ℃,光照强度为20 μmol/(m2·s),光源为LED灯,光照时间为12 h/d。

图1 DL18品系裙带菜孢子体Fig.1 A sporophyte of DL18 strain of sea mustard Undaria pinnatifida
1.1.2 高压静电处理装置 依据白亚乡等[10]的方法,高压静电处理装置为ZGF-60 kV型直流高压发生器(大连电源技术有限公司),把220 V交流电压整流到0~60 kV,输出电流在0.05~2.00 mA,自行设计两平行铝板(圆形,Ф=20 cm),板间距可调节,下极板接地,上极板加负电场强度。处理时,将盛有配子体的培养皿(Ф=12 cm,下同)置于两极板正中央,由于培养皿面积小于两极板,故可视培养皿内为匀强电场,无边缘效应(图2)。
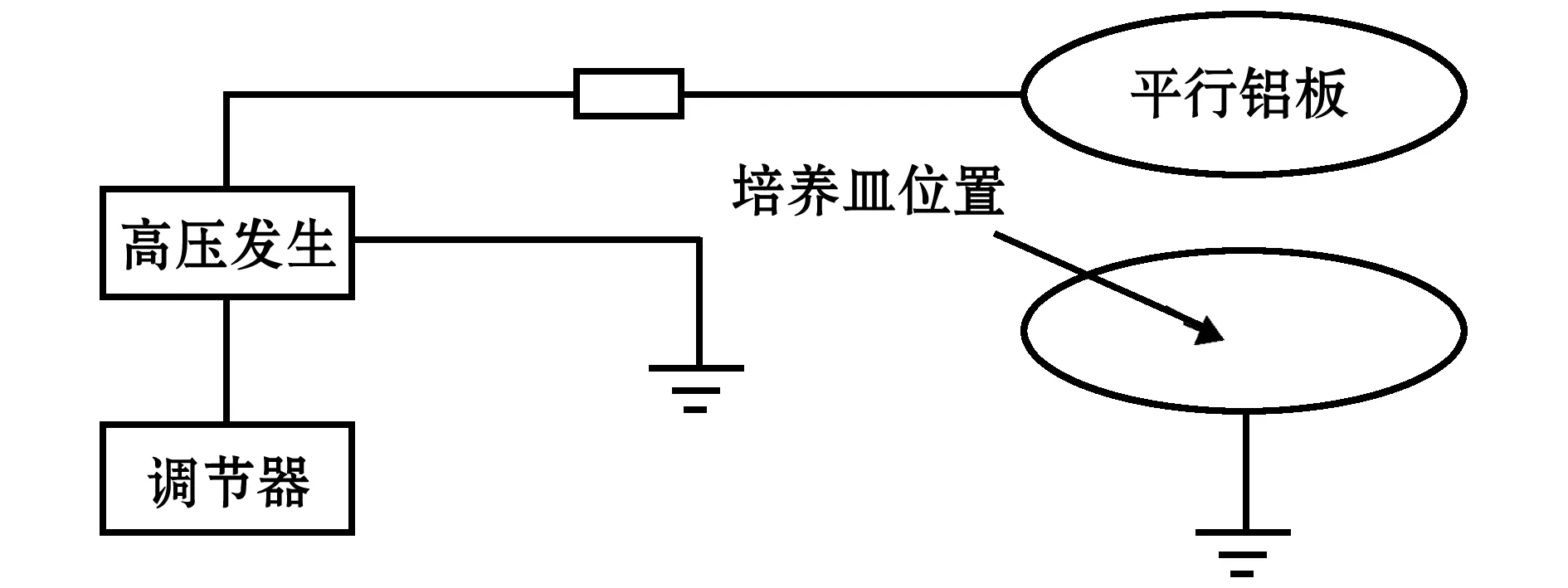
图2 高压静电处理装置Fig.2 Schematic diagram of an electrostatic field device
1.2 方法
1.2.1 不同电场强度和处理时间对裙带菜配子体存活率的影响试验 各称取0.1 g(湿质量,下同)DL18品系配子体(雌、雄各半,下同),放入培养皿中,在培养液深度为0.6 cm条件下,分别在3.3、4.0、4.7、5.3、6.0 kV/cm电场强度下,各处理2、5、10 min,对照组为未处理的DL18品系配子体,各试验组均设3个平行(下同)。
1.2.2 高压静电场处理对配子体特定生长率及成熟率、受精率的影响试验 各称取0.1 g DL18品系配子体,分别在不同电场强度下处理10 min后,将配子体经组织捣碎机[11]切碎成400~500 μm 的藻段,移入培养皿(Ф=15 cm)中,置于22 ℃、光照强度60 μmol/(m2·s)、光照时间24 h/d条件下培养,每5 d全量更换1次培养液,称重配子体质量,计算配子体的特定生长率(SGR,%/d):
SGR=(lnW2- lnW1)/(t2-t1)×100%。
其中:t2、t1分别为相邻两次测定时间(d);W2、W1分别为t2和t1时的藻体质量(g)。
各称取0.1 g DL18品系配子体,分别在不同电场强度下处理10 min后,经组织捣碎机切碎成100~200 μm的藻段,移入培养皿中,置于20 ℃、50 μmol/(m2·s)、14 h/d条件下培养,每2 d全量换水1次,并观测配子体生长发育状态,计算成熟率、受精率和受精卵的萌发率。
1.2.3 配子体的采苗及育苗 每次取5 g DL18品系配子体,在不同电场强度下处理10 min后,加入灭菌海水定容至1500 mL,经组织捣碎机切碎成100~200 μm的藻段,然后将其均匀地撒到盛有5 L培养液、铺有采苗帘的塑料箱中培养。塑料箱(规格为40 cm×30 cm×14 cm)为白色食品级,加盖自制透明的塑料盖,苗帘(苗帘规格为38 cm×28 cm)为自制框架上缠绕直径3 mm的维尼纶绳制成,苗绳间隔为2 mm。采苗前将塑料箱、塑料盖和苗绳均进行消毒处理,采苗后黑暗过夜,从第2天开始在18~20 ℃、50~60 μmol/(m2·s)、14 h/d条件下进行培养,培养液每3 d全量更换1次,每5 d剪取苗绳镜检,观察配子体的成熟、受精情况,幼孢子体出现后开始测量幼孢子体的长度,每次测量100个个体并取其平均值。
以上室内培养的培养液均为大连市黑石礁海域自然海水经沉淀过滤后,每5 L海水中添加500 mg NaNO3、100 mg KH2PO4和5 mL PI[12]溶液,加热90 ℃以上冷却后供试验使用。
1.2.4 海区暂养及栽培 配子体采苗后经30 d的室内培养,F1代幼苗长度达到400 μm以上时,将苗绳移至旅顺柏岚子养殖场进行海区暂养,待幼苗长至1 cm以上时进行分苗栽培,每个处理组各夹4根苗绳,置于同一区域的浮筏上养殖,每月测定一次孢子体的长度和质量,每次测量50株藻体并取其平均值。
1.2.5 F1代和F2代配子体的获得 取各试验组的成熟F1代孢子体,进行游孢子采集,获得F1代配子体,进行雌、雄分离后,获得F1代雌、雄配子体。将获得的DL18品系 F1代配子体进行配子体采苗、育苗和海区栽培后,在试验的第3年获得DL18 品系F2代配子体。
1.2.6rbcL-sp-S基因序列分析
(1)组别及编号。将处理组获得的F1代配子体及对照组F1、F2代配子体和部分组的雌、雄配子体,进行rbcL、rbcL-rbcS间隔区和部分rbcS基因序列分析 (rbcL-sp-S),各组及其编号见表1。
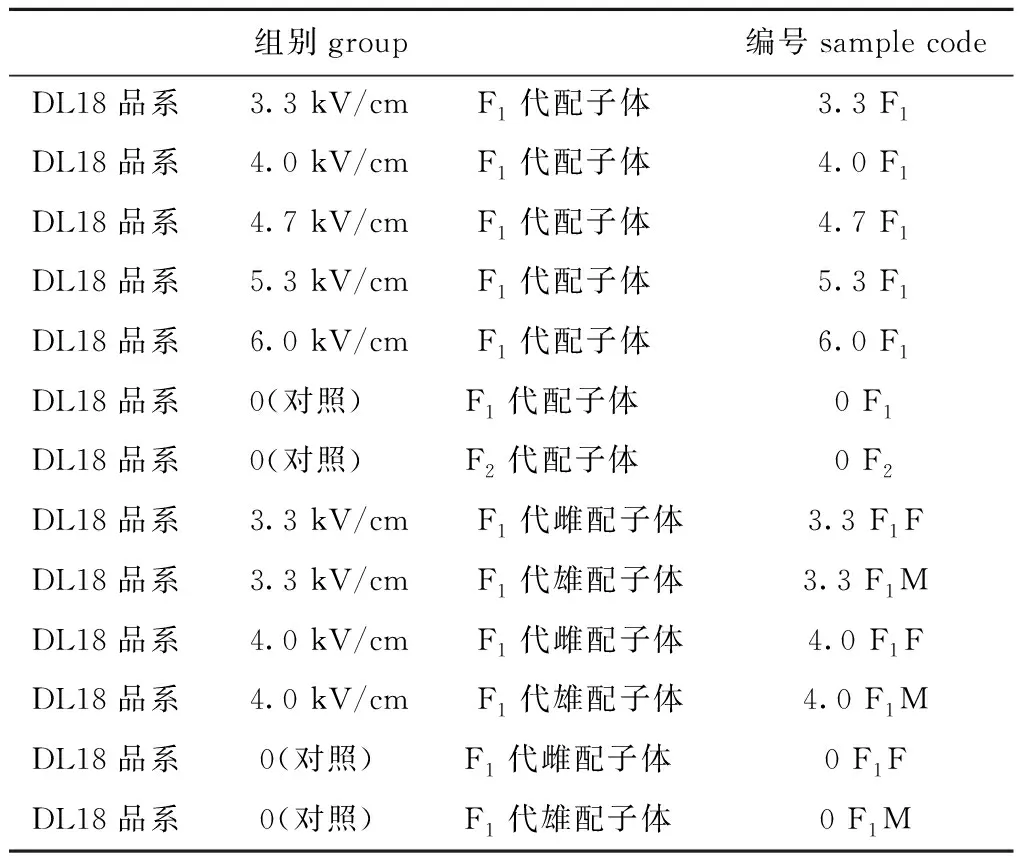
表1 rbcL-sp-S基因序列分析的组别及其编号
(2) 基因组DNA的提取及检测。使用新鲜的配子体,按照Plant Genomic DNA kit植物基因组DNA提取试剂盒(离心柱型)(北京天根生化科技有限公司)的操作步骤,提取基因组DNA。DNA纯度和浓度的检测使用NV3000超微量核酸蛋白测定仪(VASTECH美国威斯特),当提取DNA的OD260 nm/ OD280 nm值为(1.7~1.9)、浓度为(14.9~99.6)ng/μL时,直接用于PCR扩增。
(3) 引物的合成。本试验中设计的引物(表2),由上海生工生物工程股份有限公司代为合成,新合成时为干粉状,常温运输即可。

表2 引物代号及基因序列Tab.2 Primer codes and gene sequences
(4) PCR反应体系及程序。PCR反应体系(共25 μL):模板为1 μL, 上、下游引物各2.5 μL,Premix TaqTM12.5 μL,用ddH2O补足至25 μL。PCR扩增程序为:95 ℃下预变性5 min;94 ℃下变性45 s,复性温度退火45 s,72 ℃下延伸60 s,共进行40个循环;最后在72 ℃下再延伸10 min。PCR扩增在PCR仪(Eppendorf AG 22331 Hamburg PCR扩增仪)上完成。
(5) PCR产物回收及序列测定与分析。PCR扩增后对其反应产物进行纯化,使用胶回收试剂盒(上海生工)进行PCR纯化反应,然后将PCR纯化产物送到上海生工生物工程股份有限公司进行测序。测序所得序列用MAGE 7.0软件进行碱基差异度分析和系统进化树构建。
1.3 数据处理
利用Excel 2007软件对数据进行整理,采用SPSS Statistics 22.0软件进行独立样本t检验及单因素方差分析,统计值用平均值±标准差(mean±S.D.)表示。
2 结果与分析
2.1 电场强度和处理时间对DL18品系配子体存活率的影响
培养3 d后,不同电场强度和处理时间下配子体的存活率如表3所示。从表3可见:随着电场强度及处理时间的增加,配子体的存活率逐渐降低,处理组与对照组间有显著性差异(P<0.05);在3.3 kV/cm、2 min条件下,配子存活率最高,达到99.4%±0.6%,在6.0 kV/cm、10 min条件下,存活率最低,为95.0%±1.0%;但在3.3~6.0 kV/cm、2~10 min处理范围内,配子体的存活率均在95%以上,说明在高压静电场处理下,裙带菜配子体存活能力较强。

表3 不同电场强度和时间处理下配子体的存活率
注:*表示与对照组有显著性差异(P<0.05),下同
Notes: * means significant difference compared with the control(P<0.05), et sequentia
2.2 高压静电场对DL18品系配子体的特定生长率、成熟率、受精率和萌发率的影响
在处理时间为10 min时,不同电场强度下DL18品系配子体的特定生长率如表4所示,培养10 d后,雌、雄配子体的成熟率,以及成熟卵的受精率和受精卵的萌发率如表5所示。
从表4可见:处理组配子体的特定生长率与对照组相比有显著性差异(P<0.05),处理组配子体的生长均快于对照组,在电场强度为5.3 kV/cm时,配子体生长最快,培养30 d后,配子体特定生长率可达到9.1%±0.1%。

表4 不同电场强度处理下配子体的特定生长率
从表5可见:处理组雌、雄配子体的成熟率,以及成熟卵的受精率和受精卵的萌发率,均与对照组相比均无显著性差异(P>0.05);各组雌、雄配子体的成熟率分别达到96%、92%以上,成熟卵的受精率均达到97%以上,受精卵的萌发率均达到98%以上。
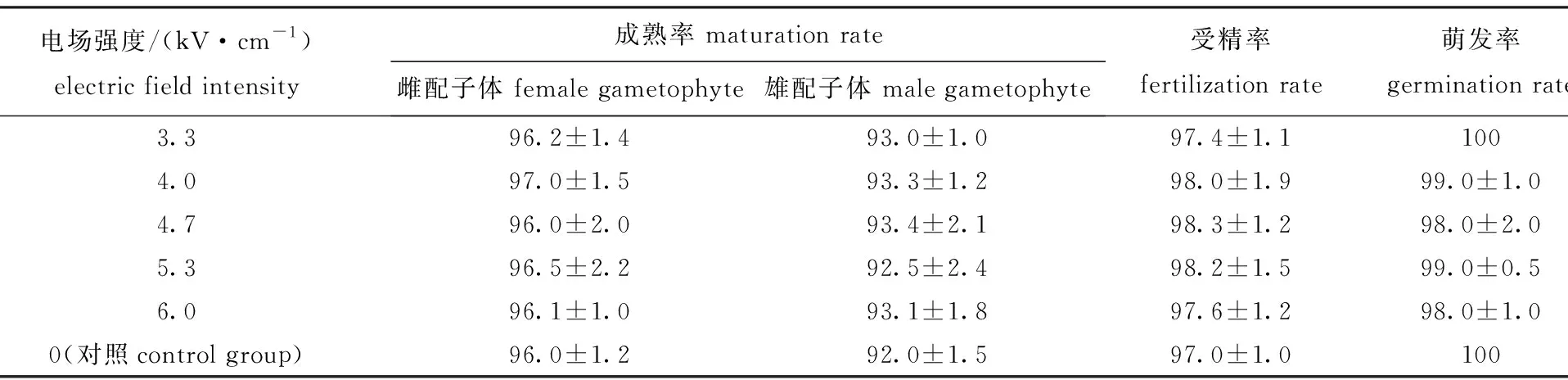
表5 不同电场强度处理下配子体的成熟率、受精率、萌发率
2.3 高压静电场处理后DL18品系F1代幼孢子体的生长情况
配子体采苗后7 d,雌、雄配子体逐渐发育成熟,卵受精后发育为幼孢子体,不同电场强度处理对幼孢子体生长的影响如表6所示。从表6可见:处理组幼孢子体的长度与对照组有显著性差异(P<0.05),处理组幼孢子体的长度均大于对照组;随着电场强度的增加,幼孢子体长度呈先升高后下降趋势,在5.3 kV/cm电场强度下,藻体生长最快,培养30 d后,幼孢子体长度为(446.8±4.4)μm,而对照组幼孢子体长度为(380.6±5.0)μm。
2.4 海区栽培结果
幼孢子体出海暂养20 d后,各组的藻体长度均达到1 cm以上,达到分苗标准。分苗后浮筏栽培期孢子体的长度和质量生长情况如表7所示。从表7可见:处理组藻体在长度和质量生长方面与对照组有显著性差异(P<0.05),随着藻体的增大其生长优势更加明显;2016年4月份,各组藻体长度和质量达到最大值,处理组藻体的平均长度和质量分别为(2.4~2.8)m、(1.6~2.0)kg,其中,在5.3 kV/cm电场强度处理下的藻体平均长度和质量最大,分别为(2.8±0.5)m、(2.0±0.3)kg,对照组则分别为(2.2±0.3)m、(1.2±0.2)kg;5月份后,孢子体逐渐进入繁殖期,叶片梢部开始溃烂,藻体的长度和质量逐渐降低,在5月15日测定时,处理组藻体的平均长度和质量分别为(2.3~2.6)m、(1.5~1.8)kg,对照组则分别降低至(2.1±0.2)m、(1.1±0.3)kg。以上结果表明,高压静电场激励裙带菜DL18品系配子体后能明显提高其F1代孢子体的产量。
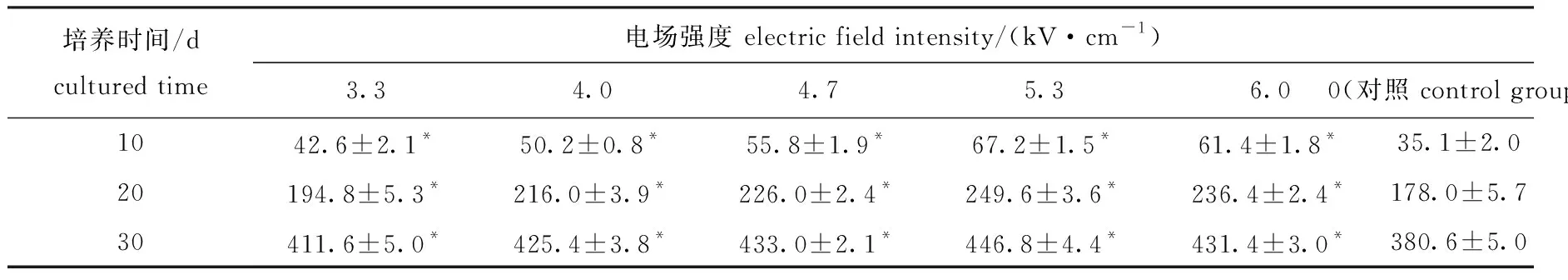
表6 不同电场强度处理下F1代幼孢子体的长度Tab.6 Length of F1 generation juvenile sporophytes in different electric field intensities of HVEF μm
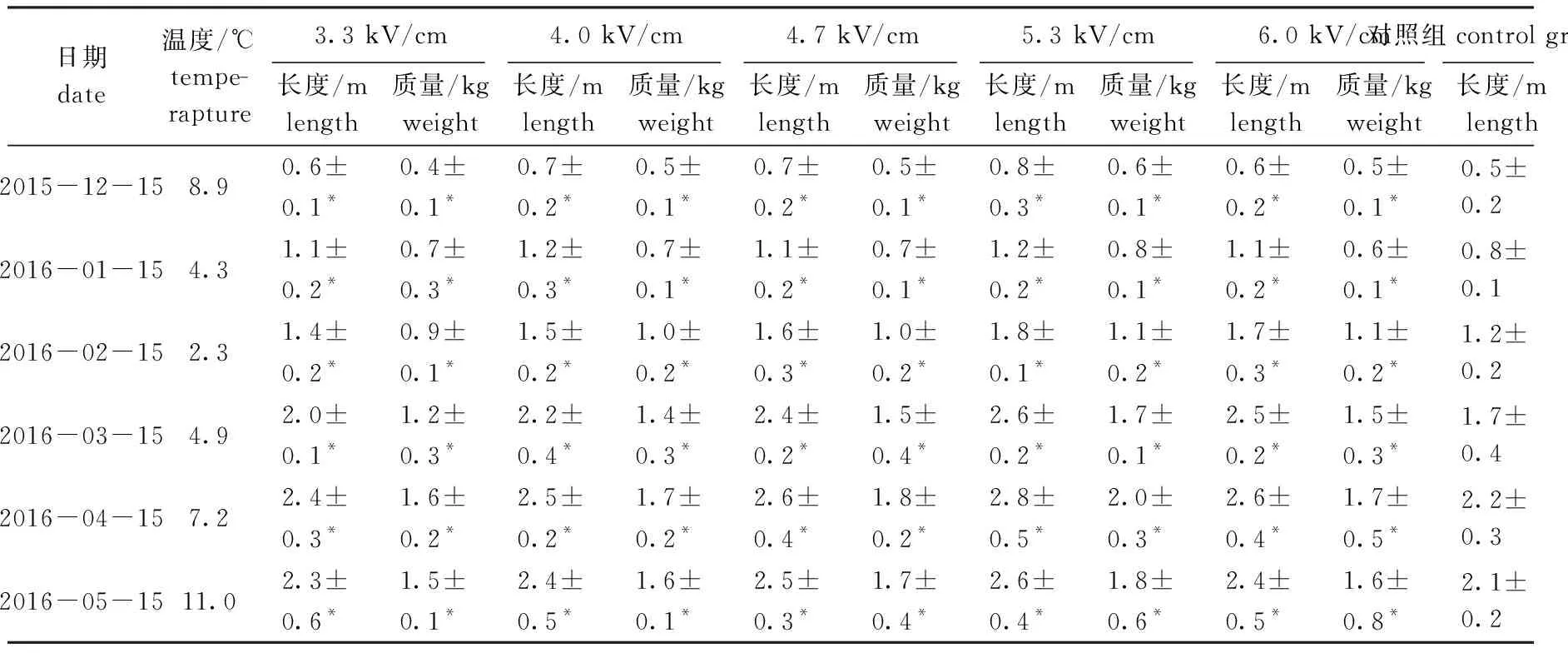
表7 栽培期间各电场强度组裙带菜长度和质量生长情况Fig.7 Length and weight growth of sea mustard Undaria pinnatifida in each group during the period of sea cultivation
2.5 rbcL-sp-S序列分析
由13个样品提取的总DNA见图3-A,rbcL基因的PCR扩增产物见图3-B~D,部分rbcS基因的PCR扩增产物见图3-E。每个样品均获得了超过2100 bp的目的产物,包括rbcL全序列、rbcL-rbcS 中间序列(spacer)和部分rbcS序列。
13个样品中碱基含量见表8,其中,T、C、A、G、A+T平均含量分别为31.34%、20.28%、32.88%、15.49%、64.22%,A+T的含量均高于G+C的含量。通过核苷酸序列的对位分析(图4),共有约130个位点的碱基发生了缺失、置换或插入。对照组F1与F2代配子体仅发生1处碱基置换,说明自发突变较小,而处理组碱基置换明显增多,如A→C,T→A,C→A,T→C,T→G,CT→TG,GA→CG,TCTA→CTAC等,说明高压静电场组的主要突变类型为碱基置换。
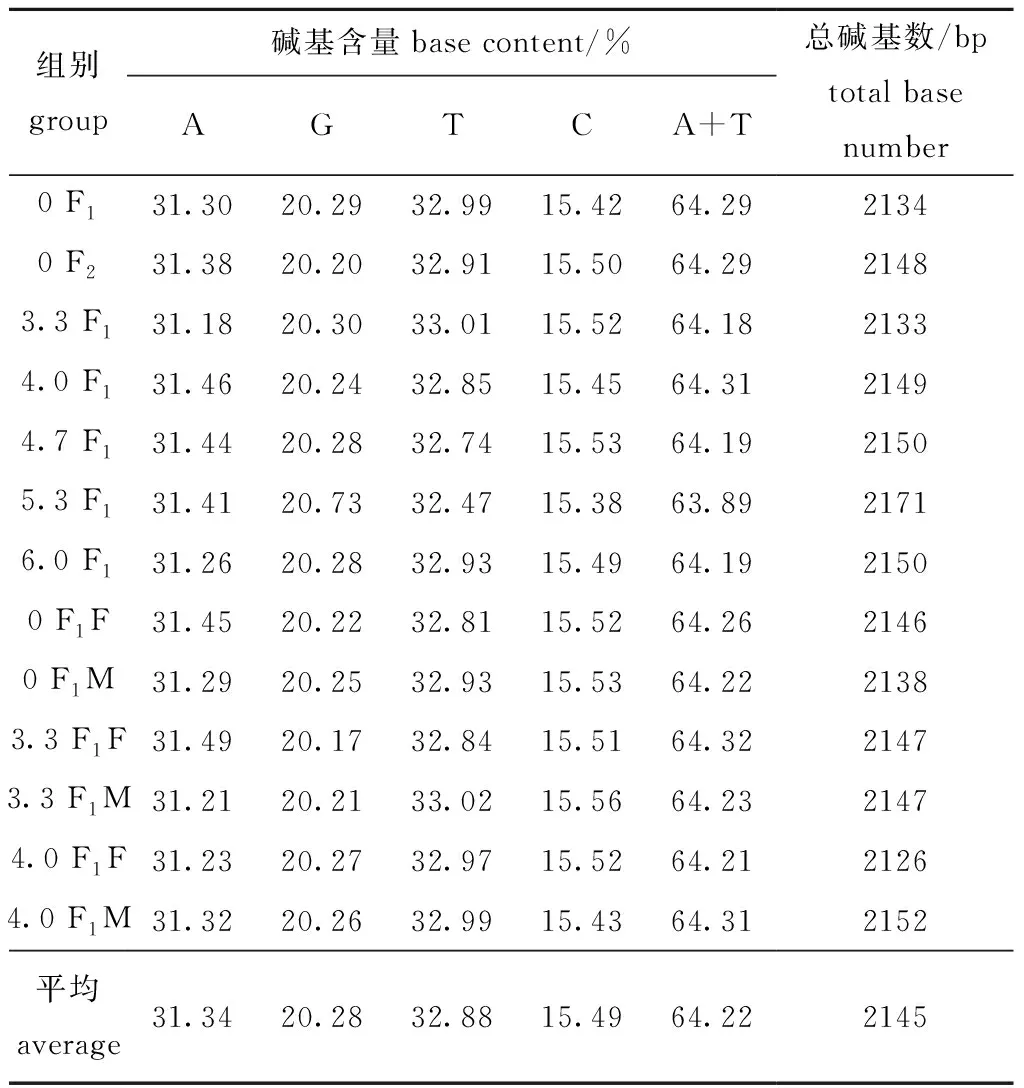
表8 13个样品基因序列基本信息Tab.8 Basic information of 13 sample gene sequences
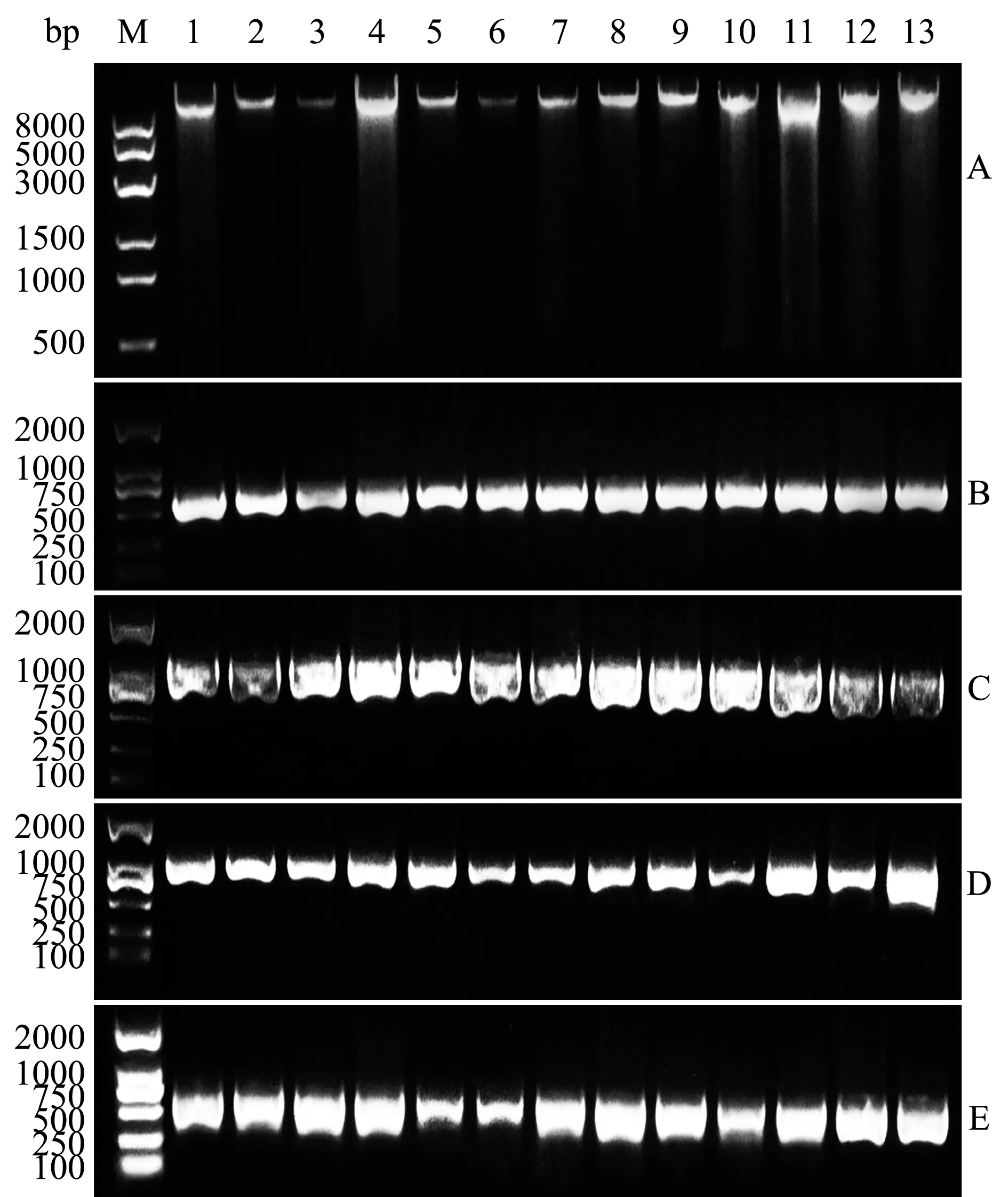
注:M为DNA Marker;A为提取的总DNA;B~D分别为rbcL基因的PCR扩增产物;E为部分rbcS基因的PCR扩增产物;1~13样品编号分别为0 F1、0 F2、3.3 F1、4.0 F1、4.7 F1、5.3 F1、6.0 F1、3.3 F1F、3.3 F1M、4.0 F1F、4.0 F1M、0 F1F、0 F1MNote:M,DNA Marker;A,Total DNA of gametophytes;B-D,The PCR amplification by rbcL primer; E,The PCR amplification by partial rbcS primer;1-13,Sample codes of 0 F1,0 F2,3.3 F1,4.0 F1,4.7 F1,5.3 F1,6.0 F1,3.3 F1F,3.3 F1M,4.0 F1F,4.0 F1M,0 F1F and 0 F1M,respectively图3 裙带菜F1 、F2代配子体的总DNA及PCR扩增产物Fig.3 Total DNA and PCR amplified products of F1 and F2 generation gametophytes of sea mustard Undaria pinnatifida
处理组与对照组的遗传距离矩阵如表9所示。从表9可见:对照组F1配子体和对照组 F2配子体的遗传距离为0.002 4,对照组 F1配子体与处理组F1配子体间的遗传距离为0~0.005 7,对照组 F2配子体与处理组F1配子体间的遗传距离为0~0.004 2。对照组F1和3.3 F1的遗传距离为0.002 4,此后随着电场强度的增加,对照组F1与处理组F1的遗传距离逐渐增大,与6.0 F1的遗传距离达到最大,为0.005 7。
雌、雄配子体的遗传距离矩阵如表10所示。从表10可见:6个样品的rbcL-sp-S基因遗传距离为0~0.006 6,对照组F1雌配子体与3.3 F1、4.0 F1雌配子体的遗传距离分别为0.006 2和0.001 4,对照组F1雄配子体与3.3 F1、4.0 F1雄配子体的遗传距离均为0.001 9,3.3 F1雌配子体与其他组的遗传距离均较大,为0.004 7~0.006 6。
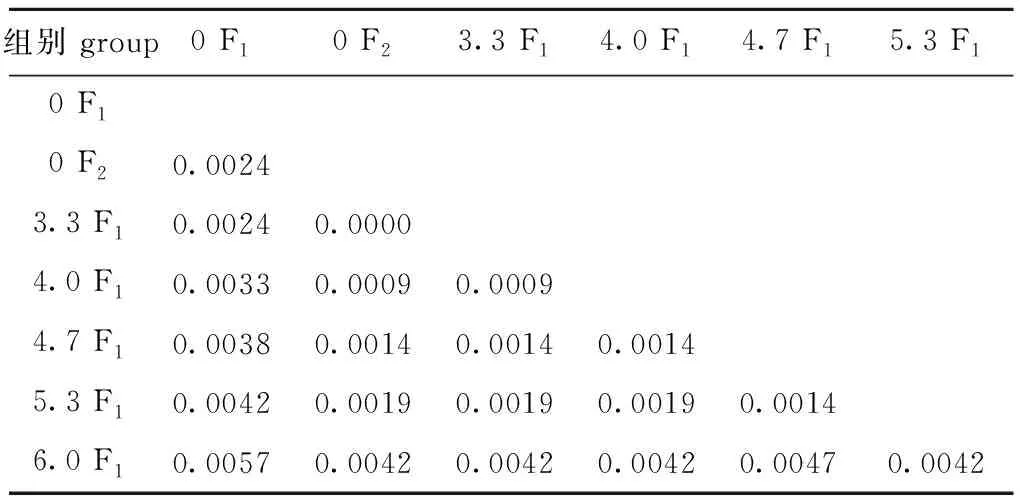
表9 各组基于Kimura 2-Parameter距离模式的遗传距离
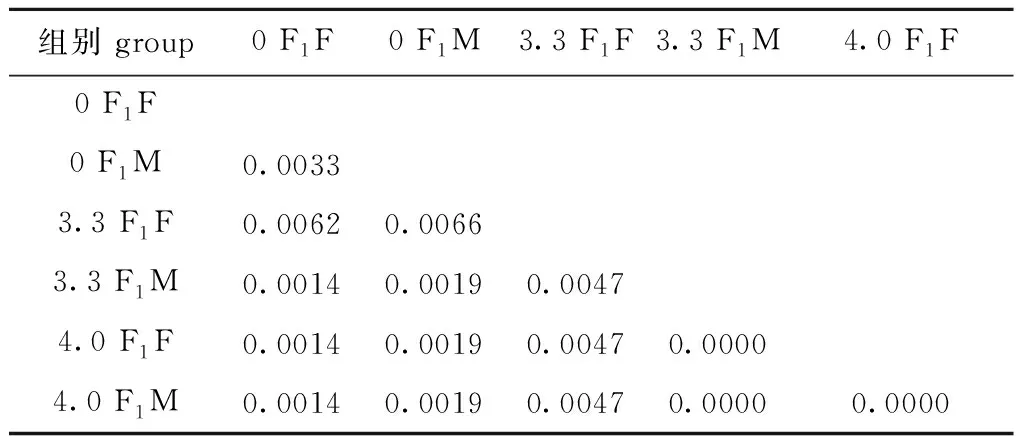
表10 雌、雄配子体基于Kimura 2-Parameter距离模式的遗传距离
利用NJ 法构建的系统树表明(图5),6.0 F1配子体首先与其他组分开,其他组分为2大分支,一个分支为5.3 F1配子体和4.7 F1的聚合,另一分支为4.0 F1配子体首先分开,0 F2配子体与3.3 F1聚合后与0 F1组成另一个分支,表明电场强度增大,基因变异加大。由图6可见:雌、雄组中,0 F1M配子体和4.0 F1M首先聚合在一起,接着与0 F1F聚合,然后与4.0 F1F聚合,再与3.3 F1M聚合,最后与3.3 F1F聚合;电场强度为3.3 kV/cm组,F1代雌配子体基因变异最大。
3 讨论
3.1 高压静电场对裙带菜生长发育的影响
在3.3~6.0 kV/cm电场强度、2~10 min处理时间范围内,随着电场强度及处理时间的增加,裙带菜配子体的存活率逐渐降低,但均在95%以上,表明高压静电场处理会使裙带菜配子体的存活率降低,但降低程度有限;高压静电场处理某些种子可以促进种子萌发,提高种子活力,然而也会对某些种子无明显效应或者抑制种子萌发[8]。本试验中,高压静电场处理对裙带菜雌、雄配子体的成熟率、成熟卵的受精率和受精卵的萌发率均无明显影响,表明高压静电场对裙带菜配子体的发育无明显效应。高压静电场在适宜范围内对植物的生长均有促进作用[17],可能是因为高压静电场能改变细胞酶活性,诱导膜电位的增大,增强其新陈代谢[8]。本试验结果也表明,高压静电场激励裙带菜配子体后,不仅促进配子体的生长,而且还促进其F1代孢子体的生长,随着孢子体的增大,生长优势更加明显。综上,选择适宜的电场强度和处理时间在裙带菜育种中尤为重要,本试验中在5.3 kV/cm电场强度、10 min处理时间条件下,裙带菜配子体的存活率在95%以上,获得的F1代孢子体产量最高。

图4 13个样品rbcL-sp-S核苷酸序列的对位分析Fig.4 Para analysis of the nucleotide sequence of 13 rbcL-sp-S samples

注:-表示缺失的核苷酸 Note:-shows deleted nucleotides续图4 13个样品rbcL-sp-S核苷酸序列的对位分析Cont.Fig.4 Para analysis of the nucleotide sequence of 13 rbcL-sp-S samples
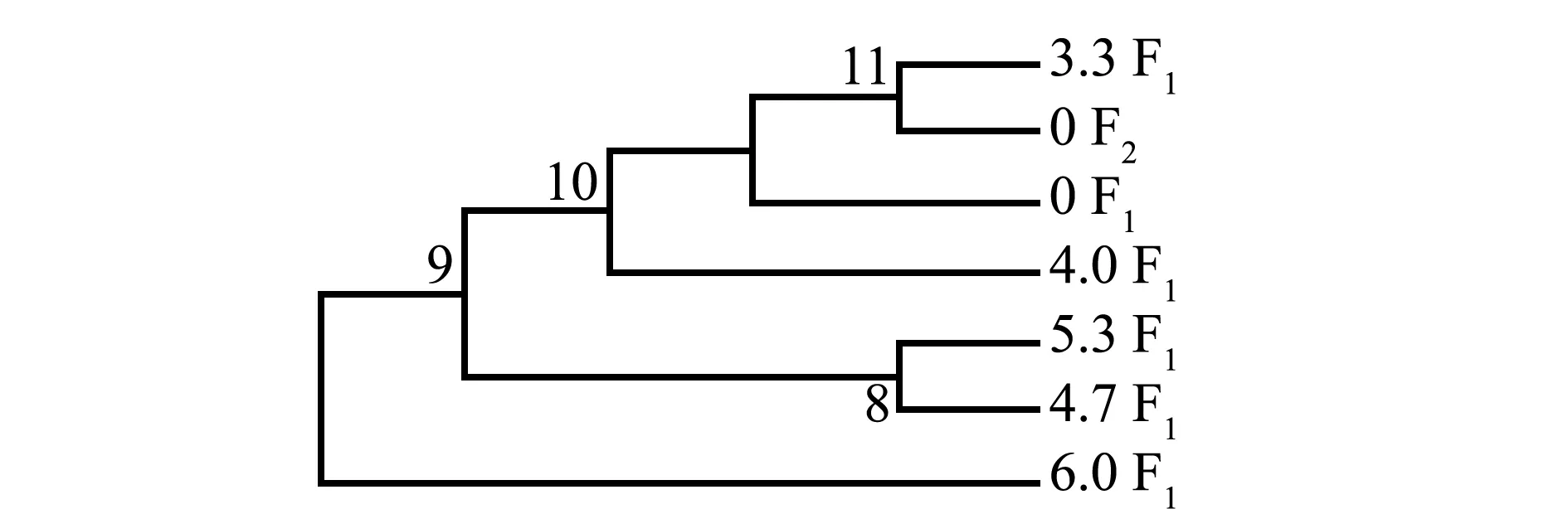
图5 各组NJ系统树Fig.5 NJ tree of each group
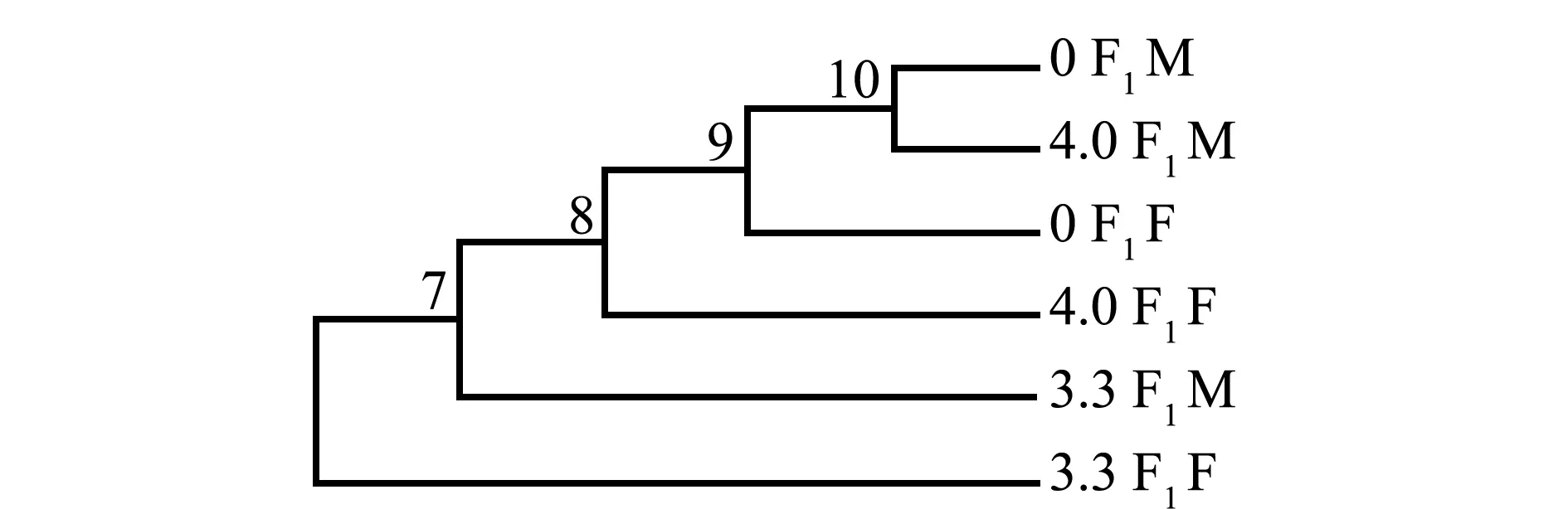
图6 雌、雄配子体NJ系统树Fig.6 NJ tree of female and male gametophytes
3.2 rbcL-sp-S基因序列分析
Rubisco是光合作用和光呼吸的关键酶,Rubisco大亚基由叶绿体基因rbcL编码, 小亚基由核基因rbcS编码,目前,已经从细菌、海藻、陆地植物等多物种中测定了rbcL、rbcL-rbcS间隔区、rbcS基因的全序列或部分序列,构成了相关核苷酸序列数据库,可以从分子水平上揭示植物间的亲缘关系和研究进化的本质,rbcL等基因序列分析已被广泛应用于藻类分类鉴定中[18-21]。由于高压静电场生物学效应还体现在可使基因发生突变[4-5],影响基因的转录、表达发生变化[5],导致遗传变异现象,故本研究中选取验证材料为从F1代孢子体获得的F1代配子体,如果高压静电场处理使配子体发生了遗传变异,那么在F1代配子体中将会检测到,本试验中同时检测了对照组F1代配子体、F2代配子体的基因信息用来消除自我突变的影响,遗传变异的检测方法采用rbcL、rbcL-rbcS间隔区、部分rbcS基因序列分析,兼顾rbcL基因的高度保守性和rbcS基因保守性相对较低的特性,从而更好地表现出种内的基因差异。
本研究结果表明,处理组的碱基置换明显增多,如A→C,T→A,C→A,T→C,T→G,CT→TG,GA→CG,TCTA→CTAC等,也出现碱基缺失和插入情况,这与宋智青[5]的研究结果一致;对照组F1配子体与F2配子体的遗传距离为0.002 4,对照组F1和3.3 F1的遗传距离为0.002 4,表明电场强度为3.3 kV/cm时,基因变异较小,与自我突变相同,此后随着电场强度的增加,对照组F1配子体与处理组F1配子体的遗传距离逐渐增大,当电场强度为6.0 kV/cm 时,对照组F1配子体与处理组F1配子体的遗传距离达到最大,为0.005 7,表明随着电场强度的增大,F1配子体的基因变异增大,但整体上仍在同种范围内,说明高压静电场处理裙带菜配子体能引起遗传变异,但对于这种遗传变异与裙带菜的产量提高间是否有必然联系还需进一步地深入研究。
本研究中进行的rbcL-sp-S基因序列分析表明,高压静电场处理对裙带菜雌、雄配子体的遗传变异影响无明显差异,可能是因为测定的基因序列不是性别决定基因或者测定的序列不完全,但电场强度为3.3 kV/cm 时的F1雌配子体与其他组的遗传距离均较大,为0.004 7~0.006 6,出现这种情况的原因还有待进一步研究。
