培养基变化和接种不同生长期细菌对印度芽孢杆菌L15生长的影响
2018-08-01张东升葛红生石泽阳周玮
张东升,葛红生,石泽阳,周玮
(大连海洋大学 农业部北方海水增养殖重点实验室,辽宁 大连 116023)
因益生菌能改善水质[1-2],提高养殖动物产量[3]、免疫力[4-5]和饵料利用率[1],从而被水产养殖者广泛使用[1]。根据功能不同,水产益生菌分为用于提高水生动物生长、免疫和饵料利用率的饲料补助剂,以及用于改善水质的水质改良剂。用来改善水质的益生菌通常采用泼洒[6-8]方式。国内用于改善池塘水质的益生菌一般先用池塘水加红糖或麦麸的方式活化5~6 h[3,7],而国外则使用灭菌的纯净水在27~32 ℃下活化益生菌和酶制剂16~18 h[1],再将活化菌泼洒在池塘中。但也有部分芽孢杆菌生产商提供的芽孢菌按比例可直接泼入养殖池塘中。目前,对使用芽孢还是活化后的营养细胞,哪一种更有利于益生菌在池塘中的生长尚无文献报道。此外,国内外益生菌的生产与实际使用往往脱节,生产厂商常根据益生菌产量最大化原则选择培养基里的碳、氮源和环境条件培养益生菌,往往不考虑益生菌使用场所的营养和环境,当益生菌培养基和使用场所的营养环境差异较大时,是否会影响益生菌的生长目前尚无报道。
前期试验中,作者从大连市某刺参池塘中分离出一株高效降解刺参池塘有机质的益生印度芽孢杆菌L15菌株[9],并研究了发酵培养L15菌株的海水、淡水发酵培养基及培养条件[10],淡水发酵培养基培养的L15菌株可以获得较好的芽孢产量,其降解刺参底泥有机质提取液COD的能力与海水发酵培养基相近[10]。为考察用淡水培养基培养L15菌株几代后,在海水环境中的生长和功能是否发生了变化,本试验中测定了用不同培养基培养的L15菌株5代后的芽孢和营养细胞接种在不同营养和环境培养基后的生长情况,旨在为L15菌株今后的应用提供一定的科学依据,也为其他益生菌株的使用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种及培养基原料 芽孢杆菌L15菌株取
自大连海洋大学水产与生命学院实验教学中心。培养基原料麦麸、豆粕购买于大连市某饲料厂,培养基其他成分均为化学分析纯试剂。
1.1.2 培养基及其配制
2216E培养基(Z):蛋白胨5 g,酵母膏1 g,FePO40.01 g/L,陈海水1000 mL,pH 7.0~7.5。
海水发酵培养基(S):豆粕2.5 g,麦麸2.5 g,陈海水1000 mL,pH 7.0~7.5。
淡水发酵培养基(F):豆粕2.5 g,麦麸2.5 g,纯水1000 mL,分别加入1 mL 0.025 mg/mL的MgCl2、MnCl2、CaCl2,pH 7.0~7.5。
将上述各种培养基配好后,分别装到50 mL的大试管中,每管装10 mL,于121 ℃下灭菌20 min,冷却待用。
1.2 试验设计
1.2.1 L15菌株营养细胞和芽孢悬液的制备 将L15菌株分别接种于2216E(Z)、淡水(F)、海水(S)的固体发酵平板培养基上,于25 ℃下培养3 d,再转接到各自同样的培养基上培养3 d,重复3次,最后各自接种于斜面培养基上培养5 d,于冰箱(4 ℃)中保存,冷藏1个月后,用接种针分别划线接种在各自原培养基上,于25 ℃恒温培养箱中培养22 h,然后用接种环刮下,悬浮在灭菌海水中,作为L15菌株营养细胞用于试验。
同时,将上述冷藏的L15菌株用接种环刮下置于灭菌的海水中,摇匀,作为L15菌株芽孢用于试验。用血球计数板计数,通过稀释使试管中的营养细胞和芽孢量相近,最终稀释至密度为(1.1~1.2)×107cell/mL。
1.2.2 培养基变化对L15菌株营养细胞和芽孢生长的影响试验 将上述制备好的L15菌株营养细胞和芽孢各 0.01 mL 分别接种到Z、F、S培养基中,共18个组合(表1),每组重复3次,然后,从每组中取出3 mL培养液于比色皿(直径为1 cm的玻璃比色皿)中,在721分光光度计(波长 600 nm)下测定原始菌液吸光度值OD0。然后将这些试管放于25 ℃、150 r/min的恒温培养箱中培养,分别培养72、96 h时取出,静止10 min,取出3 mL培养液分别测定每支试管中菌液的吸光度值OD72 h、OD96 h,用OD72 h-OD0、OD96 h-OD0分别表示L15菌株在72 h和96 h的生长情况。
1.3 数据处理
利用SPSS 19.0软件对不同培养基上的细菌细胞生长数据进行统计分析,采用Duncan法进行多重比较,显著性水平设为0.05。
表1 试验设计Tab.1 Experimental design
注:在试验组中第二个下标字母Z、F、S分别表示后培养基,CZ、CF、CS分别表示来自前培养基Z、F、S培养的营养细胞;SZ、SF、SS分别表示来自前培养基Z、F、S培养的芽孢
Note:The second subscript letters Z,F and S in the experimental groups represent different follow media, respectively. CZ,CFand CSrepresent vegetative cells in the former culture media Z, F, S culture, respectively. SZ, SFand SSrepresent spores from the former media Z, F and S culture, respectively
2 结果与分析
2.1 接种营养细胞和芽孢对L15菌株生长的影响
从图1可见:培养到72 h时,18组中有6组接种营养细胞的L15菌株增长量大于接种芽孢的增长量,占接种营养细胞的2/3;而培养到96 h时,只有4组接种营养细胞的L15菌株增长量大于接种芽孢的增长量,说明有些芽孢组在72 h 后仍继续生长,其中,接种由S培养基培养的营养细胞后的细菌增长量均高于接种相同培养基培养的芽孢后的增长量。72 h时,只有一组接种由F培养基培养的营养细胞后的细菌增长量大于接种相同培养基培养的芽孢后的细菌增长量;但96 h时,接种由F培养基培养的营养细胞后的细菌增长量均小于接种相同培养基培养的芽孢后的增长量。而接种由Z培养基培养的营养细胞和芽孢后的细菌增长量无明显规律。说明并非接种营养细胞的L15菌株增长量总是高于接种芽孢的增长量。
2.2 培养基对L15菌株生长的影响
从培养基的碳、氮源分子量大小分析,Z培养基的碳、氮源分子量较小,可以被细菌细胞直接吸收,而S培养基和F培养基的碳、氮源由大豆和麦麸组成,分子量较大,需要酶降解后才可吸收。从环境上分析,Z培养基和S培养基均由海水配制,F培养基由蒸馏水配制。
从图2、图3可见,由营养易被细菌直接吸收的Z培养基培养的营养细胞CZ转移到营养不易被直接吸收的F和S培养基后,L15菌株增长量降低,且前培养基Z和后培养基F盐度差异大时,盐度和营养两因素对L15菌株生长的协同作用较大,因此,相比S培养基,CZ接种到F培养基里的L15菌株增长量最小。当由营养不易被直接吸收的F和S培养基培养的CF和CS转移到易被直接吸收的Z培养基时,L15菌株增长量增大,且前培养基F和后培养基Z盐度差异大时,营养和盐度两因素对L15菌株生长的协同作用较小。这表明,前后培养基营养的难易吸收性决定了接种L15菌株营养细胞的生长速率。
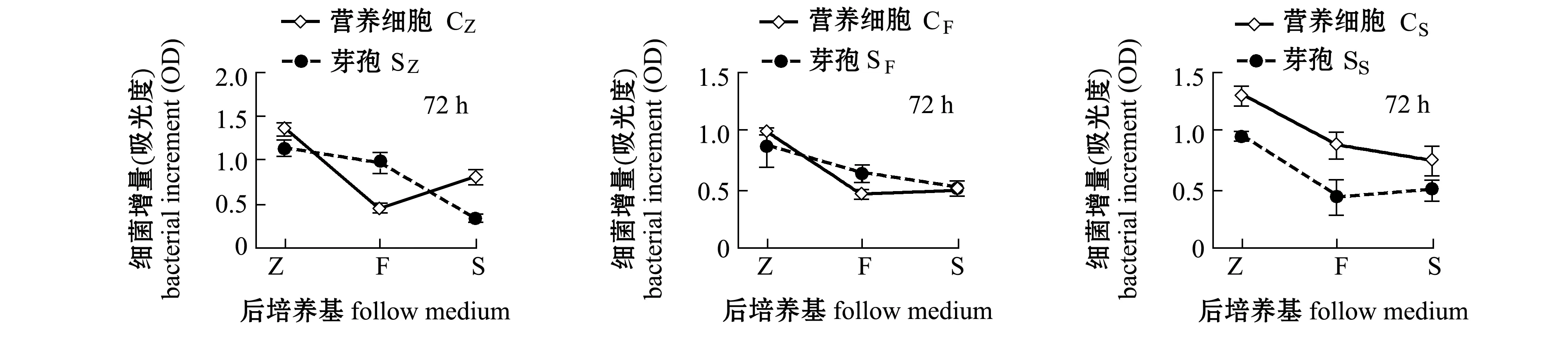
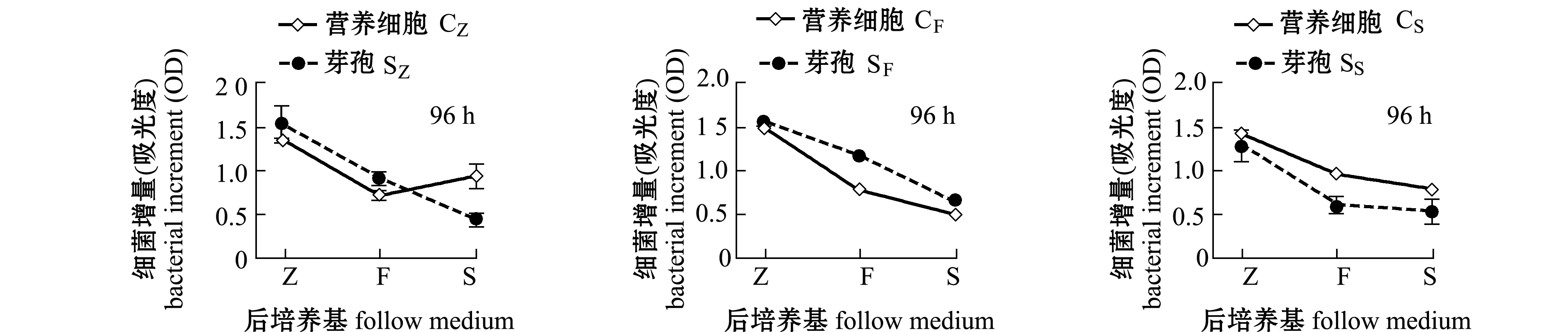
图1 接种营养细胞和芽孢对L15菌株生长的影响Fig.1 Effect of vegetative cells and spores on growth of L15 strain
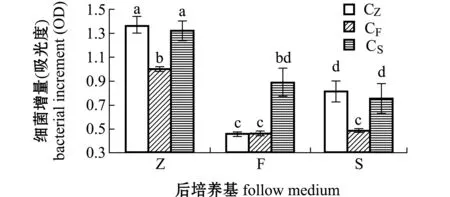
注:标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同Note:The means with different letters are significant differences at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia图2 接种营养细胞的L15菌株在72 h的增量Fig.2 Increase in number of L15 strain in 72 h by inoculation vegetative cells
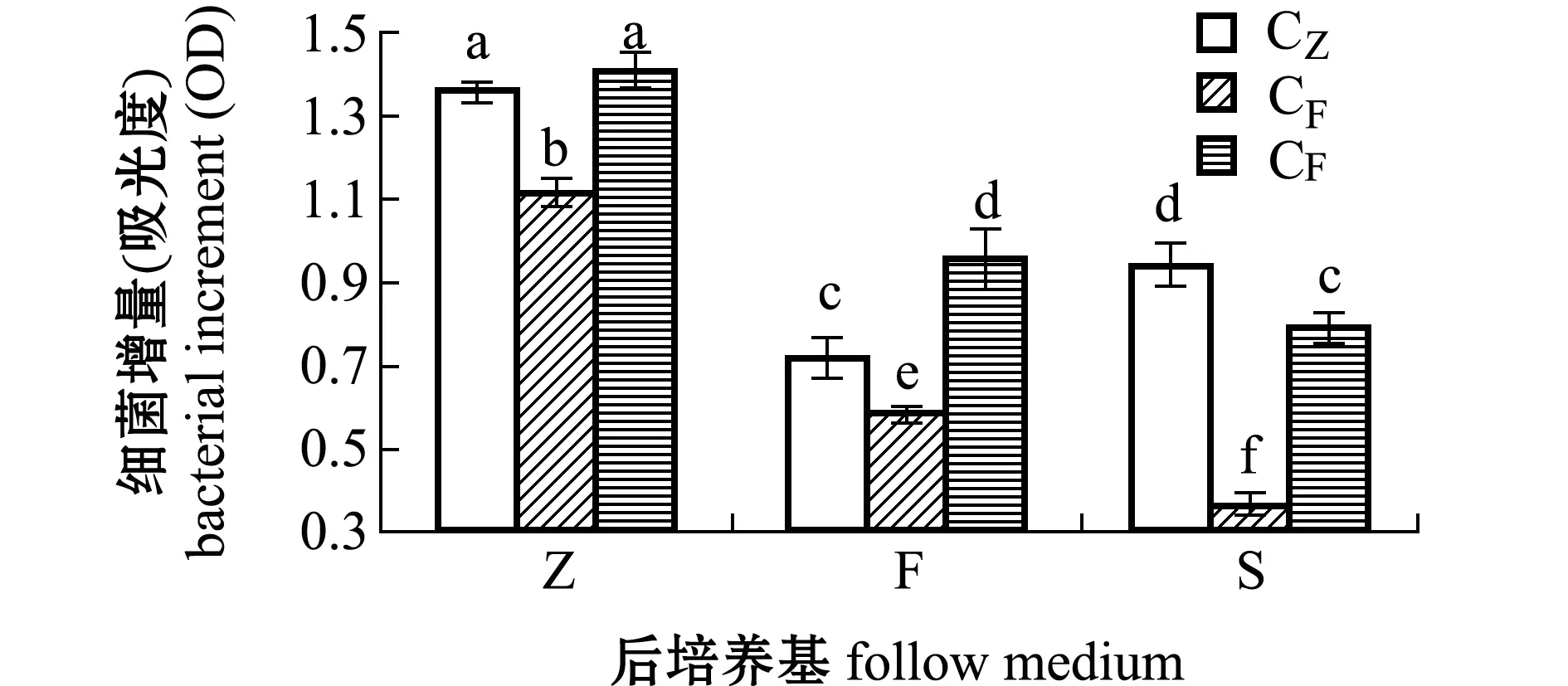
图3 接种营养细胞的L15菌株在96 h的增量Fig.3 Increase in number of L15 strain in 96 h by inoculation vegetative cells
从图4、图5可见,由Z培养基培养的SZ接种到F和S培养基后,或由F和S培养基培养的SF和SS接种到Z培养基后,L15菌株的生长情况与上述接种营养细胞的生长情况类似,但与接种营养细胞的L15菌株相比,接种芽孢的L15菌株由Z培养基转移到F和S培养基后前后培养基盐度和营养的差异并没有体现出较大的协同作用,L15菌株在F培养基中的增加量并没有降低,反而比转移到S培养基中增长量要大,表明接种芽孢后的L15菌株增长量更依赖于营养直接吸收性的难易,盐度协同作用较小。
2.3 盐度对L15菌株生长的影响
S和F培养基的碳、氮源组成一致,但S培养基液体成分为海水,F培养基液体成分为淡水。同一种培养基(F或S)培养的营养细胞同时转移到F和S培养基里,培养72 h时生长差异不显著(P>0.05)(图2),但培养到96 h时,在F培养基上的细菌生长均显著高于在S培养基上的生长(P<0.05)(图3)。同样条件下,接种L15菌株芽孢,在F和S培养基上培养72 h时,L15菌株增长量差异也不显著(P>0.05)(图4),但培养到96 h时,接种SF芽孢在F培养基上的细菌生长显著大于在
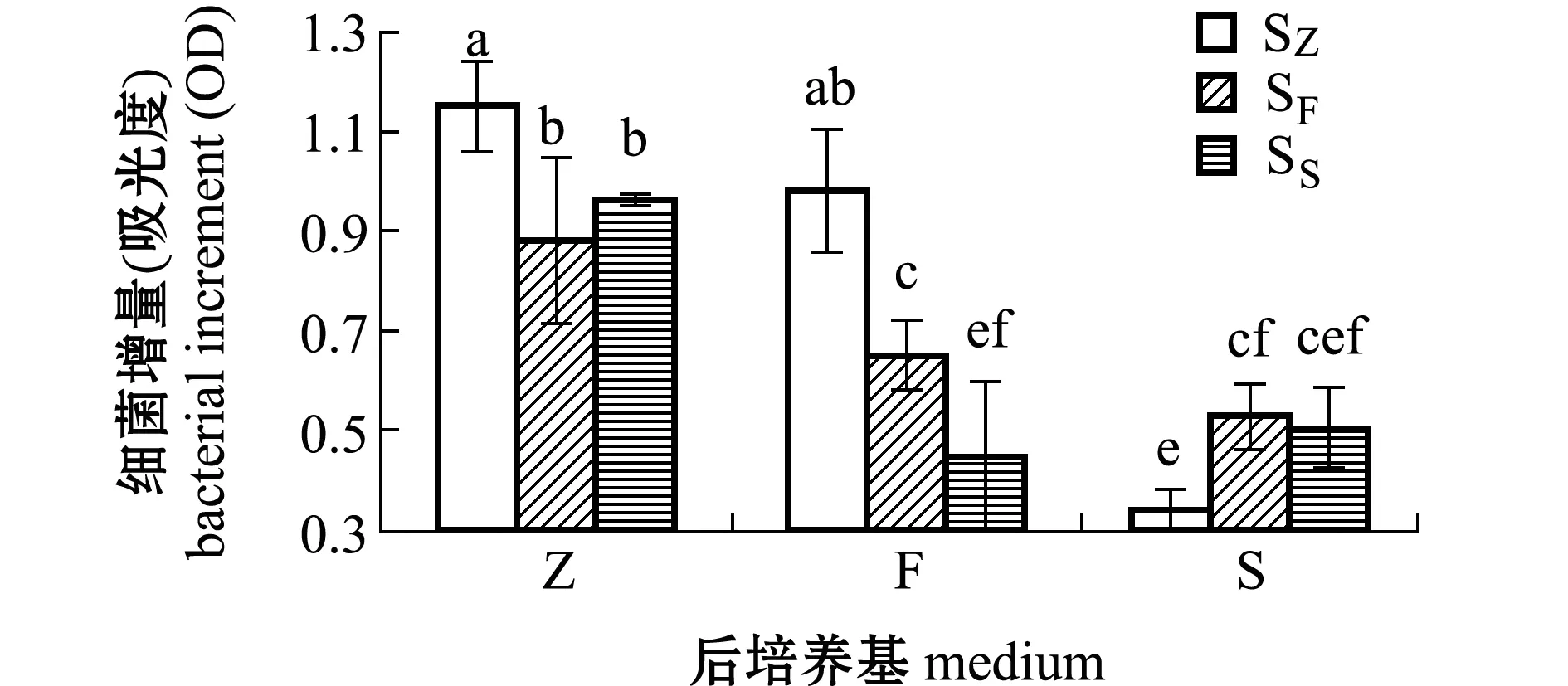
图4 接种芽孢的L15菌株在72 h的增量Fig.4 Increase in number of L15 strain in 72 h by inoculation spores
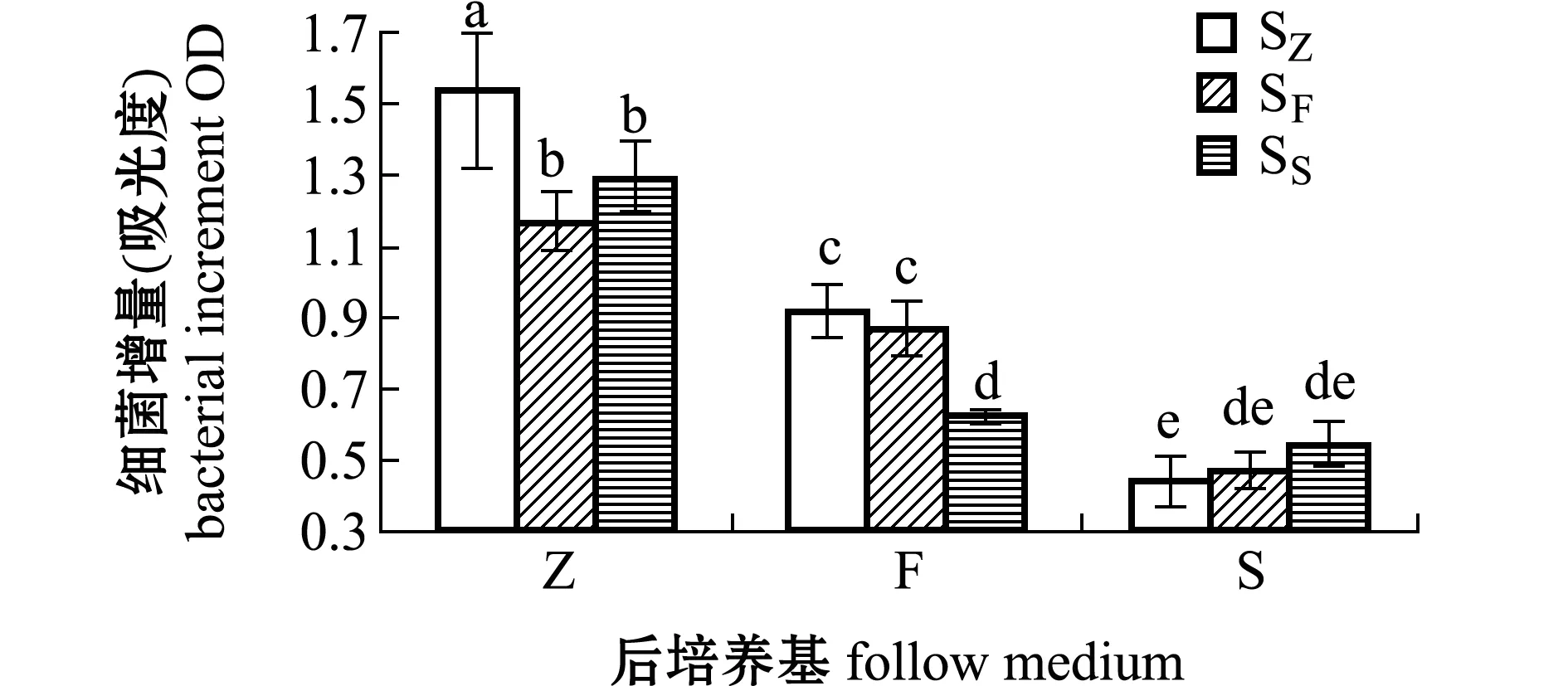
图5 接种芽孢的L15菌株在96 h的增量Fig.5 Increase in number of L15 strain in 96 h by inoculation spores
S培养基上的生长(P<0.05),但接种SS芽孢在F和S两种培养基上的生长差异不显著(P>0.05)。这说明无论接种的是营养细胞还是芽孢,盐度对L15菌株稳定期之前的生长影响不显著,但较高盐度缩短了L15菌株对数生长期时间,尤其缩短了L15菌株由F培养基转移到S培养基后的对数生长时间。
3 讨论
3.1 接种营养细胞和芽孢对L15菌株生长的影响
细菌转入新环境中生长的快慢,除了受细菌遗传因子影响外,还受培养基营养组成和培养条件的影响,如碳、氮源的种类和数量[11-12]、pH、温度[13]、溶氧、氧化还原电位、培养转速、接种体积[14]、接种量[11,15-16],以及接种细菌所处状态等。本研究中通过测定不同培养基培养的L15菌株营养细胞或芽孢转入与原培养基相同或不同培养基后的生长状况,对指导益生菌使用和研究益生菌的培养均具有重要意义。
一般认为,接种营养细胞后的细菌增长量高于接种芽孢后的增长量,主要是因为指数期细菌处于生长旺盛期,接入新培养基后其停滞期较短,而芽孢生长需要萌发时间,萌发后细胞需要较长时间的物质积累才能进入分裂期。但本研究中发现并非如此,接种由S培养基培养的L15菌株营养细胞后的细菌增长量小于接种芽孢后的细菌增长量,而接种由F培养基培养的L15菌株营养细胞后的细菌增长量却低于接种芽孢后的细菌增长量,接种芽孢后的细菌增长量大于接种营养细胞后的增长量的机理有待进一步验证,但可对益生菌使用提供借鉴,并不是改善池塘水质用益生菌均需要活化,而要根据益生菌发酵培养基和使用环境进行预试验,以便确定使用该益生菌的营养细胞还是芽孢。
3.2 培养基物质组成对L15菌株生长的影响
细菌可以直接吸收小分子物质,大分子物质则必须通过细菌分泌的胞外酶将其降解成小分子物质后才可被吸收,因此,细菌在小分子环境中的生长速度高于在大分子物质环境中的生长速度。本研究中的结果与此相同,但当L15菌株从小分子培养基转移到大分子培养基(2216E)后,其生长速度有时低于原来一直由大分子培养基培养的生长速度,这可能是细菌需要一个适应过程,因此,生产益生菌时,应尽量选用培养基碳氮源组成与使用场所营养组成相近的碳氮源。
3.3 盐度对L15菌株生长的影响
盐度影响细菌生长和代谢,环境中的盐度在细菌生长最适范围外时,细菌生长和新陈代谢活性降低,严重时将导致细胞脱水最后发生质壁分离,甚至死亡[17],L15菌株最适生长盐度为15~20[9],在淡水和海水中生长稍差,但在淡水中生长略高于海水,因此,当由F培养基培养的L15菌株接种到S培养基时,生长率略有降低,培养到72 h时,生长差异不显著,但培养到96 h时,接种到S培养基中的L15菌株生长显著降低,而接种到F培养基中的L15菌株仍在继续生长,由此可见,在F、S培养基中的生长出现了显著差异,但是将S培养基培养的L15菌株营养细胞接种在F和S培养基后,在96 h时都在继续生长,因此,在海水环境中使用L15菌株时,最好使用S培养基培养的营养细胞为好。因为用淡水发酵培养基培养第5代的L15菌株转移到F和S培养基上培养时,其生长不如在海水发酵培养基上培养的L15菌株,因此,如果用淡水发酵培养基培养L15菌株进行使用的话,应以培养第一代的L15菌株为好。
