SL7207/pBud-VP3-IL-24的肿瘤靶向性及其对胃癌细胞免疫作用研究*
2018-07-31曹红丹
曹红丹,吕 琳
(1.重庆医药高等专科学校护理学院 401331;2.重庆医科大学附属第二医院消化内科 400010)
减毒沙门菌是一种常见的侵袭性胞内菌,以它作为基因治疗的载体,可以将外源DNA运送至真核细胞并在其中表达,被广泛应用于肿瘤治疗及抗肿瘤药物研究[1]。此外,它可选择性地聚集到实体肿瘤内,并能明显延缓多种肿瘤包括黑色素瘤、结肠癌、肺癌和乳腺癌等的生长[2-3]。目前研究显示,减毒沙门菌在体外抗肿瘤实验及动物模型实验中均取得了较满意的治疗效果[4]。临床试验证实,其具有较高的肿瘤靶向性和安全性[5]。
本课题组在前期工作中构建了基于白细胞介素-24(IL-24)的减毒沙门菌载体(命名为SL7207/pBud-VP3-IL-24),发现其对胃癌肿瘤细胞生长具有抑制作用[6]。本研究主要对其在小鼠体内分布情况及抗肿瘤免疫作用机制进行分析,以进一步探讨其作用机制。
1 材料与方法
1.1材料 减毒沙门菌载体 SL7207/pBud-VP3-IL-24(含EGFP)前期已构建。减毒沙门菌SL7207、大肠杆菌DH5a、MFC小鼠胃癌细胞、YAC-1小鼠淋巴瘤细胞株由重庆医科大学附属第一医院肿瘤分子与表观遗传实验室惠赠; 6~8周龄无特殊病原菌(SPF)级Balb/c雌性小鼠,由重庆医科大学实验动物中心提供。RPMI1640培养液、新生牛血清(fetal bovine serum,FBS)、0.25%胰酶、博莱霉素(Zeocin)、四甲基偶氮唑盐(MTT)购自美国Gibco和Invitrogen公司。
1.2方法
1.2.1荷瘤小鼠模型的建立及治疗 将对数生长期胃癌细胞系MFC,制备胃癌细胞悬液,用生理盐水将细胞浓度调至1×107个/mL,取清洁级健康小鼠90只,体质量(20±1)g,无菌环境下,在每只小鼠右侧腋窝皮下以0.1 mL注射胃癌细胞悬液。接种第8天,以皮下肿瘤直径大于0.5 cm为成瘤标准。将小鼠分为3组,即A组为 SL7207/pBud-Vp3-IL-24;B组为SL7207/pBud;C组为对照组,每组30只。将SL7207/pBud 、SL7207/pBud-VP3-IL-24菌液接种于含Zeocin的LB培养液中培养,至对数生长晚期时,测600 nm处吸光度值(A600)=0.6时收集菌体,用生理盐水调整细菌为1×107cfu/mL。A、B组小鼠用3%碳酸氢钠中和胃酸后,利用胃管口服饲喂相应细菌0.1 mL,每周1次,共服2次,C组口服饲喂等量生理盐水。
1.2.2组织匀浆菌落计数 在治疗后第7、14、21天分别将A组小鼠3只脱颈处死,无菌分离肝、脾、肾脏、心脏、胃和肿瘤,以磷酸盐缓冲液(PBS)清洗,称重,然后以1∶5 的比例(1 g 组织∶5 mL培养液) 加入LB培养液,玻璃匀浆器中匀浆。将匀浆液按100倍比稀释(×100)。参照文献[7],取100 μL 稀释液接种到10 cm 的LB琼脂平板上,37 ℃温箱内倒置培养过夜,然后直接计数平板上的细菌菌落数。每克组织内的细菌数=菌落数×103×100(稀释倍数)。
1.2.3免疫荧光显微镜和肿瘤组织病理形态学观察 在A组治疗后,采用上述方法无菌剥离瘤体组织和分离肝、脾、肾、心脏、胃,制作冰冻切片,荧光显微镜下检测VP3-EGFP融合蛋白表达状况。制作石蜡切片,苏木精-伊红(HE)染色观察各组织病理变化。
1.2.4RT-PCR半定量分析 Trizol法提取各组瘤体组织和器官中总RNA。紫外分光光度计测定260 nm处及280 nm处吸光度值(A260及A280),分析RNA纯度并调整浓度。反转录反应制备cDNA,以PCR产物进行IL-24基因片段扩增,扩增片段为530 bp,引物:上游引物P1 5 ′-CGA AGC TTA TGA ATT TTC AAC AGA GGC TG-3′,P2下游引物5′-CGGT CGA CCT AGA TTC AGA GCT TGT AG-3′,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照基因,PCR扩增条件为:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s延伸35个循环;72 ℃延伸10 min。扩增产物进行1%琼脂糖凝胶电泳30 min,凝胶图像分析仪观察拍照,并测定条带积分吸光度(intergral A,IA)值,以待检基因条带与内参条带GAPDH的IA比值作为目的基因相对表达量。
1.2.5淋巴细胞增殖实验 3组小鼠治疗后14 d,脱颈处死,无菌从小鼠取脾脏,用淋巴细胞分离液分离淋巴细胞,PBS洗涤2次,用RPMI1640培养液调整细胞浓度至 1×106个/mL,制得脾淋巴细胞悬液。96孔培养板每孔加入150 μL脾淋巴细胞悬液,继而加入经RPMI1640完全培养液配制的刀豆蛋白A(ConA)100 μL(终浓度5 μg/mL),每实验组设5个复孔,置37 ℃,5% CO2饱和湿度条件下培养72 h。培养结束前4 h,每孔加入20 μL MTT(5 g/L),继续培养4 h。培养结束后加二甲亚砜150 μL,在酶标仪570 nm处测定吸光度值(A)。
1.2.6乳酸脱氢酶(LDH)稀释法检测自然杀伤细胞(NK细胞)活性 采用上述方法分离获得脾淋巴细胞,以0.83% Tris-NH4C1(pH=7.2)破除红细胞,没有黏附的淋巴细胞作为NK反应细胞。以小鼠淋巴瘤细胞(YAC-1)作为靶细胞检测NK细胞活性。脾淋巴细胞 1×106个/孔和 YAC-1细胞 5×104个/孔(起始效应:靶细胞比值为20∶1),同时设靶细胞自然释放孔和最大释放孔,每组5个平行孔,置37 ℃,5% CO2孵育2 h。1 000 r/min离心5 min。 吸取各孔上清液0.1 mL加至96孔板中,37 ℃,10 min。每孔再加入0.1 mL新配制的LDH底物溶液,室温避光反应10~15 min,加入30 μL柠檬酸终止液终止酶促反应。在酶标仪490 nm处测定A值。NK细胞活性(%)=(反应孔A-自然释放孔A)/(最大释放孔A-自然释放孔A)×100%。
1.2.7巨噬细胞吞噬功能测定(中性红实验) 每组选取3只体质量相近的6周龄昆明种小鼠,摘眼球放血,引颈处死。吸取腹腔灌洗液,收集到50 mL离心管,4 ℃、3 000 r/min离心10 min后,去上清液,加1 mL完全 RPMI1640培养基。计数细胞,并调节细胞密度到2×106个/mL,接种在96孔板(2×105个/mL) ,培养4 h,各孔加入0.075%中性红(100 μL/孔),5% CO2,培养箱37 ℃培养1 h,除去中性红溶液,预热D-Hanks液洗涤细胞3次(pH 7.2)。各孔加入100 μL裂解液,室温静止过液。混合均匀后于酶标仪上测定540 nm处的A值(A540),以A值表示巨噬细胞摄取中性红的能力。
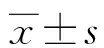
2 结 果
2.1减毒沙门菌SL7207 在小鼠体内分布 组织匀浆菌落计数表明,A组治疗后7 d在小鼠胃、肝、脾和肿瘤组织发现有减毒沙门菌,其中胃组织比其他脏器和肿瘤组织细菌数量要多(P<0.05); 第14天,细菌数目在胃组织内逐渐减少,肿瘤组织中逐渐增多; 到第21天,除了脾脏和胃有少许细菌分布外,其他正常组织内没有观察到细菌,肿瘤组织中细菌数量却比其他组织明显增多,肿瘤/脾脏的菌量最大比可达212∶1(图1)。
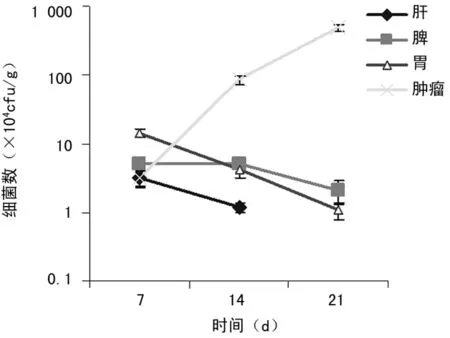
图1减毒沙门菌SL7207 在小鼠体内分布状况
2.2Apoptin-EGFP和IL-24体内表达状况 在A组治疗后7 d,荧光显微镜下可见肿瘤组织有VP3融合绿色荧光蛋白(apoptin-EGFP) 表达,在肿瘤外其他脏器中脾脏和肝脏也发现了荧光蛋白的表达,但其他重要脏器,如心、胃、肾未发现。HE染色可见肿瘤组织经治疗后,肿瘤组织有较多坏死区,细胞核溶解,其他脏器未见明显异常改变(图2、3)
RT-PCR检测结果显示,第7天在肿瘤组织有IL-24表达,随着时间推移,其表达量逐渐增多,同时在免疫器官肝脏和脾脏也发现有表达,肿瘤组织内表达量显著高于其他组织(P<0.05),见图4、5。
2.3SL7207/pBud-VP3-IL-24对小鼠脾淋巴细胞增殖功能及NK细胞杀伤活性的影响 与C组相比较,A组有较强的促进淋巴细胞增殖和 NK细胞杀伤活性的作用,各组之间差异有统计学意义(P<0.05),见表1。
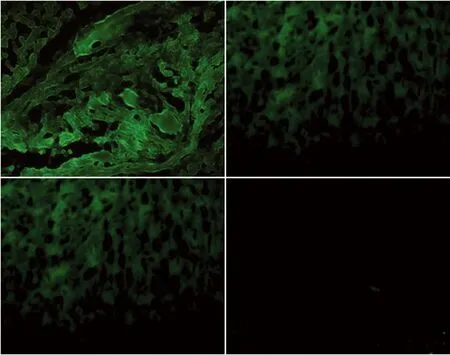
A:肿瘤组织;B:脾;C:肝; D:心
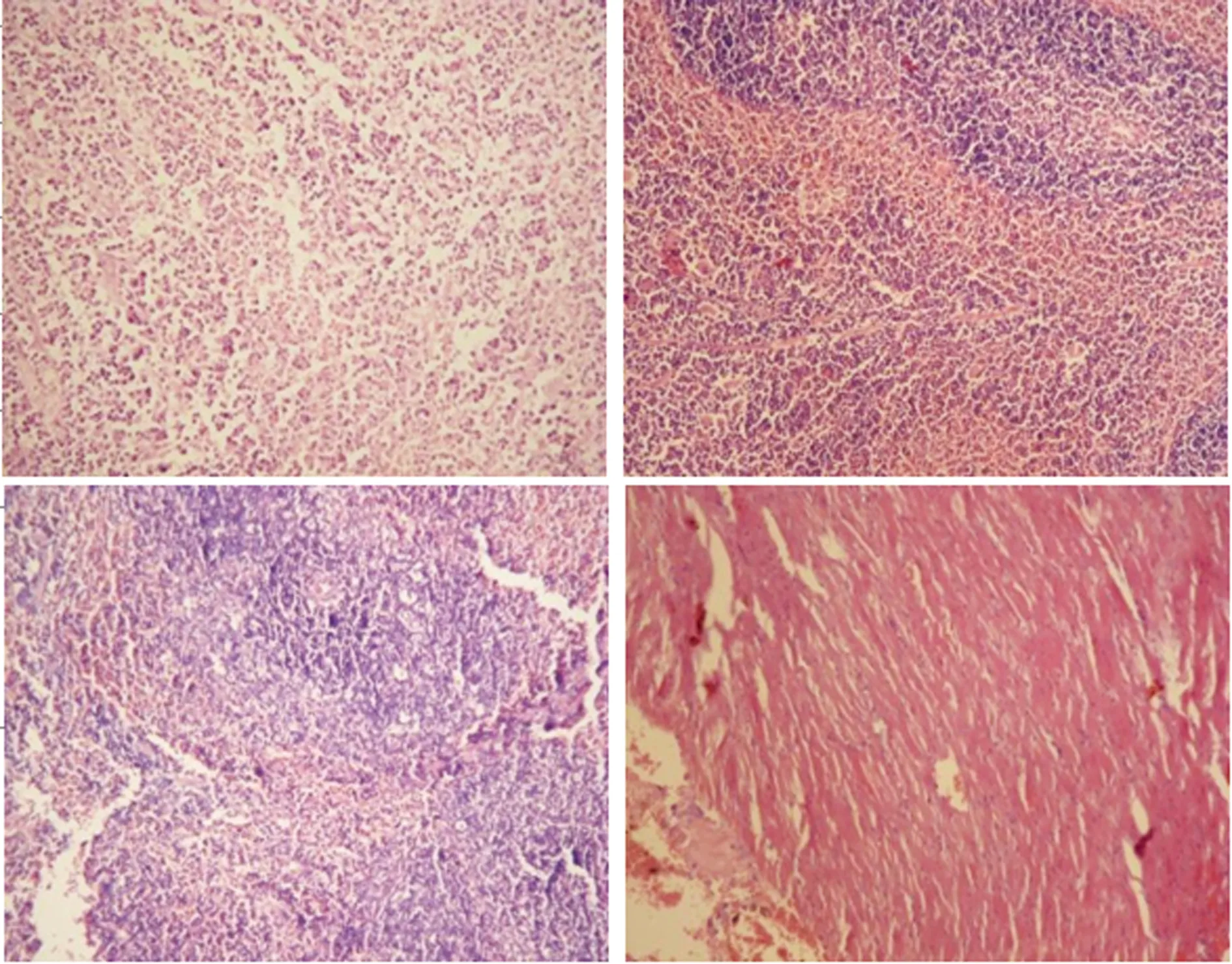
A:肿瘤组织;B:脾;C:肝; D:心
2.4SL7207/pBud-VP3-IL-24对小鼠腹腔巨噬细胞吞噬功能的影响 巨噬细胞吞噬功能实验结果显示,A、B、C组A540值分别为0.49±0.10、0.38±0.02、0.12±0.01,SL7207/pBud-VP3-IL-24可显著提高腹腔巨噬细胞的吞噬活性(P<0.05)。
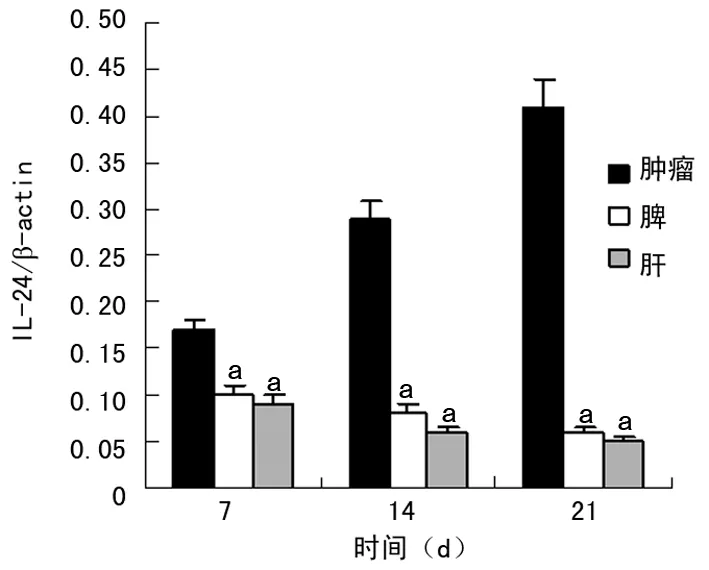
图5 IL-24在荷瘤小鼠不同组织中的表达
表1 小鼠脾淋巴细胞增殖功能及NK细胞杀伤活性的检测
a:P<0.05,与C组相比
3 讨 论
自从1893年COLEY等偶然发现癌症患者术后感染厌氧菌能够使病情好转以来,厌氧菌在肿瘤治疗中的作用逐渐引起研究者的兴趣[7]。PAWELEK等[8]将减毒沙门菌YS72(pur-)及YS721(pur-,ilv-)等通过腹腔内注射途径注入荷瘤C57B6小鼠体内,发现细菌能够优先聚集在肿瘤组织中;肿瘤组织与正常组织细菌比例最大可达到1 000∶1,治疗组小鼠肿瘤体积明显缩小。此后,其他研究者利用静脉、腹腔及瘤体注射也得到了相似结果[9]。这说明减毒沙门菌可靶向肿瘤组织并能够抑制肿瘤细胞生长,有望成为抗癌治疗中新型载体。
本研究结果显示,SL7207在肿瘤组织中分布随时间推移逐渐增多,到21 d肿瘤组织内细菌数量较其他组织明显增多,这提示减毒沙门菌载体SL7207可以远距离优先选择性聚集到肿瘤组织。通过对其携带基因及其表达蛋白的组织定位分析也证实SL7207/pBud-VP3-IL-24在肿瘤组织表达要高于其他组织。对于其靶向性的解释,笔者认为主要与作为厌氧菌的减毒沙门菌生物学特性及肿瘤组织的特殊环境有关。PAWELEK等[8]认为采用营养缺陷型菌株所需物质如芳香族氨基酸等在正常细胞中含量极少,不足以满足细菌生长的营养需要;而在细胞不断分裂的肿瘤“坏死区”处于相对乏氧的微环境,肿瘤细胞代谢旺盛,有大量中间产物可供细菌利用,能为厌氧菌的定植和繁殖提供条件。而其他研究者认为,肿瘤组织内不规则的血管和肿瘤组织间隙内的高压能阻止粒细胞、抗体和补体等免疫成分随血流进入肿瘤组织,故沙门菌从肿瘤组织被清除的效率和速度比正常组织低,因此能在该环境中定植生存[10]。此外,肿瘤组织内也有可能存在某些黏附分子,导致细菌对肿瘤细胞有趋向性。
在本研究中,发现除了肿瘤组织外,其他重要脏器,例如胃、脾、肝,也有减毒沙门菌聚集生长,这主要与给药方式和机体对减毒菌免疫反应有关。具有侵袭力的减毒沙门菌经口服途径饲喂后,可通过胃肠黏膜上皮途径侵入宿主细胞[11]。动物胃肠道黏膜表面派伊尔结的滤泡上皮细胞中分布着微皱褶细胞(M细胞),被肠上皮细胞紧紧包围,通过口服的具有侵袭力的沙门菌在胃肠道能增殖侵袭M细胞并破坏M 细胞进入皮下组织,也可通过包围M细胞进入皮下组织,从而在本研究中观察到胃肠组织有沙门菌的存在。此外,派伊尔结淋巴细胞激活活化后,开始分化,并向肝、脾脏等淋巴组织迁移[12],所以重要免疫脏器也有细菌及其携带蛋白的分布。
本研究对免疫细胞在肿瘤非特异性免疫调节中作用进行探讨,结果显示,SL7207/pBud-VP3-IL-24可激活淋巴细胞和巨噬细胞活性,显著增强NK细胞对肿瘤细胞的杀伤作用来发挥抗肿瘤免疫作用。有研究发现,沙门菌通过感染肿瘤细胞,可以充当天然的免疫佐剂,菌体脂多糖成分能够激活宿主免疫系统,刺激炎症介质释放、激活淋巴细胞而增强全身或局部免疫[13-14]。另外,作为目前为止发现的唯一细胞因子类抑癌基因,IL-24也发挥重要免疫调节功能。研究显示, IL-24免疫过的C3H系小鼠脾细胞增殖活性增强,CD3+CD8+T细胞数目明显增多,同时Thl细胞因子的表达水平升高,从而促进免疫系统激活来发挥抗肿瘤免疫功能[15]。结合本次研究,SL7207/pBud-VP3-IL-24与SL7207/pBud比,前者有较强的刺激免疫细胞作用,故SL7207/pBud-VP3-IL-24对肿瘤免疫调节作用可能与沙门菌和IL-24联合作用的结果有关。
综上所述,SL7207/pBud-VP3-IL-24能够靶向胃癌组织,在肿瘤组织,优先表达其携带基因及蛋白,并能通过增强机体非特异性免疫功能来调节抗肿瘤免疫,这为进一步研究其抗肿瘤作用机制奠定了基础。为优化该生物制剂治疗肿瘤作用效果,将在后续研究中针对SL7207/pBud-VP3-IL-24作用途径,例如口服、静脉注射、瘤体注射等,进一步探讨。
