不同来源白念珠菌感染小鼠前后胞外水解酶活力差异
2018-07-31,,,,,,,,
, ,,, ,, ,,
白念珠菌(Candidaalbicans)是一种常见的机会性致病真菌,自然界广泛分布,为人、动物机体正常菌群的一部分[1-2]。白念珠菌作为共生菌定植在口腔、胃肠道和泌尿生殖道等,因机体免疫力下降致侵袭性白念珠菌感染[3],是血液、肿瘤和ICU病房患者死亡原因之一[4-5]。分泌水解酶作为致病因素之一[6-7],可促使白念珠菌感染宿主并渗透宿主组织[8]。
白念珠菌分泌的水解酶中,分泌型天冬氨酸蛋白酶(secreted aspartyl proteinase,SAP)、磷脂酶(phospholipase,PL)、脂肪酶(lipase,Lip)与白念珠菌致病性关系密切,在逃避宿主免疫系统和药物作用中起关键作用[9-10]。分泌型天冬氨酸蛋白酶具有较高的蛋白水解活性,能水解多种宿主底物,导致宿主细胞损伤[11];磷脂酶能够分别作用于甘油磷脂分子中不同的酯键,使甘油磷脂水解形成溶血磷脂,是血源性感染的重要毒力因子[10];脂肪酶够催化甘油单酯,还能与其他酶协同作用,使白念珠菌逃匿宿主免疫系统[12]。研究表明,上述3种酶在宿主不同解剖部位及不同感染阶段呈差异性表达[13]。目前该3种酶在不同来源菌株间的体外表达差异与致病性的关系已经有了较为详细的研究,但此3种酶在感染宿主前、后表达的研究却较少。
白念珠菌的致病能力与宿主的相互作用密切相关[14],前期研究中,我们收集了临床艾滋病、外阴阴道念珠病等患者的白念珠菌临床分离株与健康人来源的菌株,比较受感染小鼠致死率和不同来源菌株分泌型天冬氨酸蛋白酶、磷脂酶和脂肪酶3 种致病相关分泌型水解酶体外表达水平差异。研究中,我们发现不同来源菌株产生水解酶能力即使没有差异,也能在感染小鼠后引起小鼠差异性死亡。有研究表明,白念珠菌水解酶在宿主不同解剖部位和不同感染阶段会呈现差异性表达[2]。大量研究表明,肾脏是白念珠菌系统性感染小鼠过程中最主要的靶器官,同时小鼠肾脏因白念珠菌感染引起的炎症,积水,脓肿等因素是引起小鼠死亡的决定性因素[15]。因此,我们进一步收集死亡小鼠白念珠菌肾脏分离的白念珠菌菌株,比较菌株注入小鼠体内前后这3种致病相关分泌型胞外水解酶的表达水平,探讨白念珠菌的这3种胞外水解酶在宿主中的表达差异。
1 材 料
1.1仪器与试剂 37 ℃恒温培养箱、超净工作台(上海,SW-CJ-IF)、紫外分光光度计(美国,DU640型)、三丁酸甘油酯平板琼脂基础、三丁酸甘油酯购自青岛日水生物公司;50%卵黄乳液购自青岛海博生物公司; 牛血清白蛋白、酵母碳源基础(YCB)、购自北京索莱宝科技有限公司。
1.2培养基配制 实验中用到的牛血清白蛋白培养基、卵黄琼脂平板培养基、三丁酸甘油酯培养基参照文献[16-18]的方法进行配制。
2 方 法
2.1 构建白念珠菌小鼠感染模型
2.1.1感染小鼠所用菌株 2009年6月至2010年9月从贵州5家省级及专科医院收集独立的深部感染及外阴阴道念珠病病患来源的临床白念珠菌,按照文献[19]中的方法鉴定,健康人来源白念珠菌为中科院微生物研究所白逢彦老师惠赠。按照本文中方法2.2及2.3检测3种水解酶活力差异,从中选取水解酶活力一致的4株临床分离株,2株健康人来源的白念珠菌,具体情况见表1。第5 d为3种酶活力的最佳培养时间,胞外水解酶阳性的菌株在达到最佳培养时间以后,随着培养时间的延长,圈层会逐渐增大,相互重叠而无法测量,而胞外水解酶阴性的菌株即使达到这个时间点,也没有水解圈产生,Pz值仍为1,文中以第10 d为过期时间,作为对照。
表1 感染小鼠所用菌株来源、三种水解酶活力及感染小鼠数量情况
Tab.1 Sources of C. albicans used to infect mice, three extracellular hydrolytic enzyme activities of these strains and the amount of the mice infected
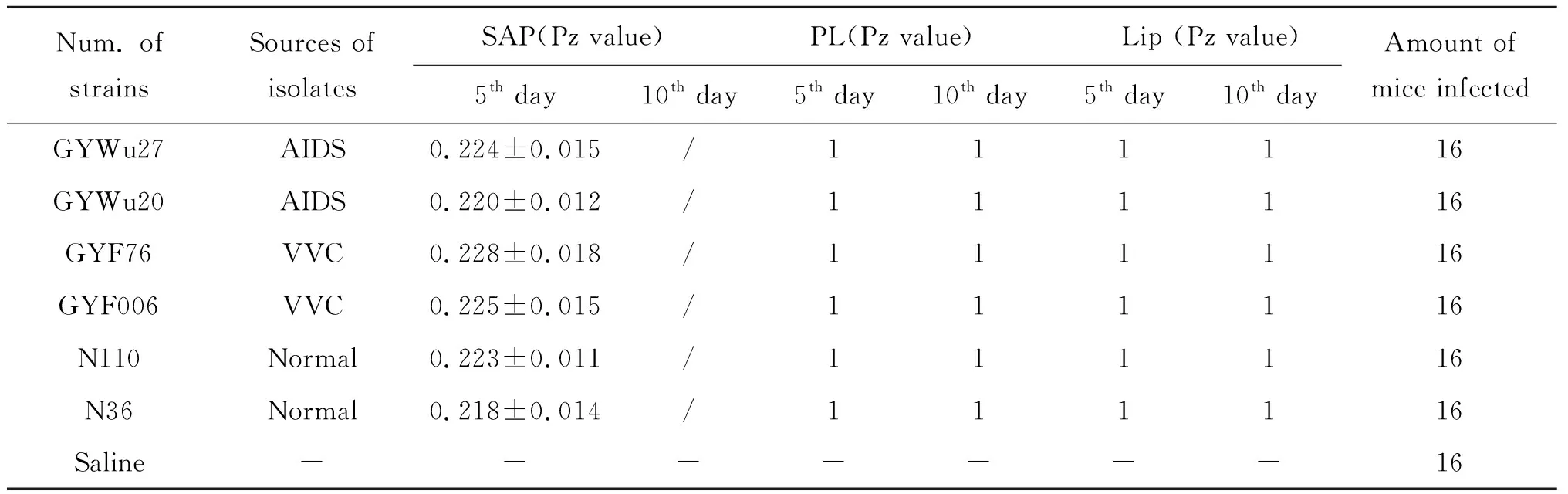
Num. of strainsSources of isolatesSAP(Pz value)PL(Pz value)Lip (Pz value)5th day10th day5th day10th day5th day10th dayAmount of mice infectedGYWu27AIDS0.224±0.015/111116GYWu20AIDS0.220±0.012/111116GYF76VVC0.228±0.018/111116GYF006VVC0.225±0.015/111116N110Normal0.223±0.011/111116N36Normal0.218±0.014/111116Saline-------16
注:SAP:分泌型天冬氨酸蛋白酶; PL:磷脂酶; Lip:脂肪酶Pz值=菌落直径 /(菌落直径+圈层直径)。Pz值=1,表示没有水解环。
-表示阴性对照; 表示圈层过大相互重叠,无法测量
第5 d为三种酶活力的最佳培养时间,第10 d为过期培养时间。
2.1.2感染小鼠 各菌株均使用原代保存菌种解冻后传于PDA培养基上,37 ℃培养48 h,挑取白念珠菌菌落于生理盐水中稀释成浓度为2×106CFU的菌液。尾静脉注射建立系统性念珠菌感染小鼠模型。将配制好的菌液及无菌生理盐水通过尾静脉注射入小鼠体内,每只注射0.2 mL,实验小鼠正常饲养,饲料充足,饮水定时更换,对小鼠生存情况进行记录,采用Kaplan-Meier法估计各组各时点的生存率及其标准误,绘制生存曲线,并采用log-rank检验进行生存曲线比较。
对发病死亡小鼠进行解剖,无菌分离双侧肾脏,迅速取双肾,去除肾包膜,用冷生理盐水灌洗,加入1 mL含有0.05%氯霉素的PBS缓冲液用组织细胞破碎仪匀浆。组织匀浆后,按(1∶50-1∶500)的比例用含0.05%氯霉素的PBS缓冲液稀释, 吸取100 mL稀释液接种到含0.05%氯霉素SAB琼脂平板中,37 ℃培养24~48 h后,并按照文献[19]中的方法鉴定后保存于-80 ℃冰箱备用。
2.2 胞外水解酶检测实验
2.2.1菌悬液制备 挑选小鼠双肾分离白念珠菌以及感染小鼠所用的菌株作为实验菌株,通过YPD固体培养基进行复苏,37 ℃培养48 h,用无菌生理盐水配制为5×106CFU/mL菌悬液。
2.2.2胞外水解酶活力检测 因分泌型天冬氨酸蛋白酶、磷脂酶和脂肪酶3种酶水解对象不同[2],可利用不同底物培养基分别检测酶活性,小鼠肾脏分离菌株均接种至牛血清白蛋白培养基(检测分泌型天冬氨酸蛋白酶)、卵黄培养基(检测磷脂酶)、三丁酸甘油酯培养基(检测脂肪酶),置于37 ℃恒温培养箱培养,并设置3次生物重复。
2.3酶活力检测指标 3种培养基达到最佳培养时间,平板上菌落周围会出现沉淀圈或透明圈,测量菌落直径和菌落加圈层的总直径[9]。以 Pz值表示水解酶的表达水平。Pz值=菌落直径 /(菌落直径+圈层直径)。Pz值越大,水解酶产生越少。Pz值≤0.59,水解酶高表达(+++);Pz值为 0.60~0.79,水解酶中等表达(++);Pz值为 0.80~<1.00,水解酶低表达(+);Pz值=1 表示不产此水解酶(-)。通过方差分析对结果进行统计学分析。
3 结 果
3.1小鼠发病情况 注射白念珠菌4 d后艾滋病、外阴阴道念珠病病患来源和健康人来源白念珠菌感染小鼠陆续开始发病,初始表现为饮食减少,嗜睡,皮肤粘膜发紫,动力下降,大小便不尽,接着出现呼吸急促,抽搐,最后死亡。
3.2绘制生存曲线 采用Kaplan-Meier法绘制生存曲线(图1),并采用log-rank检验显示各组曲线间具有统计学差异(χ2=8.25,P<0.05)。各组间在7 d内小鼠死亡率并无差异,之后各组间差异逐渐显著,于感染后第21 d达到高峰,艾滋病病患来源组死亡小鼠20只(死亡率62.5%),外阴阴道念珠病病患来源组死亡小鼠16只(死亡率50.0%),外阴阴道念珠病病患来源组小鼠12只(死亡率37.5%)。总体而言,小鼠死亡速率最快的是艾滋病病患来源组,其他依次为外阴阴道念珠病病患来源组和健康人来源组。
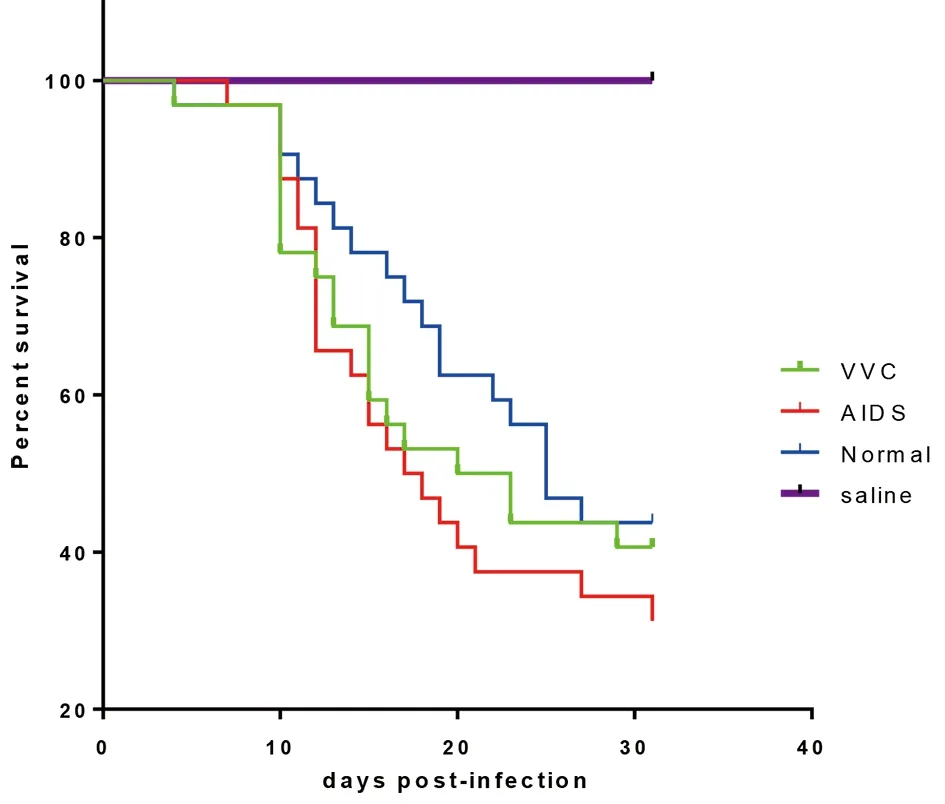
图1 不同来源白念珠菌感染的小鼠生存曲线Fig.1 Survival curves of mice infected by C. albicans from different sources
3.3不同来源白念珠菌感染的小鼠肾脏分离株 3种胞外水解酶体外表达水平 结果如图2,感染小鼠前,体外培养第5 d,6株3种不同来源白念珠菌磷脂酶与脂肪酶活力均为阴性(Pz=1,-),分泌型天冬氨酸蛋白酶活力均为阳性且高表达(Pz<0.59,+++),艾滋病、外阴阴道念珠病、健康人来源白念珠菌的3种酶活力无统计学差异(F=7.53,P>0.05)。
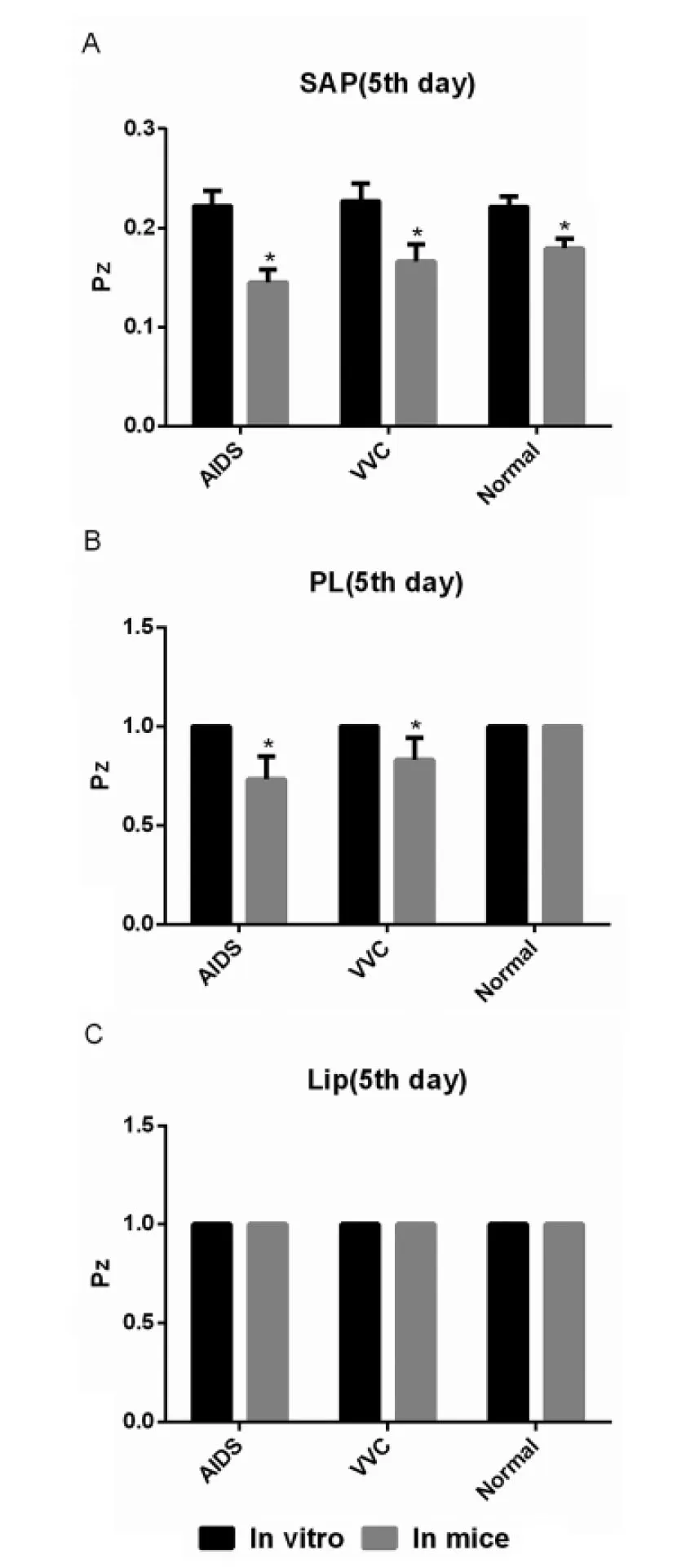
注:SAP:分泌型天冬氨酸蛋白酶; PL:磷脂酶; Lip:脂肪酶
图2 不同来源白念珠菌感染小鼠前后3种胞外水解酶Pz值差异比较
Fig.2 Comparison of the activity of three extracellular hydrolytic enzymes produced by C. albicans in vitro and in mice
如图2A,21株艾滋病病患来源、18株外阴阴道念珠病病患来源、18株健康人来源白念珠菌感染小鼠后,体外培养第5 d,小鼠肾脏分离株分泌型天冬氨酸蛋白酶活力皆为阳性且高表达(Pz<0.59,+++)。分泌型天冬氨酸蛋白酶表达水平皆显著高于感染小鼠前,分泌型天冬氨酸蛋白酶表达升高程度在不同来源菌株间有统计学差异(F=4.96,P<0.05),从高到低依次为艾滋病、外阴阴道念珠病、健康人来源白念珠菌。
如图2B,体外培养第5 d,21株艾滋病病患来源白念珠菌小鼠肾脏分离株中,19株(95%)为磷脂酶活力阳性;18株外阴阴道念珠病病患来源白念珠菌小鼠肾脏分离株中,14株(77.8%)为磷脂酶活力阳性;18株健康人来源白念珠菌小鼠肾脏分离株未检测到磷脂酶活力。艾滋病、外阴阴道念珠病病患来源菌株感染小鼠前后磷脂酶表达有统计学差异(F=7.89,P<0.05),但艾滋病、外阴阴道念珠病病患来源菌株间无统计学差异(F=2.54,P>0.05),健康人来源菌株感染小鼠前后磷脂酶活力皆为阴性。
如图2C,体外培养第5 d,21株艾滋病病患来源小鼠肾脏分离株、18株外阴阴道念珠病病患来源小鼠肾脏分离株、18株健康人来源小鼠肾脏分离株脂肪酶活力也皆为阴性,Pz值为1。
体外培养第10 d时,在第5 d检测为胞外水解酶阳性的菌株,因圈层相互重叠,无法测量;而第5 d检测为胞外水解酶阴性的菌株仍为阴性。
4 讨 论
白念珠菌是常见的机会性致病真菌,但当宿主免疫力低下时,可导致严重感染。分泌型水解酶是其重要的毒力因子,其中分泌型天冬氨酸蛋白酶、磷脂酶和脂肪酶等能够介导白念珠菌入侵宿主组织以及逃避宿主抗真菌感染免疫,在白念珠菌致病中起了关键作用[2],这3种酶活力的检测方法早已有学者报道[16-18],并为其他学者广泛认同并采用,在本研究中也采用此类方法检测白念珠菌的水解酶活力。
本研究对艾滋病、外阴阴道念珠病病患来源和健康人来源的白念珠菌株感染小鼠前后,3种胞外水解酶活力差异进行比较。研究发现白念珠菌进入小鼠宿主后其分泌分泌型天冬氨酸蛋白酶的量较其在体外培养时有明显增多,提示在宿主体内时其分泌型天冬氨酸蛋白酶表达能力会随之增强。Staib[20]通过在系统性感染过程中发现不同的分泌型天冬氨酸蛋白酶等位基因会先后被激活,Kretschmar[21]通过建立小鼠的白念珠菌胃肠感染模型发现SAP4和SAP6 mRNA能在小鼠的胃中发现,且随着感染进程SAP4~6表达增加,说明分泌型天冬氨酸蛋白酶的表达取决于感染进程。实际上,白念珠菌感染小鼠的进程也是白念珠菌与小鼠相互作用的过程。本研究通过分离小鼠肾脏白念珠菌检测胞外水解酶活力的方法也证实了在小鼠肾脏中白念珠菌表达分泌型天冬氨酸蛋白酶的能力同样与小鼠宿主的作用有关,同时,在本实验中还发现艾滋病和外阴阴道念珠病病患来源的白念珠菌进入小鼠宿主后分泌磷脂酶的量较其在体外培养时也有明显增多,不难推测艾滋病和外阴阴道念珠病病患来源的白念珠菌磷脂酶在宿主体内时其表达能力也有所增强。综合本研究内容以及其他国内外学者的研究结果,我们推测可能是宿主相关环境因子和白念珠菌内源基因的相互作用对白念珠菌分泌型天冬氨酸蛋白酶、磷脂酶的表达起了重要作用,而具体的宿主相关环境因子尚需后续的研究进一步探讨。
分泌型天冬氨酸蛋白酶检测实验中,3种不同来源的白念珠菌在感染小鼠后,其分泌型天冬氨酸蛋白酶的活力是有差异的,艾滋病来源的最强,然后依次为外阴阴道念珠病和健康人来源。同时在磷脂酶检测的实验中,发现未能表达磷脂酶的3种不同来源的菌株在感染小鼠宿主后,艾滋病和外阴阴道念珠病病患来源菌株能够表达磷脂酶,而健康人来源的菌株仍为磷脂酶活力阴性。推测白念珠菌在不同的宿主环境状态下,其分泌型天冬氨酸蛋白酶和磷脂酶的潜在表达能力是有差异的,即宿主的免疫状态越弱或者菌群失调时,白念珠菌对分泌型天冬氨酸蛋白酶和磷脂酶的潜在表达能力越强。事实上,这与白念珠菌的条件致病性是一致的,在健康人体内白念珠菌作为正常菌群与宿主共生,而在宿主免疫状态减弱或菌群失调时,白念珠菌则会大量表达胞外水解酶作为其致病因子之一,转变为致病性真菌。
有研究表明白念珠菌对环境具有高度的适应能力[22],白念珠菌所处的环境会影响其代谢,与此同时,白念珠菌可以通过调整代谢过程来适应多变的环境。在不同的宿主环境下,白念珠菌体现出不同的适应性,例如,在共生状态下白念珠菌的适应性表现为病原相关分子模式 (pathogen-associated molecular patterns, PAMPSs)与宿主细胞表面的模式识别受体(pattern recognition receptors, PRRs)的相互作用,免疫防护机制,宿主体内的菌群平衡,以及微环境中代谢物的影响等[22]。而在致病状态下,白念珠菌为适应致病环境侵袭宿主则体现在对宿主细胞黏附性的改变、形态转换和分泌水解酶等[23]。结合本研究分析,正因为在共生状态与致病状态下,白念珠菌的适应性有区别,所以不同来源的白念珠菌在感染小鼠后,表达胞外水解酶的能力会有所不同,病患来源的白念珠菌在小鼠宿主体内表达分泌型天冬氨酸蛋白酶、磷脂酶的能力更强,而健康人来源的白念珠菌则相对较弱。同时,白念珠菌对于不同胞外水解酶的表达能力也有差异,事实上,白念珠菌进入小鼠血液后,为适应新的宿主环境,需要分泌具有较高蛋白水解活力的分泌型天冬氨酸蛋白酶[24], 降解黏膜表面的多种保护分子为白念珠菌生长提供营养,并增加其黏附和侵入能力,以便其到达最适宜生长的环境中,分泌型天冬氨酸蛋白酶还可裂解宿主固有免疫应答的多种因子 (如补体、上皮防御蛋白、唾液乳铁蛋白、乳过氧化物酶、组织蛋白酶等),便于白念珠菌免疫逃避[25]。同时白念珠菌分泌的磷脂酶能分别作用于甘油磷脂分子中不同的酯键,使甘油磷脂水解形成溶血磷脂,引起细胞损伤从而促进白念珠菌在体内的入侵、存活和致病,还可逃避宿主免疫防御机制[26]。脂肪酶的主要用为获取营养消化脂类[27],有研究显示,脂肪酶的表达谱取决于感染的组织类型[28]。Lip4~8几乎在所有感染的盲肠组织和黏膜组织(胃、上颚、食道和舌头)中表达;而Lip 1、Lip 3和Lip9仅在感染的胃组织中表达,在口腔组织不表达;Lip 2在感染盲肠组织中表达,但在口腔组织不表达。不难发现,脂肪酶所能表达的组织类型主要为脂质丰富的组织,而白念珠菌最终所处的靶器官小鼠肾环境中脂类相对缺乏[29],因此,在实验中未检测到脂肪酶活力也是可以理解的。
本实验为该类白念珠菌胞外水解酶检测的研究提供了补充,同时也丰富了白念珠菌宿主环境适应性的认识,将为进一步揭示致病菌与宿主相互作用的机理提供一定的依据。随着白念珠菌其他毒力因子以及其与细菌、细胞等相互作用研究的深入,本研究的发现将对白念珠菌相关的临床疾病的防治等研究提供一些有意义的线索。
