干燥方式对艾叶品质的影响*
2018-07-31王小婷毛梦然万定荣
蒲 锐,王小婷,武 娟,毛梦然,万定荣
(中南民族大学药学院,湖北 武汉 430074)
艾叶为菊科植物艾 Artemisia argyi Levl.et Van.的干燥叶,为我国传统中药,也是艾灸疗法的原材料。其味辛、苦,性温,有散寒止痛、温经止血功效[1]。现代研究表明,艾叶主要含有挥发油、黄酮类、鞣质,同时也含有三萜类、多糖等有效成分[2-4],有抗炎、抗菌、抗病毒、抗氧化等药理作用[5-10]。艾叶的有效物质含量与其药用功效直接相关,不同干燥方式可能对其有效物质含量有显著影响。本研究中以艾叶主要有效物质挥发油、黄酮类、鞣质的含量为指标,并辅以高效液相色谱(HPLC)指纹图谱法进行比较研究,考察常用干燥方式对艾叶质量的影响,以提供最佳干燥方式,保障艾叶商品或其产品的品质,保证其临床应用的有效性。现报道如下。
1 仪器与试药
1.1 仪器
UltiMate 3000型高效液相色谱仪(含二极管阵列检测器,Chromeleon色谱工作站,美国戴安公司);BDS Hypersil C18色谱柱(250 mm ×4.6 mm,5 μm,赛默飞世尔科技<中国>有限公司);UV-1800PC型紫外-可见分光光度计(上海美谱达仪器有限公司);AB256-S型十万分之一电子分析天平(梅特勒-托利多<上海>有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);HH-4型水浴锅(金坛市科兴仪器厂);挥发油提取器(武汉杰恒达工贸有限公司);98-1-B型电子调温电热套(天津市泰斯特仪器有限公司)。
1.2 试药
芹菜素对照品(批号为111901-201603,纯度为99.2%),没食子酸对照品(批号为110831-201605,纯度为90.8%),均购自中国食品药品检定研究院;乙腈(色谱纯,美国天地有限公司);甲醇(分析纯,国药集团化学试剂有限公司);水为超纯水;其他试剂(国药集团化学试剂有限公司)均为分析纯。艾叶样品共6批,来源于湖北蕲春5批,武汉郊区1批,经中南民族大学药学院万定荣教授鉴定,均为菊科植物艾 Artemisia argyi Levl.et Van.及其干燥叶。样品采收期均为2016年5月27日,每批样品采集后分室外太阳暴晒或室内阴干2种方式干燥,共获得12份试验样品。
2 方法与结果
2.1 挥发油含量测定
供试品制备:用四分法取适量样品,剪碎(直径1~2 mm,下同),充分混匀,装入洁净的样品袋中,即得。
样品含量测定:取各剪碎样品约40 g,精密称定,参照2015年版《中国药典(四部)》通则2204“挥发油测定法”进行测定,其中烧瓶加水600 mL。测定结果见表1。

表1 6批12份晒干及阴干艾叶样品含量测定结果
2.2 总黄酮含量测定
溶液制备:取各剪碎样品约1 g,精密称定,置100 mL圆底烧瓶中,精密加入70%甲醇溶液50 mL,称定质量,85℃水浴回流1 h,放冷,用70%甲醇补足减失的质量,摇匀,滤过,精密量取续滤液5 mL,置25 mL容量瓶中,加70%甲醇至刻度,摇匀,即得供试品溶液;取芹菜素对照品10.05 mg,精密称定,置100 mL容量瓶中,加70%甲醇适量使溶解,并定容至刻度,即得对照品溶液。
标准曲线绘制:精密量取对照品溶液0.15,0.40,0.80,1.60,2.40,3.20,4.00 mL,分别置 25 mL 容量瓶中,加70%甲醇稀释至刻度,摇匀,以70%甲醇为空白,照紫外-可见分光光度法,在338 nm波长处分别测定吸光度(A)。以吸光度(Y)为纵坐标、芹菜素质量浓度(X,μg/mL)为横坐标绘制标准曲线,得回归方程Y=0.079 6X+0.008 8,r=0.999 7(n=7)。结果表明,芹菜素质量浓度在0.598 2~15.951 3 μg/mL范围内与吸光度线性关系良好。
测定方法学考察:测定方法通过本课题组试验确定,其供试品溶液的制备、测定波长、测定方法均参考文献[11]。方法学考察结果表明,该方法精密度、重复性及加样回收率均符合含量测定要求,表明供试品溶液在24 h内稳定。
样品含量测定:取上述6批分别经暴晒和阴干的艾叶样品共12份,剪碎,各取约1 g,精密称定,依法制备供试品溶液并进行测定。每份样品各制成2份供试品溶液,取测定平均值作为含量测定结果。结果见表1。
2.3 鞣质含量测定
溶液制备:取各剪碎样品约2 g,精密称定,置250 mL棕色容量瓶中,加水150 mL,放置过夜,超声处理10 min,放冷,用水稀释至刻度,摇匀,静置,滤过,弃初滤液50mL,精密量取续滤液20 mL,置100 mL棕色容量瓶中,用水稀释至刻度,摇匀,即得供试品溶液。取没食子酸对照品50 mg,精密称定,置100 mL棕色容量瓶中,加水溶解并稀释至刻度,精密量取5 mL,置50 mL棕色容量瓶中,用水稀释至刻度,摇匀,即得对照品溶液。
标准曲线绘制:精密量取对照品溶液0.5,1.0,2.0,3.0,4.0,5.0 mL,分别置 25 mL 棕色容量瓶中,各加入磷钼钨酸试液1 mL,再分别加水11.5,11.0,10.0,9.0,8.0,7.0 mL,用 29% 碳酸钠溶液稀释至刻度,摇匀,放置30 min,以相应的试剂为空白溶液,照紫外-可见分光光度法,在760 nm波长处测定吸光度,以吸光度(Y)为纵坐标、没食子酸的质量浓度(X,μg/mL)为横坐标绘制标准曲线,得回归方程 Y=0.125 6X+0.038 7,r=0.999 8(n=6)。结果表明,没食子酸质量浓度在0.908~9.080 μg/mL范围内与吸光度线性关系良好。
测定方法:参照2015年版《中国药典(四部)》通则2202项下方法进行测定。
样品含量测定:取上述6批分别经暴晒和阴干的艾叶样品共12份,剪碎,各取约2 g,精密称定,依法制备供试品溶液并进行测定。每份样品各制成2份供试品溶液,取测定平均值作为含量测定结果,详见表1。
2.4 含量测定结果分析
由表1(均按干燥品计)可见,6批阴干艾叶样品的挥发油、总黄酮和鞣质含量均显著高于另6批相同产地环境的晒干样品。其中,6批阴干艾叶样品的挥发油、总黄酮和鞣质的含量范围分别为0.95%~1.25%,2.03% ~6.93%,1.18% ~3.82%;相同产地与环境的6批晒干艾叶样品的挥发油、总黄酮和鞣质的含量范围分别为0.76% ~0.90%,0.93% ~5.67%,0.52% ~2.87%。6批阴干艾叶的挥发油、总黄酮和鞣质含量的平均值比晒干艾叶分别高25.3%,31.1%和39.9%。晒干样品中,有1批总黄酮的含量还达不到艾叶国际标准(ISO 20759)对总黄酮的低限要求(不应低于1.10%)[12]。
2.5 样品HPLC指纹图谱的初步比较
色谱条件:色谱柱为BDS Hypersil C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.2% 磷酸溶液(B),梯度洗脱(A:0 ~15 min、10%→20%,15~30 min、20%→25%,30~40 min、25%→35%,40~45 min、35%→36% ,45~55 min、36% →65% ,55~60 min、65% →97%);流速为0.8 mL/min;检测波长为338 nm;柱温为 30℃;进样量为10 μL。
供试品溶液制备:取剪碎的各艾叶样品约1 g,精密称定,置100 mL圆底烧瓶中,加入70%甲醇溶液50 mL,称定质量,85℃水浴回流1 h,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过。精密量取续滤液5 mL,置25 mL容量瓶中,加70%甲醇至刻度,摇匀,即得。
HPLC指纹图谱比较:对其中3批共6份阴干、晒干的样品经70%甲醇提取其主要含有黄酮类物质的供试品溶液,采用高效液相色谱仪对其进行初步HPLC指纹图谱研究,比较了阴干、晒干样品峰的种类、数目及峰面积。结果显示,所有同批晒干样品与阴干样品主要色谱峰的种类和数目均基本一致。但前者多数峰的峰面积显著低于后者,平均峰面积低于38.2%。图1以采于湖北李时珍医药集团的2份对应的晒干和阴干艾叶样品为例,显示出HPLC指纹图谱峰面积的显著差异。
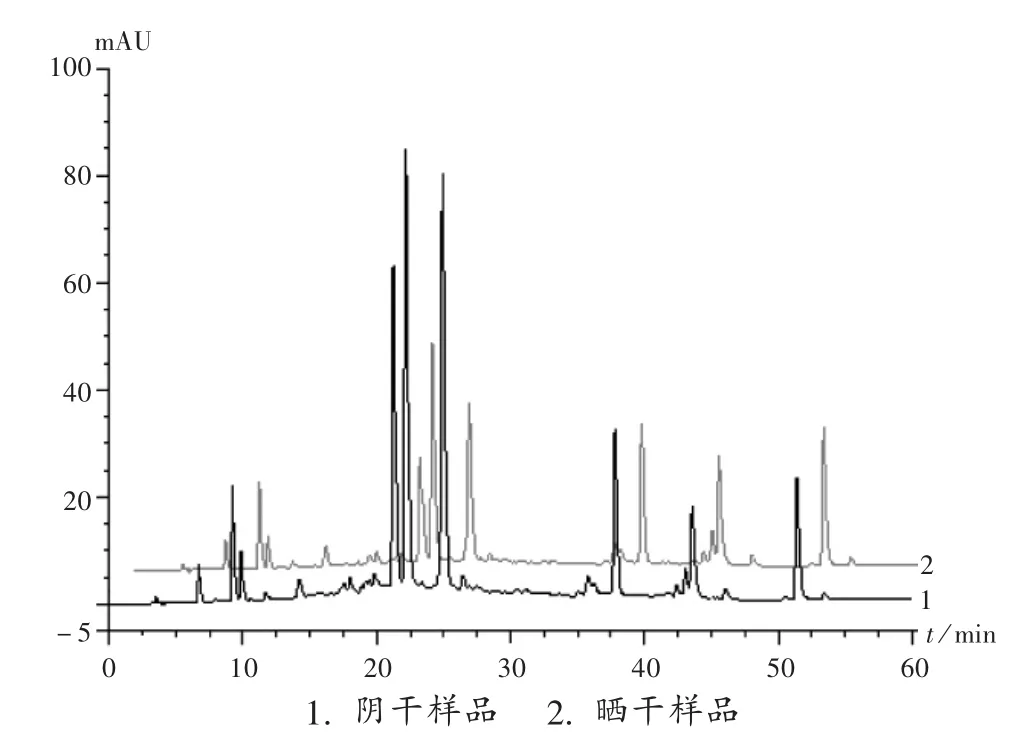
图1 艾叶样品高效液相色谱指纹图谱
3 讨论
研究结果表明,产于湖北的6批共12份艾叶样品中,阴干样品的有效物质挥发油、总黄酮、鞣质的含量均显著高于晒干样品。两类样品的甲醇提取液的HPLC色谱峰的总峰面积相比也有类似结果。表明艾叶样品在5月底采集后的短期内,由于干燥方式不同导致几类化学成分含量产生显著变化。药材挥发油含量可因暴晒而显著降低是普遍规律。总黄酮、鞣质含量因晒干而明显降低也有报道[13-16],而在艾叶中降幅更显著。
鉴于采取晒干的干燥方式会大幅度降低艾叶中挥发油、总黄酮和鞣质含量,为保证艾叶有效成分的高效利用,为临床提供高品质的艾叶,干燥方式应尽量采用自然阴干。建议艾叶产区在艾叶收获后采取搭棚或室内缓慢晾干的方式进行干燥,确保艾叶应用品质。
