α-氨基酸酯酰基转移酶表达纯化、酶学性质及其催化应用
2018-07-30刘鹏飞陆启蒙胡雪芹侯学文张洪斌
刘鹏飞,陆启蒙,胡雪芹,侯学文,张洪斌
α-氨基酸酯酰基转移酶表达纯化、酶学性质及其催化应用
刘鹏飞,陆启蒙,胡雪芹,侯学文,张洪斌
合肥工业大学 生物与医学工程学院,安徽 合肥 230009

金城. 2018酶工程专刊序言. 生物工程学报, 2018, 34(7): 1021−1023.Jin C. Preface for special issue on enzyme engineering (2018). Chin J Biotech, 2018, 34(7): 1021−1023.
α-氨基酸酯酰基转移酶(α-amino acid ester acyltransferase,AET) 能够催化底物L-丙氨酸甲酯盐酸盐、L-谷氨酰胺合成L-丙氨酰-L-谷氨酰胺 (L-alanyl-L-glutamine,丙谷二肽)。利用重组大肠杆菌saet-QC01表达 α-氨基酸酯酰基转移酶,对其表达条件进行了优化,通过Ni-NTA亲和层析法分离纯化重组蛋白,并对其酶学性质、催化应用进行了研究。适合酶表达的诱导条件:温度20 ℃,诱导阶段 (600=2.0−2.5),IPTG浓度0.6 mmol/L,诱导时间12 h。α-氨基酸酯酰基转移酶的最适反应温度27 ℃,最适pH 8.5,在pH 7.0−8.0很稳定,在酸性条件下相对稳定,低浓度的Co2+、低浓度的EDTA对酶活有促进作用。在底物浓度丙氨酸甲酯盐酸盐600 mmol/L、谷氨酰胺480 mmol/L,丙谷二肽的产量达到78.2 g/L,生产速率达到1.955 g/(L·min),转化率达到75.0%。α-氨基酸酯酰基转移酶具有良好的酸碱耐受性,催化效率高的优良特性,在工业生产中具有较好的应用潜力。
α-氨基酸酯酰基转移酶,丙谷二肽,表达条件,酶学性质,催化条件
谷氨酰胺 (Gln) 因为在机体的新陈代谢方面扮演着重要角色,近年来在预防和治疗某些疾病方面受到重要关注。谷氨酰胺虽然是非必需氨基酸,但在机体处于应激状态时,对维护肠道结构和免疫功能的完整性具有不可替代的作用;在机体受创、患败血症、化疗放疗中,自身合成的谷氨酰胺不能满足需求,使其成为一种条件必需氨基酸[1-2]。但谷氨酰胺水溶性差,单体在酸性条件下不稳定,在加热条件下易生成有毒的焦谷氨酸[3-4],限制了其在临床上的应用。而研究发现肽中谷氨酰胺的酰胺基比游离谷氨酰胺中的酰胺基要稳定[5],而且谷氨酰胺寡肽作为谷氨酰胺代用品具有突出的功效性和安全性。L-丙氨酰-L-谷氨酰胺 (L-alanyl-L-glutamine,丙谷二肽) 性质稳定、溶解度高[6-7],在体内数分钟即分解出谷氨酰胺,因其安全性和有效性[8]常作为注射液的主要营养组成成分用于术后患者的康复[9]。近年来,该肽受到国内外的密切关注。
目前,工业生产丙谷二肽的方法主要为化学法,但化学法反应步骤繁琐,路线较长,中间环节多,需要使用有毒的化学试剂,易生成副产物,后期分离纯化困难,合成条件苛刻,成本高昂[10-11],给工业生产带来诸多困难。
随着微生物技术在工业上的不断发展,利用微生物酶法合成丙谷二肽也成为研究热点。Tabata 等[12-16]发现在168中ywfE 基因编码一种L-氨基酸连接酶,该酶以游离氨基酸为底物合成二肽,可催化L-丙氨酸和L-谷氨酰胺合成丙谷二肽,副产物较少,但需要额外添加ATP,丙谷二肽的产率低且积累率低,而且L-氨基酸连接酶过表达对细菌生长带来负面影响。Yokozeki等[17]筛选到一株能合成α-氨基酸酯酰基转移酶 (EAET) 的短稳杆菌,该酶能以L-丙氨酸甲酯盐酸盐 (L-Ala-OMe·HCl) 和L-谷氨酰胺为底物高效合成丙谷二肽。Hirao等[18]从鞘氨醇杆菌里得到了活性更高的α-氨基酸酯酰基转移酶 (SAET),具有更高的合成丙谷二肽的能力。因此,文中利用重组大肠杆菌表达α-氨基酸酯酰基转移酶,并对其表达条件进行优化,通过Ni-NTA亲和层析法对粗酶液进行分离纯化,以L-丙氨酸甲酯盐酸盐和L-谷氨酰胺为底物在重组酶的作用下合成丙谷二肽,对其酶学性质进行研究并对催化条件进行系统优化,为工业生产丙谷二肽提供了理论基础,也为其他生产丙谷二肽的技术改进提供借鉴。
1 材料与方法
1.1 材料
丙谷二肽 (纯度>99%)、L-谷氨酰胺 (纯度>99%)、L-丙氨酸甲酯盐酸盐 (纯度>99%) 均由合肥川迪医药技术有限公司提供;其他试剂均为国产分析纯。
1.2 菌株
重组α-氨基酸酯酰基转移酶大肠杆菌saet-QC01为本实验室构建并保藏;本实验室将pET28a质粒与α-氨基酸酯酰基转移酶基因构建重组质粒pET28a-SAET,然后转化至BL21 (DE3) 感受态细胞中,成功筛选出构建成功的菌株,并将菌株命名为saet-QC01。
1.3 培养基
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0,(固体添加1.5%的琼脂粉)。
S培养基:甘油5 g/L,胰蛋白胨10 g/L,酵母提取物10 g/L,无水MgSO41 g/L,pH 6.3。
1.4 saet-QC01的初始培养条件
将重组α-氨基酸酯酰基转移酶大肠杆菌saet-QC01以1% (体积分数) 的接种量接种至20 mL含卡那霉素 (100 μg/mL) 的LB液体培养基中,37 ℃、250 r/min培养12 h,再按1% (体积分数) 接种量转接至50 mL含卡那霉素 (100 μg/mL) 的S液体培养基中,37 ℃、250 r/min培养至600=2.0 时添加异丙基-β-D-硫代半乳糖苷 (IPTG) 至终浓度为0.6 mmol/L,25 ℃、200 r/min诱导培养6 h,并在此基础上进行后续的表达条件优化。诱导结束后发酵液以8 000×离心15 min后去上清,保留菌体。
1.5 酶液制备与纯化
50 mL发酵液的离心后的菌体用10 mL的硼酸缓冲液 (pH 8.5) 重悬,超声破碎 (参数为破碎 2 s,间隔3 s,破碎时间15 min,破碎功率15 W),破碎结束后8 000×离心15 min,取上清液即为粗酶液。将粗酶液经镍柱纯化,纯化步骤经过装柱、平衡、上样、洗涤、洗脱,收集洗脱液。
1.6 酶活测定
取0.1 mL酶液,加入1 mL含200 mmol/L谷氨酰胺、200 mmol/L 丙氨酸甲酯盐酸盐的底物溶液(pH 8.5),混匀后在25 ℃恒温水浴锅中反应1 h,加入等体积1.7% (/) H3PO4溶液终止反应,经0.22 μm的滤头过滤后,按1.7所述测定丙谷二肽的浓度,一个酶活单位定义为1 mL底物在1 h内生成0.1 mg产物所需的酶量。
1.7 丙谷二肽检测
HPLC检测:采用高效液相色谱法检测丙谷二肽的浓度,色谱条件:色谱柱为TSKgel Amide-80 HR (4.6 mm×250 mm,5 μm);流动相为:0.05 mol/L KH2PO4(pH 4.0):乙腈=35∶65;流速为1 mL/min,检测波长214 nm。
1.8 表达条件优化
对不同的诱导条件进行优化,包括诱导温度 (15、20、25、30、35 ℃),诱导剂IPTG浓度 (0.2、0.4、0.6、0.8、1.0 mmol/L),诱导时间 (6、12、18、24、30 h) 和加入TPTG时的初始菌体浓度600(1.0、1.5、2.0、2.5、3.0)。
1.9 酶学性质
最适反应温度及热稳定性:在pH 8.5的硼酸缓冲液中,将酶液置于不同温度下 (23、25、27、29、31 ℃) 测定酶活,最高以100%计,计算相对活力。将酶液置于不同温度 (25、30、35、40、45、50 ℃)下处理30 min,在最适温度下测定相应的酶活,最高以100%计,计算相对活力,考察热稳定性。
最适反应pH及pH稳定性:将酶液置于不同pH缓冲液中于25 ℃测定酶活力,酶活最高以100%计,计算相对活力。将酶液置于各pH下,4 ℃孵育12 h,在25 ℃下测定相应的酶活,最高以100%计,计算相对活力,考察pH稳定性。
金属离子及化合物对酶活力的影响:用硼酸缓冲液 (pH 8.5) 配制100 mmol/L的MgCl2、CaCl2、MnSO4、CoCl2、NiCl2、FeCl3、SDS、EDTA溶液,稀释,使其在酶促反应中终浓度分别为1、5、10 mmol/L,测定酶活力,以未加入上述试剂的酶液为对照100%,计算相对酶活力。
2 结果与分析
2.1 α-氨基酸酯酰基转移酶的表达条件优化
saet-QC01作为α-氨基酸酯酰基转移酶的合成菌株,但其表达条件需要优化。首先,在15−35 ℃的温度范围内进行saet-QC01中蛋白的诱导,结果如图1所示,20 ℃诱导表达的酶活最高,20 ℃是最适合saet-QC01诱导的温度。诱导剂IPTG的浓度对酶的表达也产生影响,结果如图2所示,IPTG终浓度为0.6 mmol/L时,诱导表达的酶活最高。研究saet-QC01生长期对酶表达的影响,结果如图3所示,当初始菌体浓度600为2.0−2.5时酶活最高,结合saet-QC01生长曲线,此时在大肠杆菌的生长对数期的中期,表明当在大肠杆菌生长曲线的中期对数期时最适宜加IPTG诱导。诱导时间对酶活的影响不显著,如图4所示,但在诱导12 h时,酶活最高,随时间的延长,酶活有所降低,诱导时间12 h为宜。
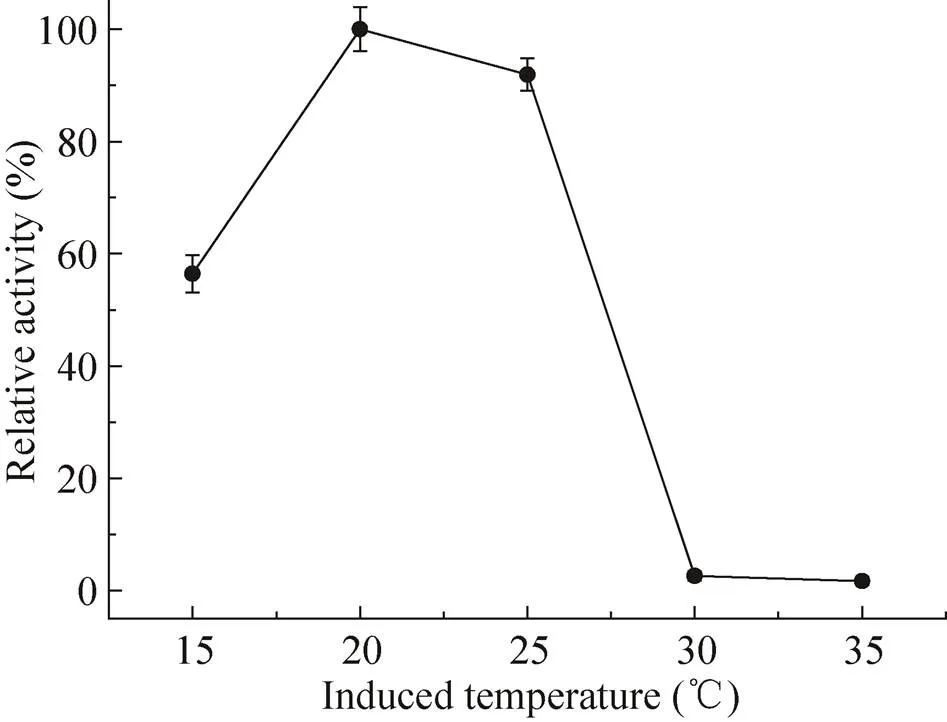
图1 诱导温度对SAET表达的影响
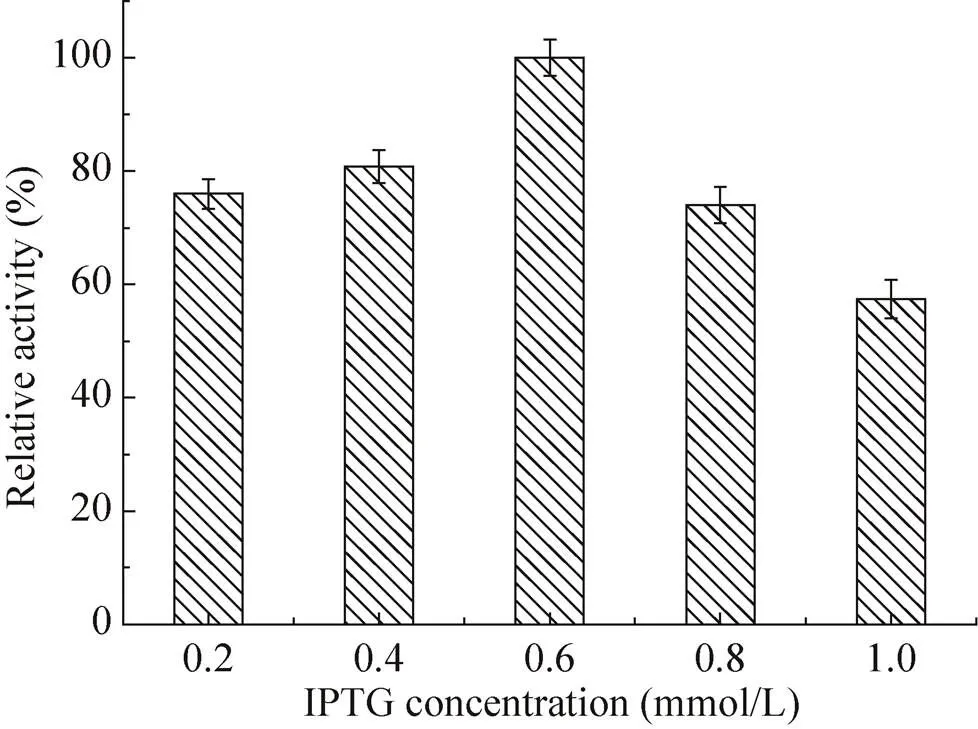
图2 IPTG浓度对SAET表达的影响
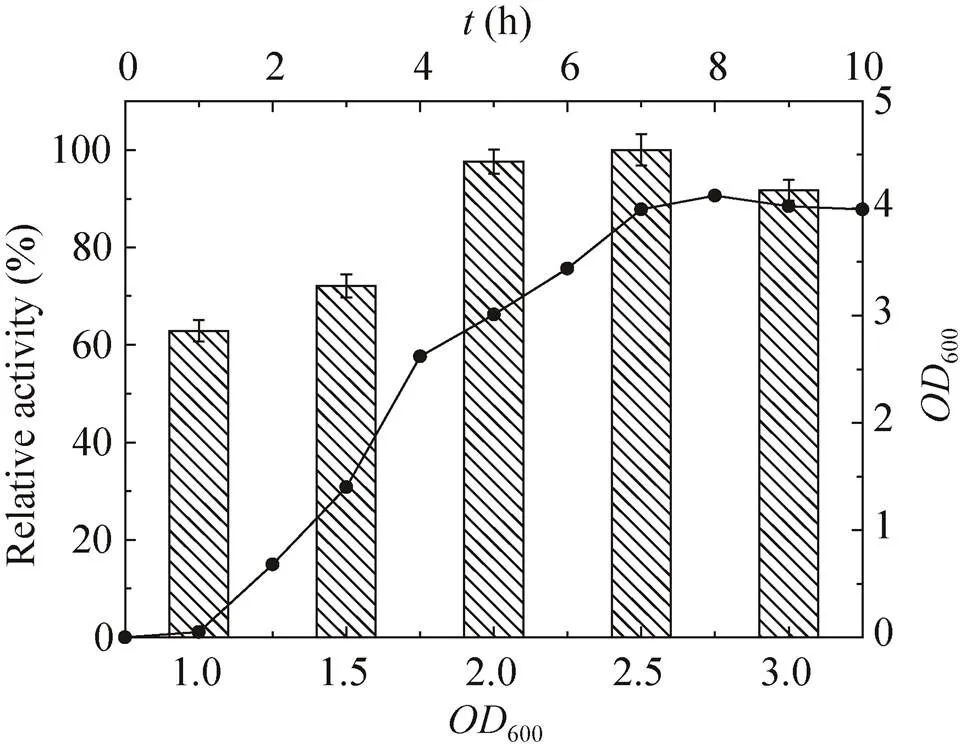
图3 OD600对SAET表达的影响

图4 诱导时间对SAET表达的影响
2.2 α-氨基酸酯酰基转移酶的酶学性质
将发酵后的菌体破碎后收集上清并进行SDS-PAGE,再经考马斯亮蓝染色,结果如图5所示,saet-QC01菌体破碎上清液中出现约68 kDa的条带,与文献报道α-氨基酸酯酰基转移酶经SDS-PAGE的分子量68 kDa一致[19],但阴性对照的pET28a空载的破碎上清液也出现68 kDa的条带,则不能证明该条带蛋白是由目的基因表达而来,所以将saet-QC01菌体破碎上清液采用Ni-NTA亲和层析方法分离纯化,经不同浓度的咪唑洗脱,收集洗脱液,经SDS-PAGE和考马斯亮蓝染色,如图6所示,在经80 mmol/L咪唑洗脱的洗脱液中出现分子量约为68 kDa的单一条带,说明该蛋白是由目的基因表达而来,与文献报道α-氨基酸酯酰基转移酶经SDS-PAGE的分子量68 kDa一致[19]。
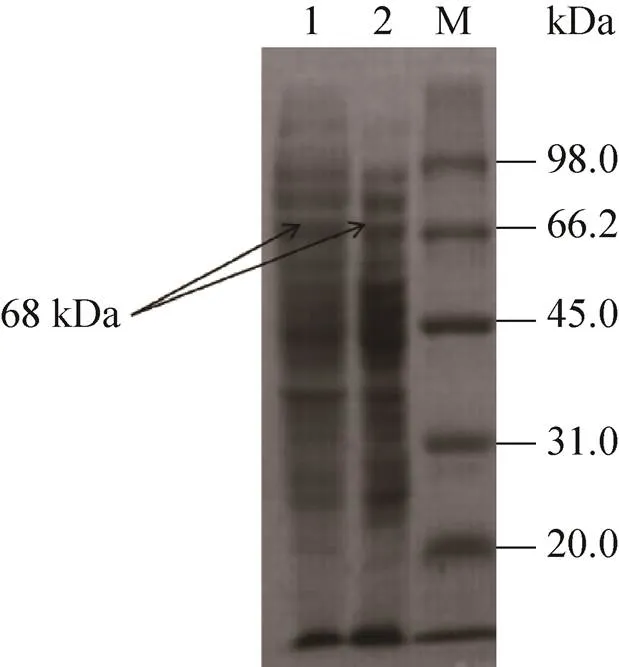
图5 重组α-氨基酸酯酰基转移酶SDS-PAGE分析
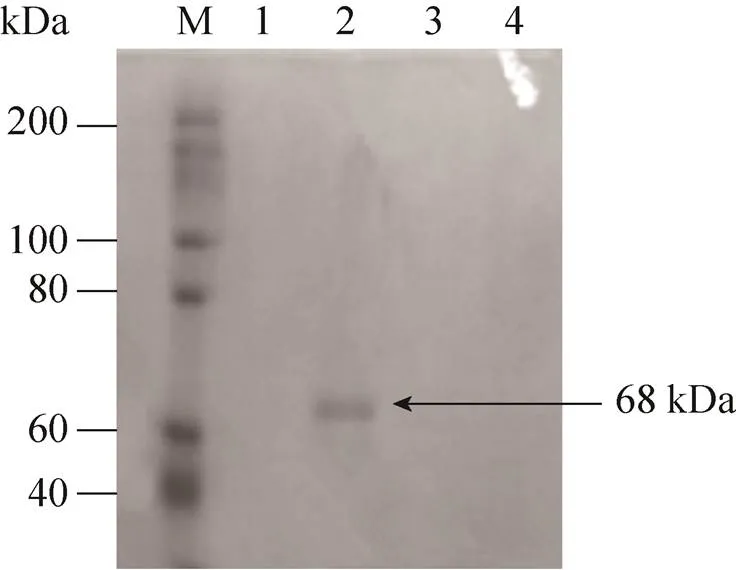
图6 纯化α-氨基酸酯酰基转移酶SDS-PAGE
考察最适反应温度对催化反应极为重要,由图7所示,α-氨基酸酯酰基转移酶的最佳催化温度为27 ℃。由图8所示,35 ℃处理30 min,酶活力保持在25 ℃时酶活的80%以上,45 ℃处理30 min后酶基本已经失活。上述结果表明,该酶的作用温度范围不是很广泛,对热也较为敏感,无法长时间放置在高温的过程中。
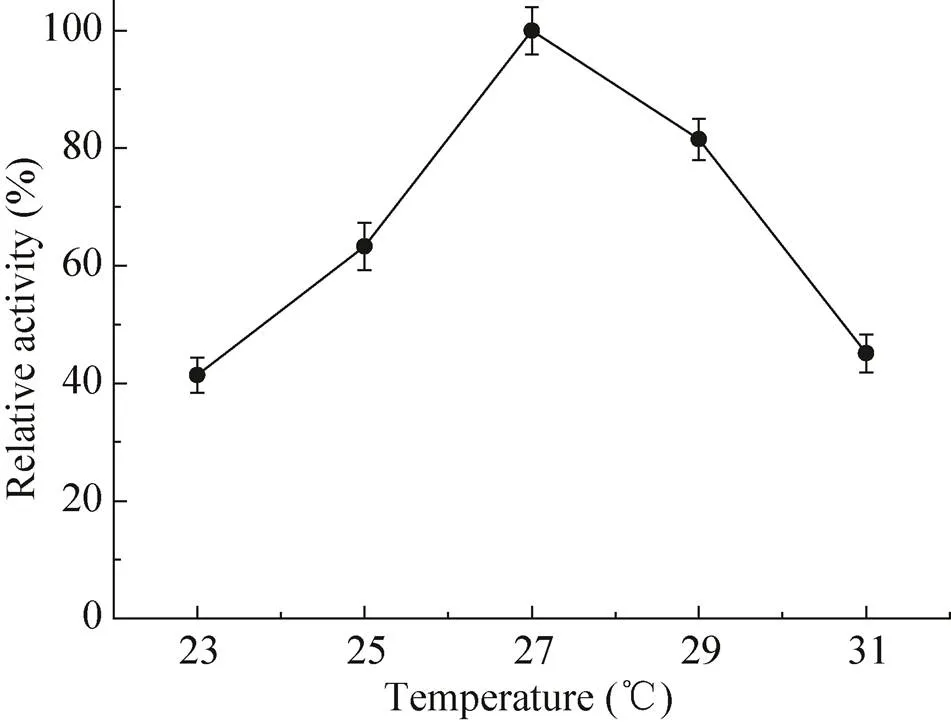
图7 温度对SAET活力的影响
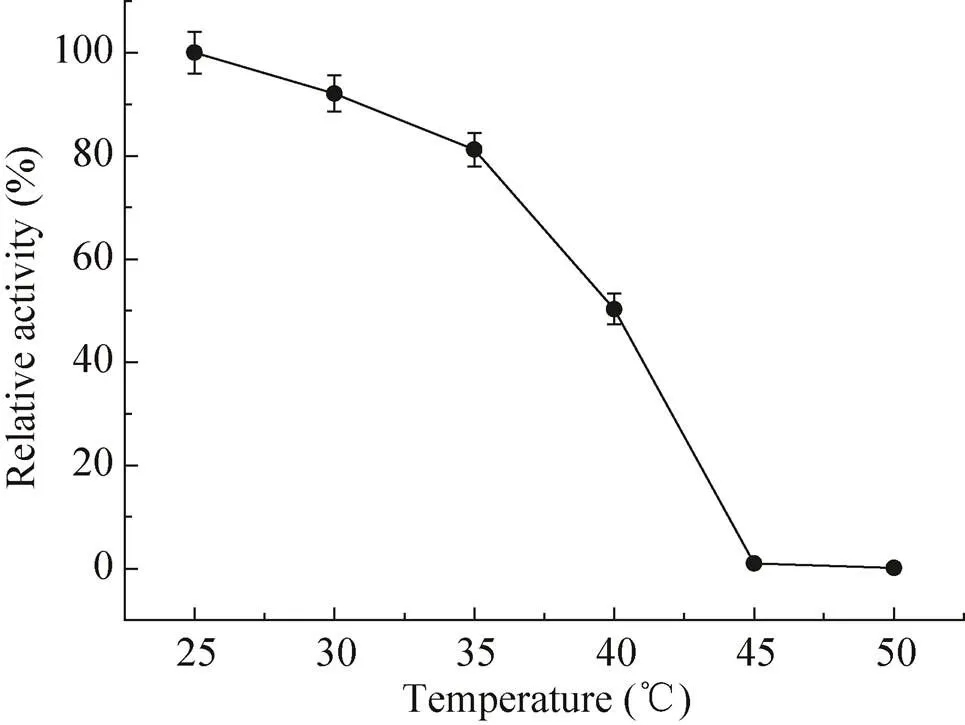
图8 温度对SAET稳定性的影响
反应的pH值对酶的稳定性有重要影响,但酶的最适稳定pH不一定是最佳反应pH,考察最佳反应pH值也很重要。由图9所示,在碱性范围内,α-氨基酸酯酰基转移酶的活性先随pH值的升高而升高,在pH 8.5时其活性最高,pH 8.5是α-氨基酸酯酰基转移酶的最佳催化pH值。由图10所示,α-氨基酸酯酰基转移酶在pH 7.0−8.0范围内稳定性很好,孵育12 h,酶活力仍能保留原来的90%以上。
金属离子及化合物对α氨基酸酯酰基转移酶活力的影响如表1所示。低浓度的Co2+和低浓度的EDTA对该酶有轻微的促进作用,低浓度的Co2+将酶活力提高5.35%,低浓度的EDTA将酶活力提高3.33%;高浓度的Fe3+、Ni2+、SDS对该酶有明显的抑制作用,高浓度的SDS使该酶丧失酶活性;高浓度Mn2+对该酶有轻微的抑制作用;Ca2+、Mg2+对该酶无明显影响。
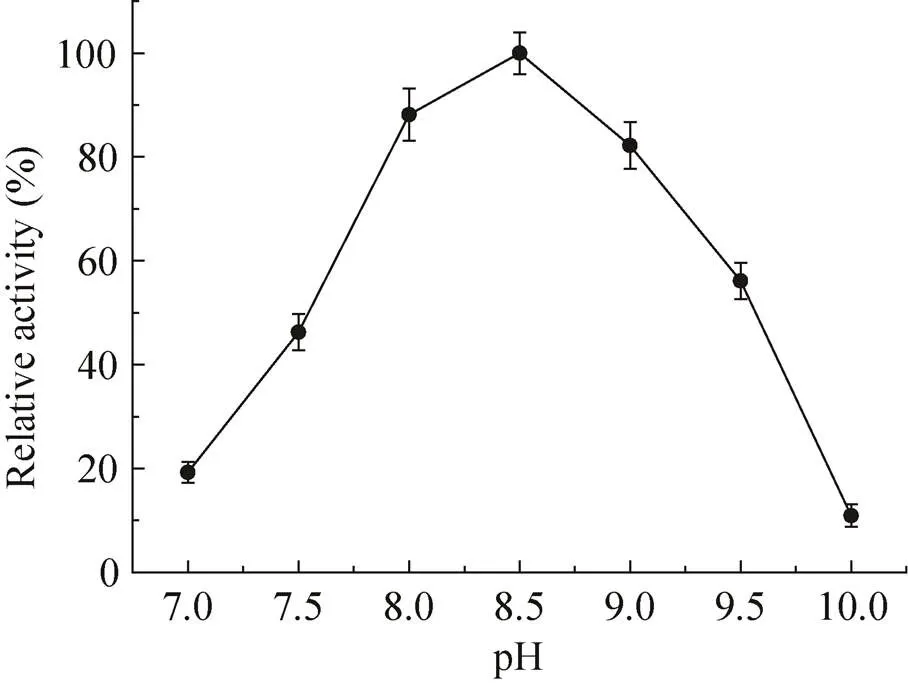
图9 pH对SAET活力的影响
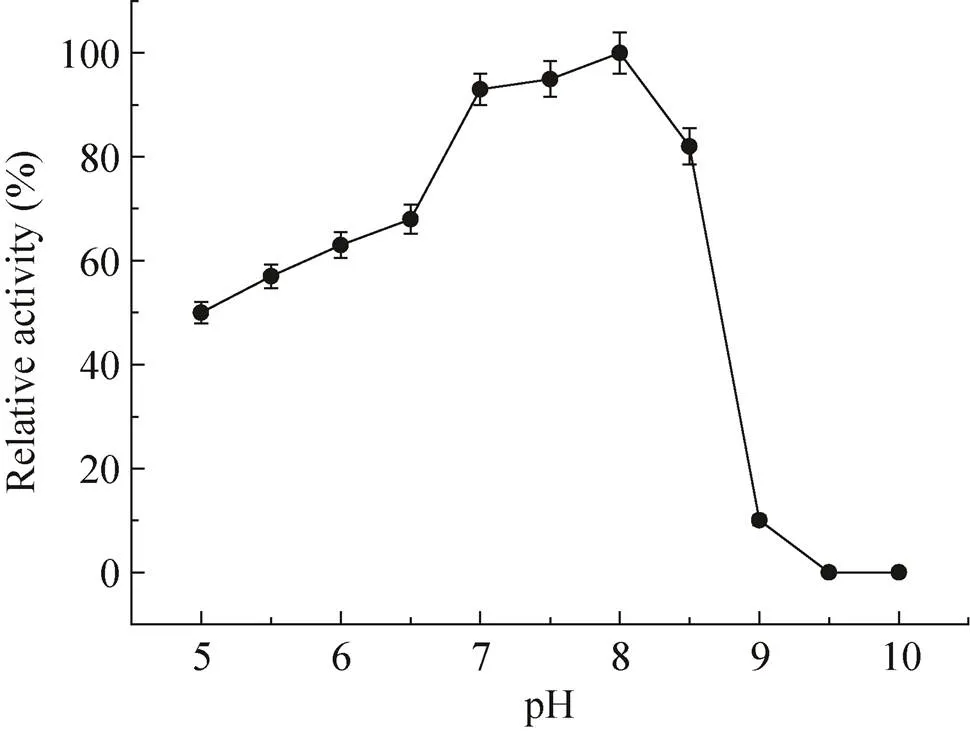
图10 pH对SAET稳定性的影响
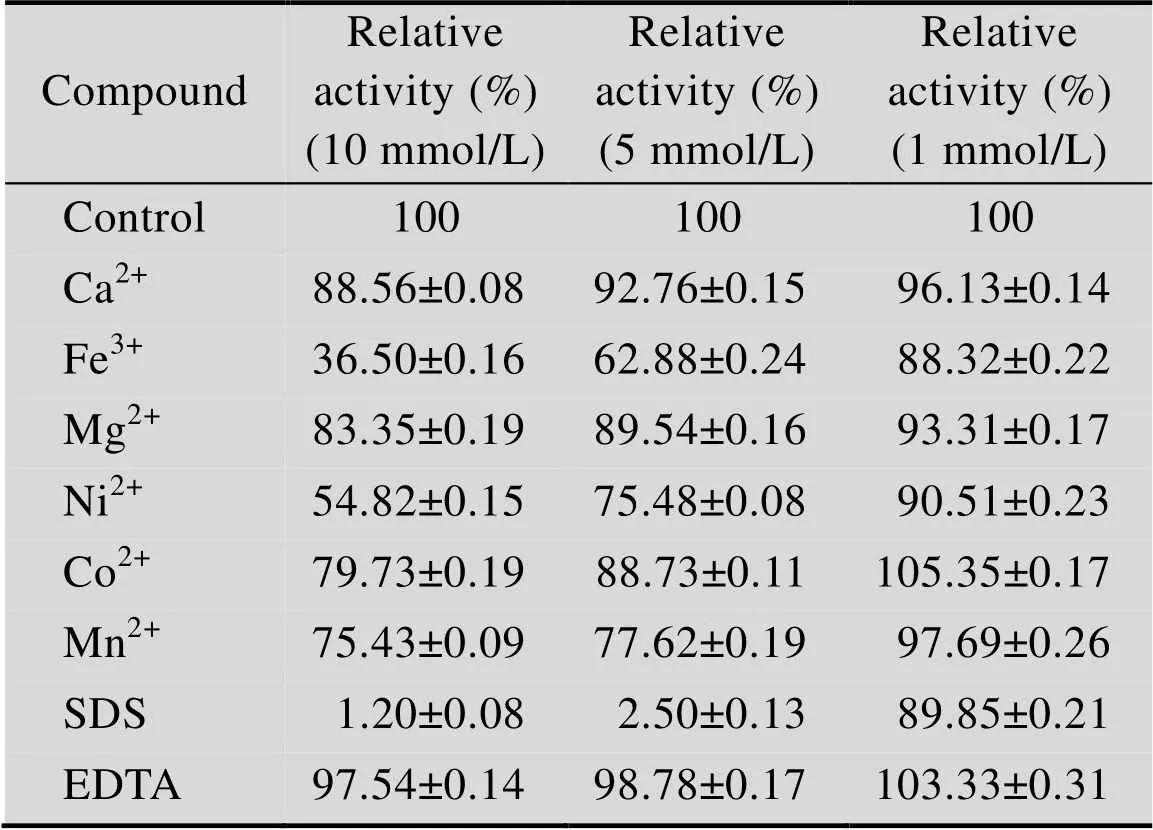
表1 金属离子及化合物对SAET活力的影响
2.3 α-氨基酸酯酰基转移酶催化条件优化
反应底物的配比对产物的生成有重要影响,固定丙氨酸甲酯盐酸盐的浓度为250 mmol/L,谷氨酰胺与其的比例为A:0.6、B:0.8、C:1.0、D:1.2,在27 ℃、pH 8.5下反应1 h,结果如图11所示,丙谷二肽的产量随着底物谷氨酰胺的浓度的增加而增大,且相对于底物谷氨酰胺的转化率依次为19.5%、19%、15.7%和13.2%,转化率是降低的,但当比例达到0.8后,产物的产量增加有限,但转化率却降低明显,所以当丙氨酸甲酯盐酸盐的浓度为250 mmol/L,谷氨酰胺浓度为200 mmol/L,即比例为0.8时应为底物的最佳浓度比。
丙氨酸甲酯盐酸盐的浓度为100、200、300、400、500、600 mmol/L,谷氨酰胺和丙氨酸甲酯盐酸盐的添加比例为0.8,在优化后的最佳条件下反应,丙谷二肽的产量如图12所示。当反应40 min时,丙谷二肽的产量趋于平衡。随着丙氨酸甲酯盐酸盐的浓度从100 mmol/L增加到600 mmol/L,丙谷二肽的量分别为15.1、29.2、42.3、56.2、69.5、78.2 g/L,相对于谷氨酰胺的转化率为86.7%、84.0%、81.1%、80.9%、80.0%和75.0%。
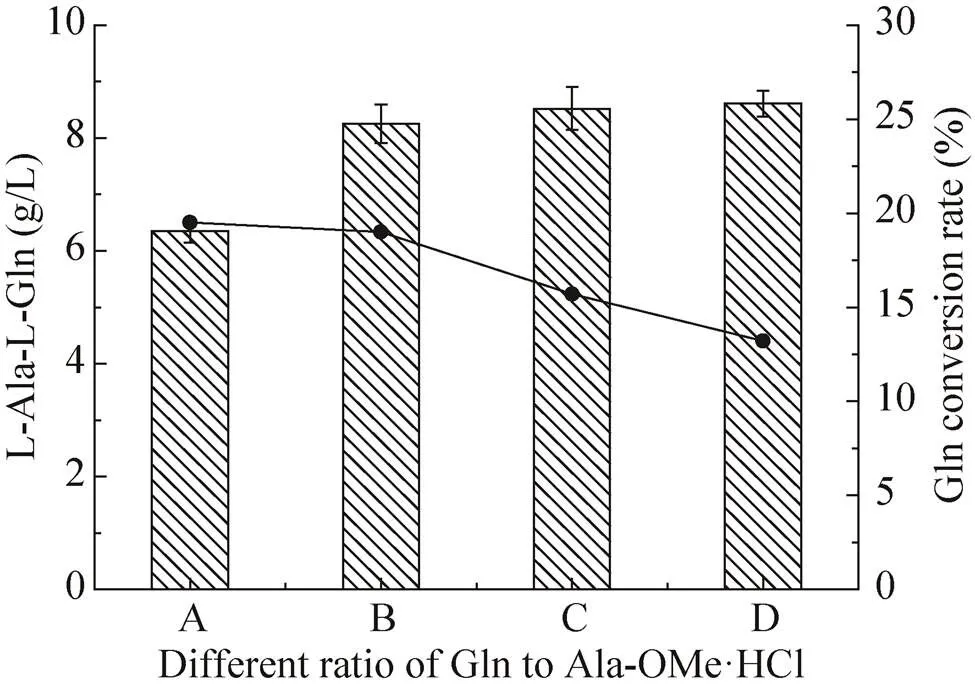
图11 底物的配比对催化反应的影响
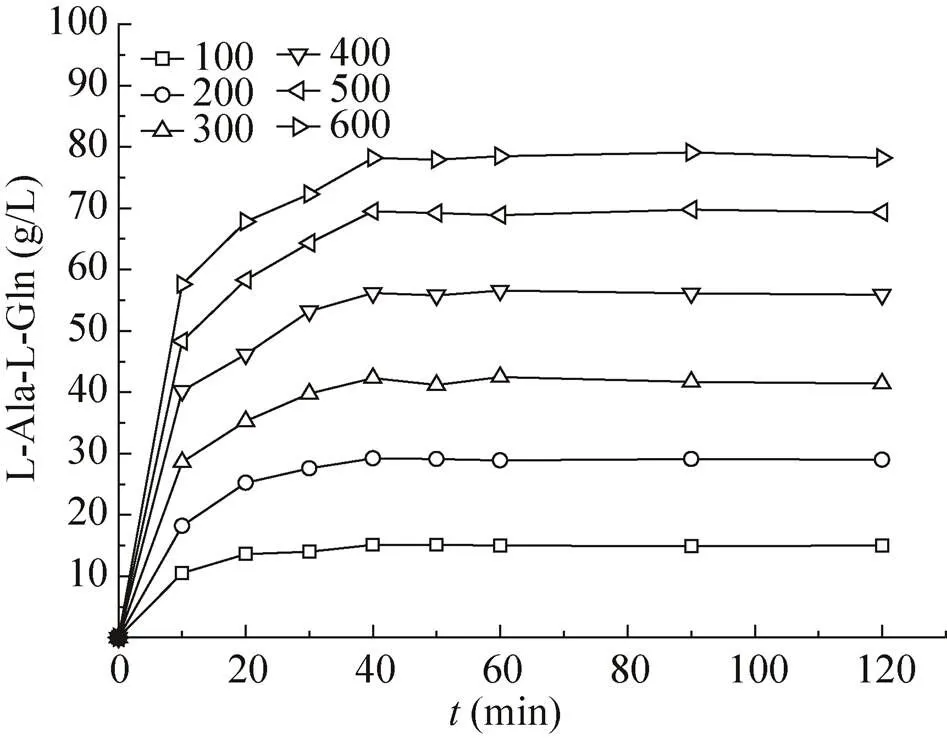
图12 底物浓度对催化反应的影响
3 讨论
丙谷二肽作为谷氨酰胺的替代物,应用前景广泛,但目前在丙谷二肽的生产方式上存在短板,生产过程复杂,成本高昂,α-氨基酸酯酰基转移酶的出现为丙谷二肽的合成带来了新的曙光。文中首先对重组大肠杆菌saet-QC01的表达条件进行了优化,诱导温度在20 ℃和25 ℃时,表达的酶活差别不大,但诱导温度过高会导致蛋白质合成速度过快,多肽链不能正确折叠,使得疏水基因暴露在外容易形成包涵体,因此当酶活相似时,选取最后的诱导温度为20 ℃[20-21];IPTG浓度太低时蛋白的表达量低,酶活较小,而IPTG浓度过高反而会抑制蛋白的表达,而且IPTG有细胞毒性,不利于菌体生长[22-23],选取IPTG最佳诱导浓度为0.6 mmol/L;加入IPTG时,600在2.0–2.5时,酶活的大小相差不大,结合该重组大肠杆菌的生长曲线,当600达到2.0–2.5时,此时为该重组菌的对数生长期的中期阶段,在此时,菌体活力强,生长能力旺盛,酶的表达能力高,所以诱导的初始菌浓度600为2.0–2.5时最佳;一般诱导时间越长,目的蛋白的表达量越高,但诱导时间过长,诱导产生的氨基酸反而会抑制目的蛋白的合成[24],当诱导时间在12 h时酶活力最高;所以最终的优化结果为:最佳的诱导温度20 ℃,加入IPTG时初始菌浓度600为2.0–2.5,IPTG浓度0.6 mmol/L,诱导时间12 h;然后对α-氨基酸酯酰基转移酶的酶学性质进行了研究,该酶的最佳反应温度为27 ℃,反应pH 8.5,在pH 7.0–8.0很稳定,在酸性条件下相对稳定,低浓度的Co2+、低浓度的EDTA对酶活有促进作用;最后对该酶催化合成丙谷二肽的催化条件进行了研究,在最优的反应条件下实现丙谷二肽的高效合成,即温度为27 ℃,pH 8.5,谷氨酰胺和丙氨酸甲酯盐酸盐的添加比例为0.8,当丙氨酸甲酯盐酸盐的浓度为600 mmol/L、谷氨酰胺的浓度为 480 mmol/L时,反应40 min时丙谷二肽的量为78.2 g/L,丙谷二肽的生产速率达到1.955 g/(L·min),相对于谷氨酰胺的转化率为75.0%,达到国际的最佳水平[25]。
在提高丙谷二肽的转化率和积累量上,可以对反应体系中底物采取流加的方式进行研究,可以改变流加浓度、流加速度、流加量来实现丙谷二肽的优化生产。另外还可以对α-氨基酸酯酰基转移酶的结构进行模拟,对其基因序列实行定点突变的方式,筛选有效的突变体,增加酶的稳定性和催化效率,向提高丙谷二肽合成效率的方向推进。
[1] Tapiero H, Mathé G, Couvreur P, et al. II. Glutamine and glutamate. Biomed Pharmacother, 2002, 56(9): 446–457.
[2] Wernerman J. Suggestion for present and future use of parenteral glutamine. Clin Nut Suppl, 2004, 1(1): 37–42.
[3] Fürst P. New developments in glutamine delivery. J Nut, 2001, 131(9): 2562S–2568S.
[4] Lacey JM, Wilmore DW. Is glutamine a conditionally essential amino acid. Nut Rev, 1990, 48(8): 297–309.
[5] Abumrad NN, Morse EL, Lochs A, et al. Possible sources of Gln for Parenteral nutrition. Am J Physiol, 1989, 257(2 Pt 1): E228–E234.
[6] Tritsch GL, Moore GE. Spontaneous decomposition of glutamine in cell culture media. Exp Cell Res, 1962, 28(2): 360–364.
[7] Yagasaki M, Hashimoto SI. Synthesis and application of dipeptides; current status and perspectives. Appl Microbiol Biotechnol, 2008, 81(1): 13–22.
[8] Fürst P, Pogan K, Stehle P. Glutamine dipeptides in clinical nutrition. Nutrition, 1997, 13(7/8): 731–737.
[9] Fürst P, Stehle P. Glutamine supplemented nutrition in clinical practice--use of glutamine-containing dipeptides. Infusionstherapie Und Transfusionsmedizin, 1995, 22(5): 317–324.
[10] Liu SX, Yang YH, Liu XW, et al. Direct amidation of amino acid derivatives catalyzed by arylboronic acids: applications in dipeptide synthesis. Eur J Org Chem, 2013, 2013(25): 5692–5700.
[11] Nilsson BL, Soellner MB, Raines RT. Chemical Synthesis of Proteins. Annual Review of Biophysics and Biomolecular Structure, 2005, 34(19): 91–118.
[12] Steinborn G, Hajirezaei MJ, Hofemeister J.genes for recombinant bacilysin and anticapsin production inhost strains. Arch Microbiol, 2005, 183(2): 71–79.
[13] Tabata K, Ikeda H, Hashimoto S.incodes for a novel enzyme, L-amino acid ligase. J Bacteriol, 2005, 187(15): 5195–5202.
[14] Tabata K, Hashimoto SI. Fermentative production of L-alanyl-L-glutamine by a metabolically engineeredstrain expressing L-amino acid alpha-ligase. Appl Environ Microbiol, 2007, 73(20): 6378–6385.
[15] Kino K, Nakazawa Y, Yagasaki M. Dipeptide synthesis by L-amino acid ligase from. Biochemical and Biophysical Research Communications, 2008, 371(3): 536–540.
[16] Hashimoto SI, Tabata K. Microorganisms producing dipeptides and process for producing dipeptide using the microorganisms: US, US20100120126. 2010-05-13.
[17] Yokozeki K, Hara S. A novel and efficient enzymatic method for the production of peptides from unprotected starting materials. J Biotechnol, 2005, 115(2): 211–220.
[18] Hirao Y, Mihara Y, Kira I, et al. Enzymatic production of L-alanyl-L-glutamine by recombinantexpressing α-amino acid ester acyltransferasefrom. Biosci Biotechnol Biochem, 2013, 77(3): 618–623.
[19] Abe I, Hara S, Yokozeki K. Gene cloning and characterization of α-amino acid ester acyl transferase inATCC14234 andAJ2458. Biosci Biotechnol Biochem, 2011, 75(11): 2087–2092.
[20] Liu M, Sun Y, Yang YK, et al. Construction of chimeric single-chain antibody efficient soluble expression inand optimization of fermentation conditions. J Biol, 2016, 33(6): 1–6 (in Chinese). 刘萌, 孙杨, 杨艳坤, 等. 人-鼠嵌合单链抗体的构建及其在大肠杆菌中的高效可溶性表达和发酵条件优化. 生物学杂志, 2016, 33(6): 1–6.
[21] Corrales-Garcia L, Ortiz E, Castañeda-Delgado J, et al. Bacterial expression and antibiotic activities of recombinant variants of human β-defensins on pathogenic bacteria and. Prot Express Purific, 2013, 89(1): 33–43
[22] Lange C, Rudolph R. Suppression of protein aggregation by L-arginine. Curr Pharmaceut Biotechnol, 2009, 10(4): 408–414.
[23] De Araujo ED, Geletu M, Gunning PT. Strategies for over-expression and purification of recombinant full length STAT5B in. Prot Express Purificat, 2017, 129: 1–8.
[24] San-Miguel T, Pérez-Bermúdez P, Gavidia I. Production of soluble eukaryotic recombinant proteins inis favoured in early log-phase cultures induced at low temperature. Springerplus, 2013, 2: 89.
[25] Li YM, Yuan WJ, Gao JQ, et al. Production of L-alanyl- L-glutamine by recyclingexpressing α-amino acid ester acyltransferase. Bioresour Technol, 2017, 245: 1603–1609.
(本文责编 陈宏宇)
Expression, purification, characterization and application of α-amino acid ester acyltransferase from recombinant
Pengfei Liu, Qimeng Lu, Xueqin Hu, Xuewen Hou, and Hongbin Zhang
School of Biological and Medical Engineering, Hefei University of Technology, Hefei230009, Anhui, China
α-Amino acid ester acyltransferase (Aet) catalyzes the L-alanyl-L-glutamine forming reaction from L-alaine methylester hydrochloride and L-glutamine. In this study, the recombinantsaet-QC01 was used to express the α-amino acid acyltransferase, and its expression conditions were optimized. The recombinant protein was separated and purified by Ni-NTA affinity chromatography, and its enzymatic properties and catalytic applications were studied. The induction conditions suitable for enzyme production optimized were as follows: The temperature was 20 ℃, the induction stage (600=2.0−2.5), IPTG concentration was 0.6 mmol/L, induction time was 12 h. The optimal reaction conditions of α-amino acid acyltransferase were 27 ℃, pH 8.5, it was most stable between pH 7.0 and 8.0 and relatively stable in an acidic environment, and low concentration of Co2+or EDTA could promote the enzyme activity. Under optimal reaction conditions, 600 mmol/L of L-alaine methylester hydrochloride and 480 mmol/L of L-glutamine, the yield of L-alanyl-L-glutamine reached 78.2 g/L and productivity of 1.955 g/L/min, the conversion rate reached 75.0%. α-Amino acid ester acyltransferase has excellent acid-basei resistance, high catalytic efficiency. These characteristics suggest its application prospects in the industrial production.
α-amino acid ester acyltransferase, L-alanyl-L-glutamine, expression conditions, characterization, catalysis conditions
January 9, 2018;
April 23, 2018
College Students Innovation and Entrepreneurship Training Program of Hefei University of Technology (No. 2017CXCY478), Special Fund for Independent Innovation Program of Anhui Province, China (Qiushi Program of Hefei University of Technology, No. 2013AKKG0391).
Hongbin Zhang. Tel: +86-551-62901968; E-mail: zhb5678@163.com
10.13345/j.cjb.180017
合肥工业大学大学生创新创业训练计划项目 (No. 2017CXCY478),安徽省自主创新专项“秋实计划” (No. 2013AKKG0391) 资助。
