微生物尿酸氧化酶的筛选、酶学性质及重组表达
2018-07-30咸静女郭鑫李波彭海波汪小龙张建业陈刚
咸静女,郭鑫,李波,彭海波,汪小龙,张建业,陈刚
微生物尿酸氧化酶的筛选、酶学性质及重组表达
咸静女,郭鑫,李波,彭海波,汪小龙,张建业,陈刚
中国海洋大学,山东 青岛 266007

金城. 2018酶工程专刊序言. 生物工程学报, 2018, 34(7): 1021−1023.Jin C. Preface for special issue on enzyme engineering (2018). Chin J Biotech, 2018, 34(7): 1021−1023.
尿酸氧化酶 (Urate oxidase,Uox) 是一种催化尿酸氧化为尿囊素的酶,常用于尿酸的检测以及痛风和高尿酸血症治疗。文中从土壤中筛选出一株Uox高产菌株OUC-1,经16S rRNA部分基因序列分析,与苛求芽孢杆菌序列相似度达99%。OUC-1的Uox经纯化后,分析表明该酶反应最适pH和温度分别为10.0和40 ℃;Uox以尿酸为底物反应动力学参数m值为 (0.15±0.04) mmol/L (=5)。Mg2+能够提高该酶性活性,而Zn2+和SDS能强烈抑制该酶的酶活。参考GenBank中苛求芽孢杆菌基因组中的基因序列,成功扩增出基因,通过SWISS-MODEL对Uox空间结构进行预测,推测该酶是同源四聚体,单亚基分子量为35.38 kDa。文中将基因克隆并在大肠杆菌中表达,为后续的Uox的性能改造提供条件和技术支持。
尿酸氧化酶,苛求芽孢杆菌OUC-1,酶学性质,重组尿酸氧化酶
尿酸氧化酶(Urate oxidase, Uox, EC1.7.3.3)是生物体内嘌呤代谢的关键酶,催化尿酸氧化形成尿囊素。研究发现许多物种中有Uox存在,然而在高等哺乳动物尤其是猿和人类体内却缺乏具有生物活性的Uox[1],尿酸在人体内的累积可导致痛风症[2-4]。近年来随着饮食结构和生活方式的改变,摄入嘌呤成分的增多,调查发现成年人痛风发病率呈逐渐上升的趋势[5],同时流行病学和临床研究证实了血液中尿酸升高与心血管疾病的发生有重要的关联[6-7]。
随着研究的深入,在尿酸的检测、痛风和高尿酸症治疗方面,Uox的应用潜力也逐渐被发现[8-9]。利用Uox检测尿酸的方法具有简单、快速、特异性强的优点而成为常用的临床检测方法[10]。此外Uox在疾病治疗方面可通过直接注射Uox快速降低血液中的尿酸含量,用于痛风症的长期治疗[11]。研究发现自然界中存在大量的微生物来源的Uox资源[12-14],这些野生菌产生的Uox虽然在体外具有一定降解尿酸活性,但由于结构和稳定性上的缺陷,限制了其在检测和临床的应用。因此利用工程菌株异源表达基因,并通过分子杂交和理性设计等手段改造Uox是获得具有临床价值药物的重要途径。
本研究通过从环境微生物中筛选高产Uox菌株,发酵后纯化Uox,并对最适温度、pH等酶学性质进行探究。通过合理设计引物扩增该菌的基因,进行克隆和在大肠杆菌中异源表达,为后续基因突变表达库的构建及筛选高稳定性和高底物亲和力的Uox奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和载体
本研究采用的菌株大肠杆菌DH5α、BL21和质粒pET28a等为本实验室保存。
1.1.2 培养基及试剂
尿酸降解微生物富集培养基(g/L):硫酸镁0.5,氯化钠0.1,磷酸氢二钾0.5,磷酸二氢钾0.5,尿酸2,pH 7.0;固体分离培养基添加2%的琼脂。
产尿酸氧化酶发酵培养基(/L):蛋白胨10 g,蔗糖20 g,氯化钠0.5 g,硫酸镁1 g,磷酸二氢钾1 g,硫酸亚铁10 mg,尿酸1.5 g,pH 7.0。
1.2 方法
1.2.1 产尿酸氧化酶菌株的筛选
称取5 g不同环境来源的土壤样品,加入到富集培养基于30 ℃、120r/min振荡富集培养3–5 d。 梯度稀释后涂布在含有尿酸的筛选培养基上培养,挑取含有透明圈的菌落,经分离纯化后,接种在发酵培养基中培养3–5 d,检测发酵液中Uox的活性,筛选出高产Uox的菌株进行进一步测试。
1.2.2 菌株生长和尿酸氧化酶酶活性检测
产酶发酵过程中定时取样检测菌体生长和发酵液Uox酶活。菌体生长通过检测600的值确定。Uox活性根据文献[15-16],将每分钟转换1 μmol尿酸的量定义为单位酶活。检测反应液尿酸溶液在293nm紫外光下吸光值单位时间的减少量来确定。具体公式如下:

1.2.3 产酶菌株16S rRNA基因测序及鉴定
提取产酶菌株的基因组DNA,利用16S rRNA基因通用引物进行PCR扩增[17-18]。扩增产物经纯化测序后,序列通过PubMed数据库中的Blast工具与GenBank中核酸序列进行比对分析,确定与已知菌种的相似关系。DNA测序均由生工生物工程(上海)股份有限公司完成。
1.2.4 产酶菌株Uox的纯化
产酶菌株发酵结束后,离心分别获取菌体和发酵液。菌体经超声破碎离心收集上清液,即粗酶液。将胞内外粗酶液经50 mL透析管 (10 kDa)初步脱盐浓缩后,通过AKTA蛋白纯化系统依次经DEAE-52阴离子交换层析[19]和丙烯基葡聚糖Sephacryl S-300凝胶过滤层析[20]对Uox酶进行进一步纯化。
1.2.5 Uox酶学性质分析
将纯化好的Uox酶液加入合适的反应体系中,分析温度 (25 ℃、28 ℃、30 ℃、32 ℃、35 ℃、37 ℃、40 ℃、42 ℃、45 ℃、48 ℃、50 ℃、52 ℃、55 ℃、58 ℃、60 ℃)、pH (7–12)、常见离子 (Cu2+、Zn2+、Mn2+、Mg2+、Fe3+和Ca2+) 及酶抑制剂(EDTA、咪唑、SDS) 对Uox酶活的影响,每组实验分别设置3个平行组。
在酶热稳定性研究中,反应液分别经不同温度处理10、20、30min后检测酶活变化;检测金属离子对Uox影响实验中,离子的浓度设置为 0–6mmol/L,除Ca2+使用CaCl2外,其他金属离子都使用其硫酸盐化合物;检测酶抑制剂EDTA、咪唑、SDS对Uox活性的影响,抑制剂的浓度分别设置为0.5、1.0、2.0、3.0、4.0、6.0、8.0 mmol/L。
1.2.6 苛求芽孢杆菌OUC-1的Uox米氏常数 (m) 测定
在25 ℃条件下,0.2 mmol/L硼酸钠反应体系(pH 9.0)中,测试不同浓度的尿酸(0.1–0.5 mmol/L)底物,在293nm处1min内光吸收的减少量。根据 Lineweaver Burk法[21]作图计算该尿酸酶的m。
1.3 苛求芽孢杆菌B. fastidiosus OUC-1来源的uox基因的克隆、表达
基因扩增:根据GenBank中已知的保守序列设计扩增OUC-1菌的基因全序列的引物[22-23],为便于克隆测序,分别在正向和反向引物序列的5ʹ端引入酶HⅠ和dⅢ酶切位点,具体引物序列如下。正向引物UoxF:5ʹ-CGGG ATCCATGTTTTATGGTAAAGGCG-3ʹ;反向引物UoxR:5ʹ-CCCAAGCTTTCATAGTGCA ACATACTCCG-3ʹ。PCR扩增参考文献[24-25]进行。
表达载体pET28a/uox的构建:基因PCR 扩增产物和质粒pET28a分别用HⅠ和d Ⅲ双酶切后回收纯化,经T4 DNA连接酶连接后转化大肠杆菌BL21感受态细胞,构建成重组质粒pET28a/,重组质粒序列测定由生工生物工程(上海)股份有限公司完成。
大肠杆菌重组表达Uox蛋白的分离纯化:含有Uox重组子表达的工程大肠杆菌经发酵、IPTG诱导表达后48 h收获菌体,7 500 r/min离心 20 min后收集菌体,菌体经超声波破菌后离心,上清和重悬的沉淀分别经12% SDS-PAGE 分析来确定其为胞内可溶或包涵体表达,重组蛋白通过AKTA蛋白纯化系统,经亲和层析柱纯化[26]后检测酶活。
2 结果与分析
2.1 产尿酸氧化酶菌株的筛选和鉴定
经过富集筛选从环境样品中纯化出9株具有产透明圈的菌株,经PCR扩增16S rRNA部分序列并测序进行序列比对后,根据GenBank中菌落序列的相似性比对结果 (序列相似度>98%),初步鉴定uo-331、uo-332、uo-333、uo-334、uo-335、uo-338为芽孢杆菌属,uo-336、uo-411为假单胞菌属,uo-412为微杆菌属。根据透明圈的大小和发酵液酶活的初步测试,uo-338菌株的酶活最高,其16S rRNA序列与苛求芽孢杆菌基因序列(NR_113989) 相似性>99%。菌株经进一步的生理生化分析后确认为苛求芽孢杆菌OUC-1,以下实验将针对该菌Uox酶进行研究。
2.2 B. fastidiosus OUC-1的生长和产酶曲线测定
实验结果 (图1) 显示,OUC-1 经发酵培养36 h时生长量达到最高,随后菌株的600值趋于稳定。发酵液酶活在培养12 h前未检测到Uox活性,24 h酶活达0.128 U/mL,到30 h时酶活性最高,达到0.183 U/mL,随后酶活性逐渐下降。
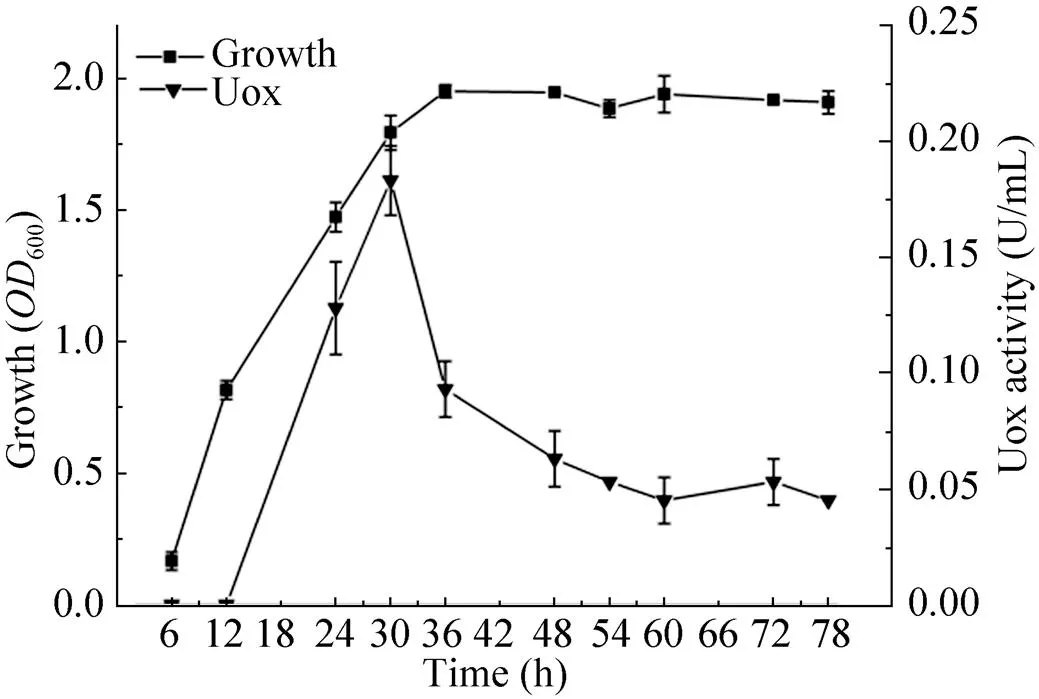
图1 B. fastidiosus OUC-1的生长和酶活测定
2.3 B. fastidiosus OUC-1产Uox的纯化
实验中发酵液及菌体内都检测出Uox酶活性,发酵后细胞粗酶液经超滤浓缩和进一步的离子交换、凝胶层析纯化后,胞内外Uox酶活都有不同程度的提高 (表1),胞内Uox的比酶活提升了5倍,胞外Uox的比酶活则提升了13倍。SDS-PAGE结果(图2) 也表明Uox经纯化后纯度明显提高,且主要分布在35–40 kDa之间。
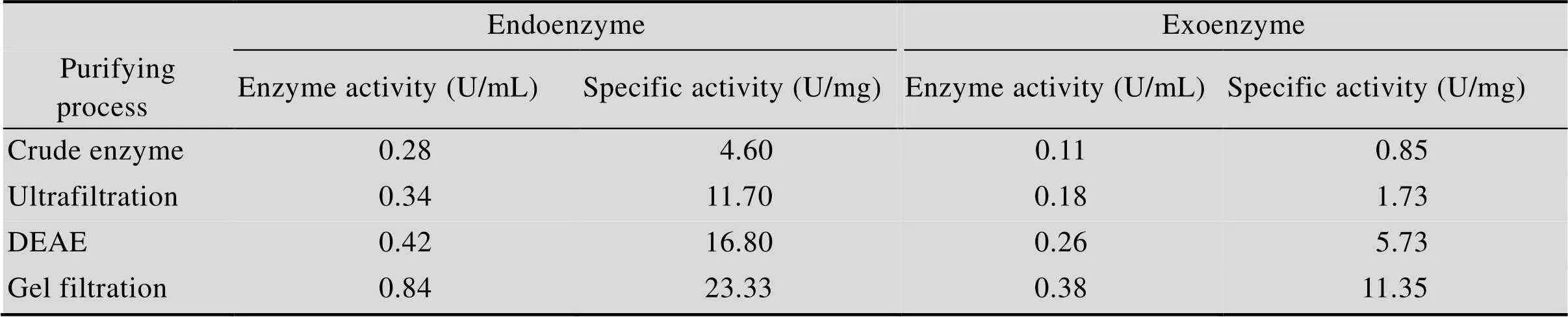
表1 纯化过程的酶活和比酶活
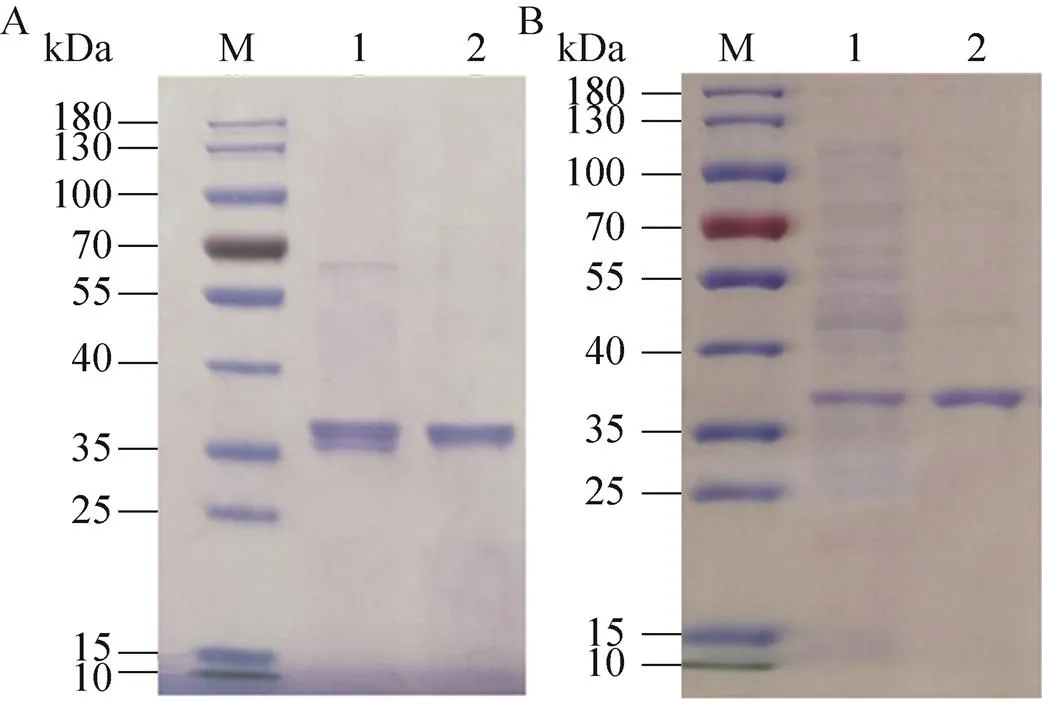
图2 OUC-1胞外(A)、胞内 (B) 纯化Uox的SDS-PAGE图谱
2.4 苛求芽孢杆菌B. fastidiosus OUC-1来源Uox的酶学性质
2.4.1 Uox的最适反应温度及热稳定性研究
实验结果显示 (图3),40 ℃为该酶的最适反应温度。温度从25 ℃升高到40 ℃时,OUC-1 的Uox活性随温度的升高处于较平稳的状态,在40 ℃热处理10 min后达到最高。当温度从48 ℃增高到55 ℃以上时,酶活从高点快速下降到8%左右,并随着处理时间的延长,其酶的 热稳定性也呈下降趋势,尤其是在50 ℃和52 ℃热处理30 min后酶活衰减较快。温度继续升高到60 ℃,酶活一直保持在较低的水平,此时延长热处理时间并不能使酶活快速降低。
2.4.2 pH对Uox酶活性的影响
以pH 9.0为参照,实验结果显示(图4),反应体系的pH从7.0升高到10.0过程中,Uox的相对酶活从30%升高到120%,之后随pH从10.0升高到12.0,酶活呈快速下降趋势,该Uox酶的最适pH应在10.0左右。
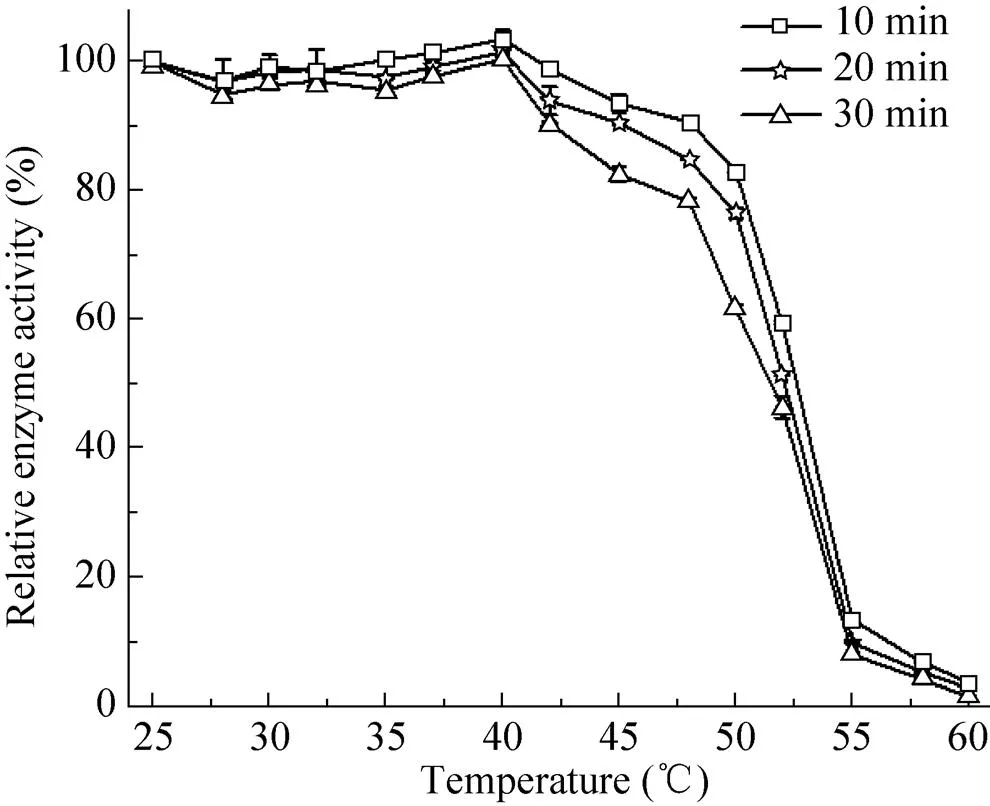
图3 温度对Uox酶活的影响
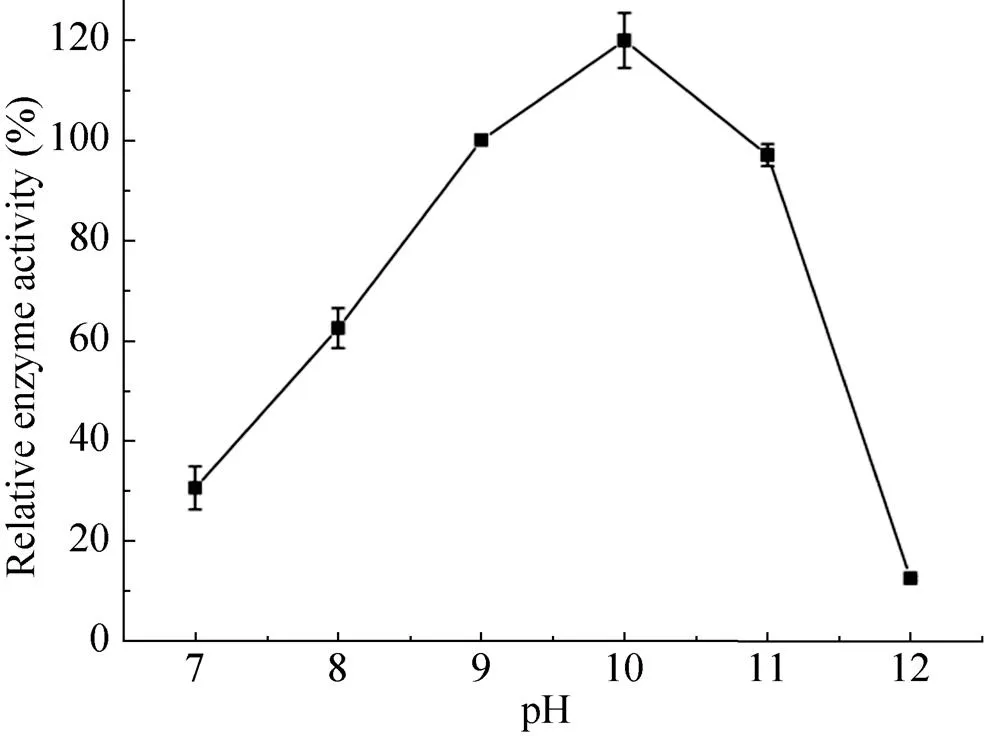
图4 pH对Uox酶活的影响
2.4.3 不同金属离子对Uox活性的影响
实验结果(图5) 显示出Zn2+对Uox酶活性有明显的抑制作用,在较低浓度(0.5 mmol/L)时Uox相对酶活为11.15%;而Mg2+随着浓度的增加能显著提高Uox酶的活性,当浓度达到6 mmol/L时,相对酶活高达163.27%。K+和Ca2+在测试浓度范围内对酶活无明显影响。而Cu2+和Fe3+随着浓度升高,其对Uox的抑制作用明显,金属Mn2+离子在测试浓度范围可能对Uox活性略有抑制。
2.4.4 抑制剂对Uox活性的影响
图6结果表明Uox酶活随着SDS浓度升高而迅速降低,尤其当SDS浓度高于3 mmol/L时,Uox几乎没有活性。咪唑在0.5–8 mmol/L浓度范围内对Uox无明显影响。EDTA作为常见的金属螯合剂,在0.5 mmol/L时相对酶活高达134%,对Uox具有明显促进作用,但随着浓度的持续升高(>4 mmol/L),其促进作用减弱到对照的酶活水平。
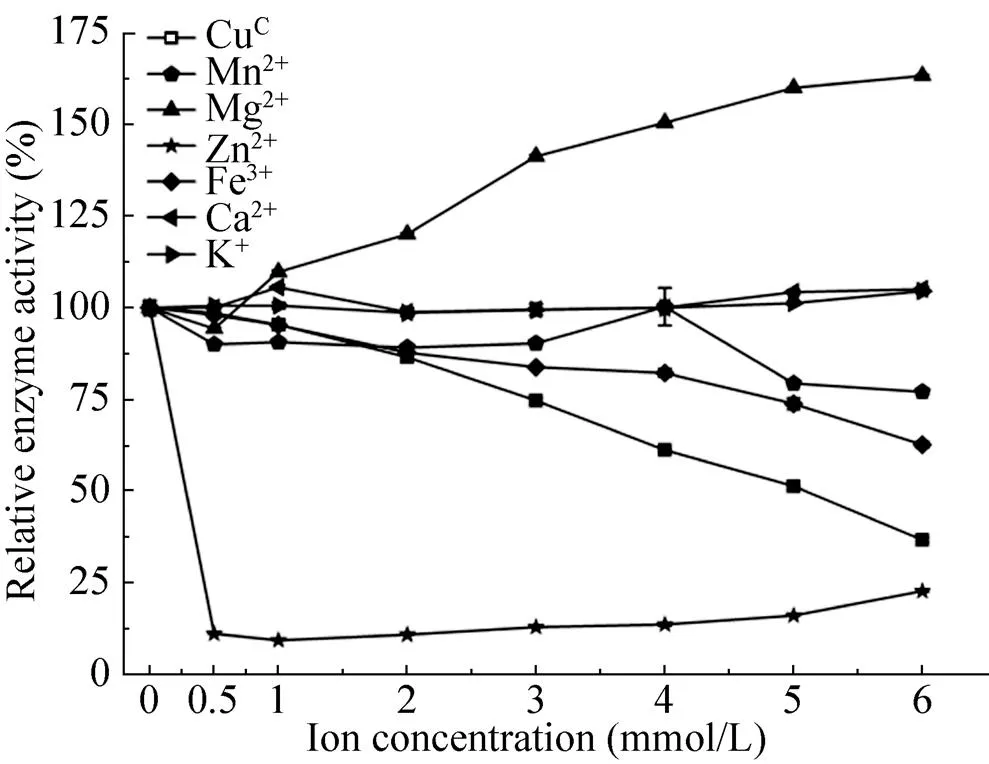
图5 不同离子对Uox酶活的影响
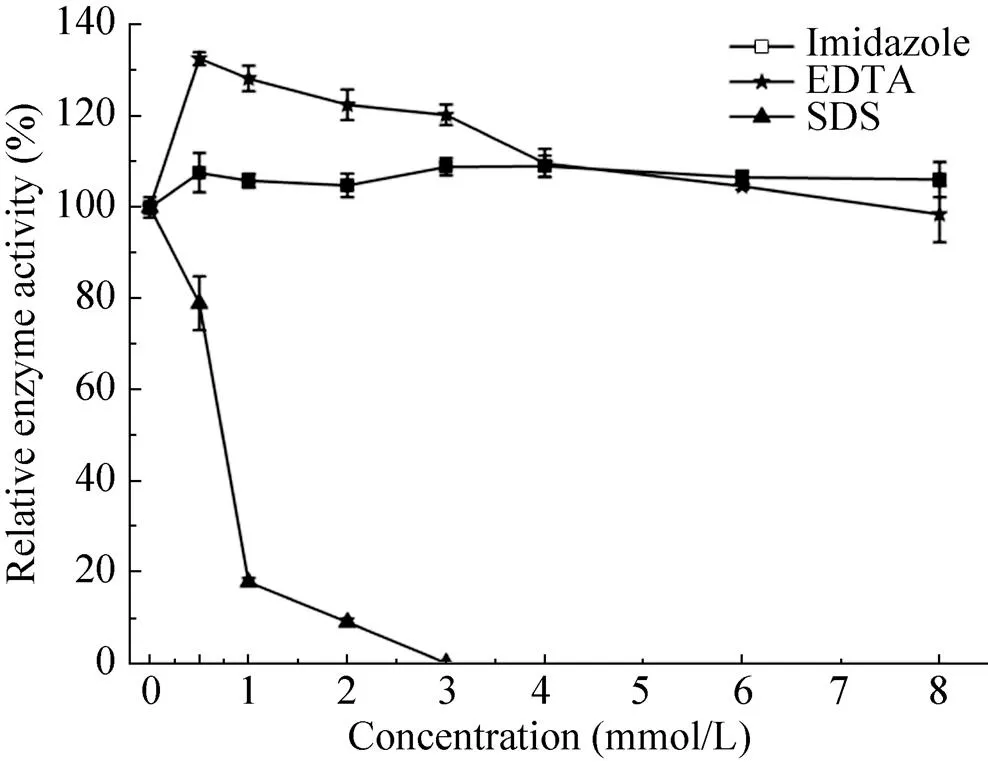
图6 常见酶抑制剂对Uox酶活的影响
2.5 Uox的米氏常数(Km) 和Vmax测定
根据Lineweaver Burk作图法求得苛求芽孢杆菌OUC-1尿酸氧化酶的m为(0.15± 0.04) mmol/L(=5)(图7),max为0.021 mol/(L·min)。米氏方程为:1/=7.01/+46.57。
2.6 uox基因的克隆和重组表达
2.6.1基因的扩增及表达载体的构建
以苛求芽孢杆菌OUC-1的基因组DNA为模板,经PCR扩增出大小约为900 bp的DNA片段,测序后序列经NCBI网站的ORF Finder转换为蛋白质序列,利用SWISS-MODEL建模推测该酶为同源四亚基,单亚基的分子量为35.38 kDa,等电点pI为5.1。OUC-1的基因序列通过NCBI网站的blastn和blastp分析工具与GenBank中的已知基因和Uox酶蛋白质进行比对,发现与已报道[27]的29604的基因和Uox序列高度相似,同源性分别达到96%和97.5%,但单亚基的氨基酸序列上存在7个氨基酸的差别:D103S、K118Q、K207Q、A215P、T230S、N234T、E236D。
通过进化树分析 (图8) 可看出OUC-1的Uox与其他种类Uox的同源性相对较低。利用UniProt网站数据库中蛋白比对推测该菌的Uox活性位点为65位苏氨酸 (T) 和66位的天冬氨酸 (D)、175位的苯丙氨酸 (F) 以及192位的精氨酸 (R)。
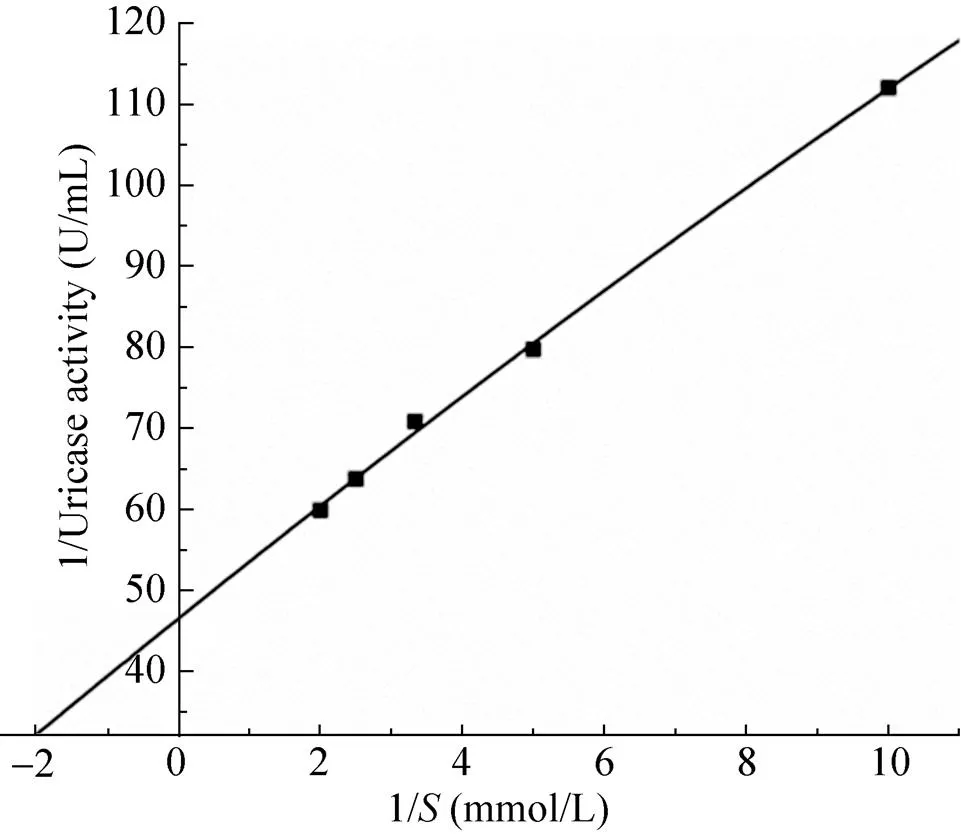
图7 双倒数作图法测定Km
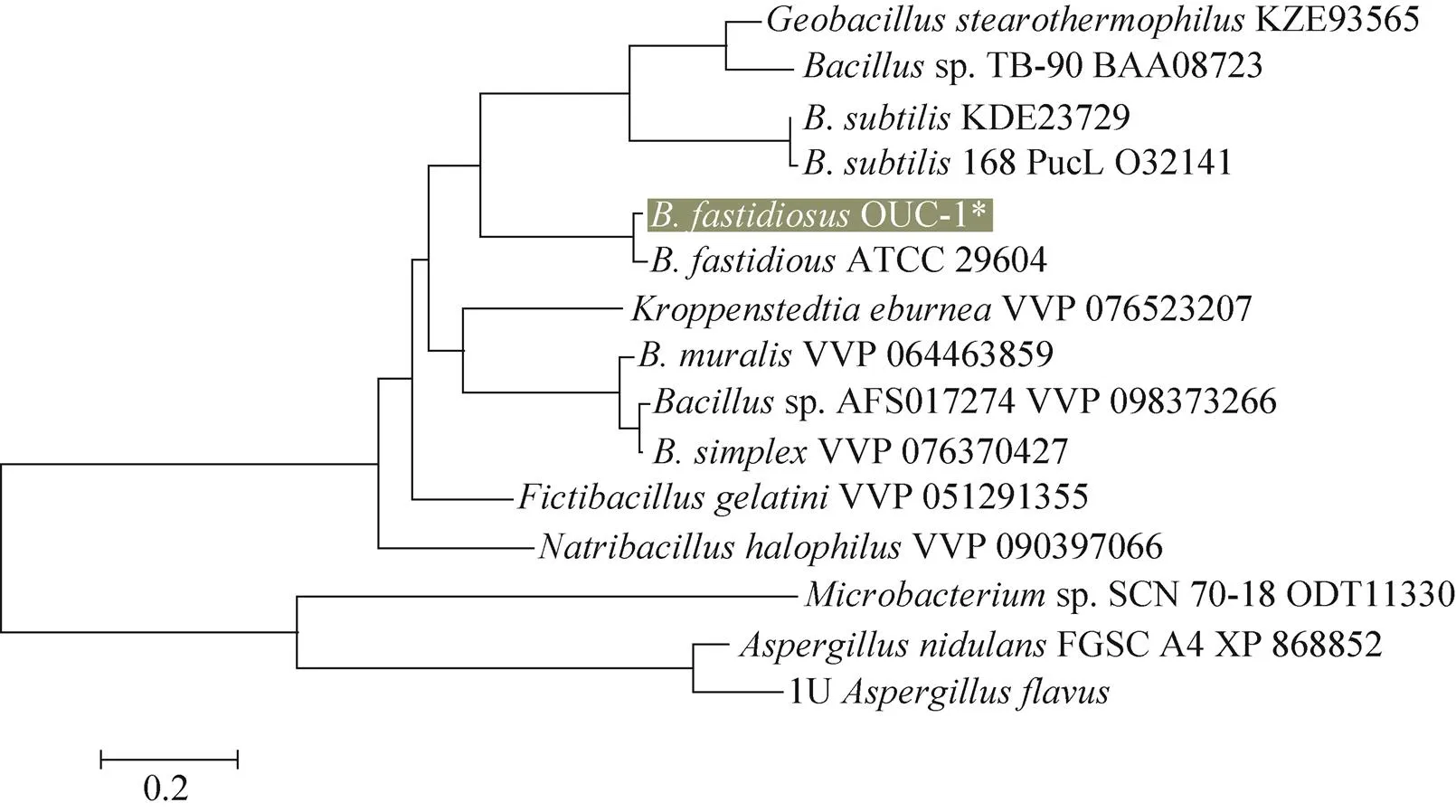
图8 基于氨基酸序列的邻接法 (N-J) 构建的Uox系统发育关系进化树
2.6.2 苛求芽孢杆菌.OUC-1的基因克隆及大肠杆菌异源表达
的基因在大肠杆菌重组表达的实验中,转化后涂布在含有尿酸的固体培养基上,与对照组相比,含有尿酸氧化酶菌落的周围已变透明,说明该重组子能分解Uox,进一步对重组子测序分析证明Uox已在大肠杆菌中异源表达成功。重组子发酵液菌体超声波破碎后所得上清液经Ni柱亲和层析纯化获得重组表达的Uox。酶活测试显示,经IPTG诱导和未加诱导皆有Uox产生(图9),但未加IPTG的对照组全菌裂解液上清酶活为0.07 U/mL,而加入IPTG诱导的实验组酶活达2.32 U/mL,酶活提升30多倍。
3 讨论
Uox作为医学检测试剂和治疗用酶具有广阔的市场前景。微生物是尿酸氧化酶的一个重要来源,具有易于培养和代谢类型多样的特点。目前国内外已有许多微生物尿酸酶研究报道[28-33],本研究从土壤等环境样品中筛选得到了多株产Uox的菌株,有假单胞菌、微杆菌、芽孢杆菌等菌株。其中苛求芽孢杆菌OUC-1产酶较高。OUC-1具有同时产生分泌性和细胞内Uox酶的特点,但野生菌的生长和产酶依赖尿酸诱导,并且可同化的底物少,这提高了Uox的生产成本,尚需遗传改良得以提高产率。野生菌株的遗传背景相对复杂,提高酶活和改进酶学性质存在一定难度。将基因克隆到表达载体,一方面可利用工程菌直接生产Uox,也利于分子进化和理性设计等分子改造快速改善酶的性能。本实验表达的重组后Uox发酵产酶量达到了野生菌株的30倍,同时省去了添加价格昂贵的尿酸。
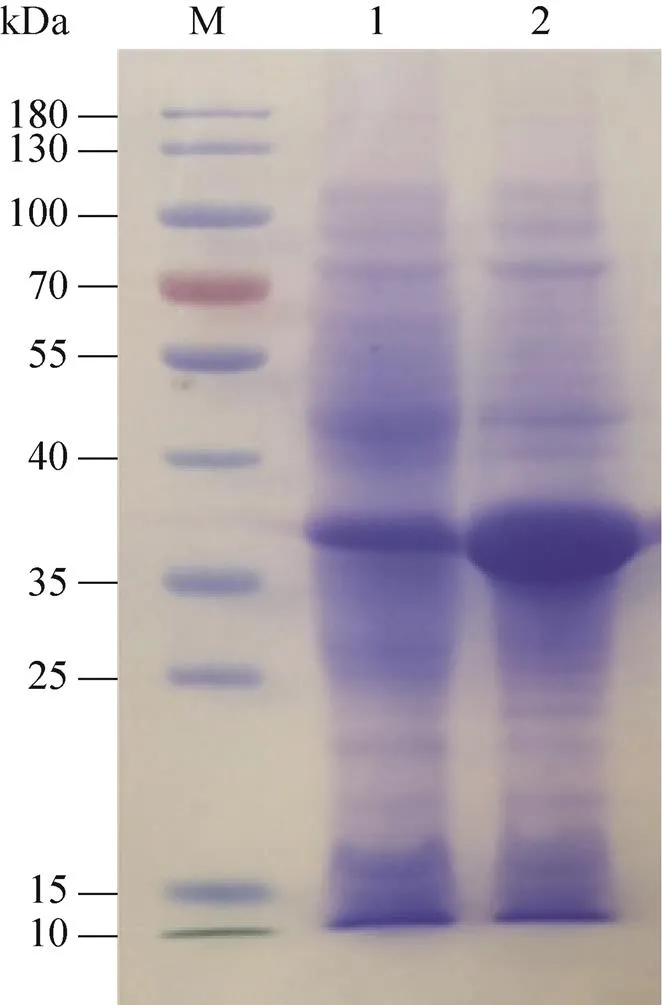
图9 Uox表达的SDS-PAGE分析
本研究筛选的OUC-1产Uox由同源四聚体构成,与1978年Bongaerts报道的 由2个36 kDa和2个39 kDa的亚基组成的SMG83 Uox异四聚体不同,后者只存在菌体胞内,两者在最适温度上也存在差异[10,28]。在氨基酸序列和空间结构上与ATCC 29604同源性非常高,仅有7个氨基酸差异,可能是同一种酶。其中有3个氨基酸T230S、N234T、E236D位于α螺旋 (225–238) 中,另外几个氨基酸的电性和疏水性等性质都存在变化,这些变化可能通过静电网络和空间结构的改变对酶活性产生一定的影响。
OUC-1来源Uox的m为 0.15 mmol/L,明显低于ATCC 29604 (0.22 mmol/L)[27],也低于Bongaerts等早期报 道的SMG83产生的尿酸酶 (0.18 mmol/L)[28],另外相对于Kai等[34]报道的一种微杆菌属尿酸酶(0.31 mmol/L),以及李想等[35]报道的芽孢杆菌胞内尿酸酶(0.29 mmol/L),OUC-1尿酸酶的m值较低,说明其与底物亲和性更强。
研究报道不同金属离子对不同微生物来源的Uox活性的作用不同[36]。本研究设置了0.5–6.0 mmol/L 的不同离子浓度梯度,发现Mg2+对Uox有明显的促进作用,并且随着浓度的提高促进作用更明显,这在其他文献中很少报道。而Zn2+对Uox活性有明显的抑制作用,与报道的Zn2+对球形节杆菌[36]、SMG83[28]和微杆菌sp. ZZJ4-1[37]的尿酸酶抑制作用相似。之前研究发现Cu2+对不同微生物尿酸酶也存在不同的作用,本研究随Cu2+浓度升高,其抑制作用逐渐增强,但仍与Cu2+表现出对FERM BP-360、sp. TB-90和来源[37]的Uox的强抑制作用有区别。
虽然OUC-1来源的Uox与ATCC 29604的Uox相似性非常高,但两者在底物的亲和力、离子对酶的影响方面还是有很大的差异,并且这些酶有些性质的差异与氨基酸的变化之间可能存在关联,尚需进一步研究。
当前应用于检测和临床治疗的Uox普遍存在热稳定差和免疫原性问题,在储藏、运输和应用过程中容易失活。目前对热稳定性好的Uox研究较少。因此以重组表达的苛求芽孢杆菌基因为基础,采用易错PCR或与其他尿酸氧化酶进行分子进化等技术,构建Uox基因突变库筛选和设计具有高耐热和pH稳定性Uox是今后研究的方向。
[1] Christen P, Peacock WC, Christen AE, et al. Urate oxidase in primate phylogenesis. EurJ Biochem, 1970, 12(1):3−5.
[2] Oda M, Satta Y, Takenaka O, et al. Loss of urate oxidase activity in hominoids and its evolutionary implications. Mol BiolEvol, 2002, 19(5):640−653.
[3] Wyngaarden JB. Overproduction of uric acid as the cause of hyperuricemia in primary gout. JClin Invest, 1957, 36(10):1508−1515.
[4] Wu XW, Lee CC, Muzny DM, et al. Urate oxidase: primary structure and evolutionary implications. ProcNatl Acad SciUSA, 1989, 86(23):9412−9416.
[5] Rai SK, Aviña-Zubieta JA, Mccormick N, et al. The rising prevalence and incidence of gout in British Columbia, Canada: Population-based trends from 2000 to 2012. Semin Arthritis Rheu, 2016, 46(4): 451–456.
[6] Conen D, Wietlisbach V, Bovet P, et al. Prevalence of hyperuricemia and relation of serum uric acid with cardiovascular risk factors in a developing country. Bmc Public Health, 2004, 4(1):9.
[7] Wu AH, Gladden JD, Ahmed M, et al. Relation of serum uric acid to cardiovascular disease. Int J cardiol, 2016, 213:4−7.
[8] Bieber JD, Terkeltaub RA. Gout: On the brink of novel therapeutic options for an ancient disease. ArthritisRheum, 2004, 50(8):2400−2414.
[9] Filiopoulos V, Hadjiyannakos D, Vlassopoulos D. New insights into uric acid effects on the progression and prognosis of chronic kidneydisease. Renal Fail, 2012, 34(4): 510−520.
[10] Chen ZY, He XP, Zhang BR, et al. Research progress on the microbial urate oxidase. Microbiol China, 2007, 34(6): 1205–1208 (in Chinese).陈志禹, 何秀萍, 张博润, 等. 微生物来源的尿酸氧化酶的研究进展及应用前景. 微生物学通报, 2007, 34(6): 1205−1208.
[11] Fazel R, Zarei N, Ghaemi N, et al. Cloning and expression ofurate oxidase in. Springerplus, 2014, 3(1):395.
[12] Mcleod MP, Warren RL, Hsiao WWL, et al. The complete genome ofsp. RHA1 provides insights into a catabolic powerhouse. Proc Natl Acad Sci USA, 2006, 103(42): 15582−15587.
[13] Deng Y, Zhu YG, Wang PX, et al. Complete genome sequence ofBSn5, an endophytic bacterium ofwith antimicrobial activity for the plant pathogensubsp. carotovora. J Bacteriol, 2011, 193(8): 2070−2071.
[14] Abdel-Fattah YR, Saeed HM, Gohar YM, et al. Improved production ofuricase by optimization of process parameters through statistical experimental designs. Process Biochem, 2005, 40(5): 1707−1714.
[15] Liao F, Zhao YS, Zhao LN, et al. Evaluation of a kinetic uricase method for serum uric acid assay by predicting background absorbance of uricase reaction solution with an integrated method. J Biomed Biotechnol, 2006, 7(6): 497−502.
[16] Cui BY, Li YH. Modified microdetermination of serum uric acid and its normal reference value. JMed College PLA, 1981, 7(2): 178–181 (in Chinese).崔宝印, 李亚虹. 改良血清尿酸微量测定法及正常参考值. 中国人民解放军军医进修学院学报, 1981, 7(2): 178−181.
[17] Enticknap JJ, Nonogaki H, Place AR, et al. Microbial diversity associated with odor modification for production of fertilizers from chicken litter. Appl EnvironMicrob, 2006, 72(6):4105−4114.
[18] Raji AI, Moller C, Litthauer D, et al. Bacterial diversity of biofilm samples from deep mines in South Africa. Biokemistri, 2008,20(2):53−62.
[19] Cummins P, Dowling O, O’Connor BF. Ion-exchange chromatography: basic principles and applicationto the partial purification of soluble mammalian prolyl oligopeptidase//Walls D, Loughran S, eds. Protein Chromatography. Methods in Molecular Biology. New York: Humana Press, 2011: 215–228.
[20] Li XQ, Bai XH, Liu CF. Study on the purification of moringa oleifera coagulant through gel filtration chromatography. Tropical Agr Sci Technol, 2008, 31(2): 35–37 (in Chinese). 黎小清, 白旭华, 刘昌芬. 凝胶过滤层析纯化辣木絮凝剂研究. 热带农业科技, 2008, 31(2): 35−37.
[21] Lineweaver H, Burk D. The determination of enzyme dissociation constant. J AmChemSoc, 1934, 56(3):658–666.
[22] Abd-Elsalam KA. Bioinformatic tools and guideline for PCR primer design. AfrJBiotechnol, 2003, 2(5):91−95.
[23] Robertson JM, Walshweller J. An introduction to PCR primer design and optimization of amplification reactions//Lincoln PJ, Thomson J, eds.Forensic DNA Profiling Protocols. Methods in Molecular Biology. New York: Humana Press, 1998: 121.
[24] Zhang XY, Zhu YN, Gao Y. To design PCR primers with Oligo 6 and Primer Premier 5.Bioinformatiocs,2004, 2(4): 15–18.
[25] Apte A, Daniel S. PCR primer design. Cold Spring Harb Protoc, 2009, 2009(3):pdbip65.
[26] Yoo D, Provchy J, Park C, et al. Automated high-throughput protein purification using an ÄKTApurifier and a CETAC autosampler. JChromatogr A, 2014, 1344:23−30.
[27] Zhao YS, Zhao LN, Yang GQ, et al. Characterization of an extracellular uricase from bacillus fastidious and its application in direct kinetic assay of serum uric acid. Acta Med Univ Sci Technol Huazhong, 2007, 36(2): 239–242 (in Chinese).
[28] Bongaerts GPA, Uitzetter J, Brouns R, et al. Uricase ofproperties and regulation of synthesis. Biochim Biophys Acta (BBA)-Enzymol, 1978, 527(2):348−358.
[29] Yu QL. Preparation and Identification of Bacillus uric Acid enzyme. J Clinical Lab Sci, 1994(3): 125–126 (in Chinese).于青琳. 芽胞杆菌尿酸酶的制备及鉴定. 临床检验杂志, 1994(3): 125−126.
[30] Legoux R, Delpech B, Dumont X, et al. Cloning and expression in Escherichia coli of the gene encodingurate oxidase. J Biol Chem, 1992, 267(12): 8565−8570.
[31] Koyama Y, Ichikawa T, Nakano E. Cloning, sequence analysis, and expression inof the gene encoding theurate oxidase (Uricase). J Biochem, 1996, 120(5): 969−973.
[32] Zhou XL, Ma XH, Sun GQ, et al. Isolation of a thermostable uricase-producing bacterium and study on its enzyme production conditions. Process Biochem, 2005, 40(12): 3749−3753.
[33] Chen ZY, Wang ZY, He XP, et al. Uricase production by a recombinantstrain harboringuricase gene. Appl Microbiol Biotechnol, 2008, 79(4): 545−554.
[34] Kai L, Ma XH, Zhou XL, et al. Purification and characterization of a thermostable uricase fromsp. strain ZZJ4-1. World J Microbiol Biotechnol, 2008, 24(3): 401−406.
[35] Li X, Feng J, Zhang C, et al. Effects of reaction conditions on interactions of some purine derivatives with the intracellular uricase from. Chin J Appl Environ Biol, 2011, 17(1): 91–94 (in Chinese)李想, 冯娟, 张纯, 等. 反应条件对苛求芽孢杆菌胞内尿酸酶与嘌呤衍生物作用的影响. 应用与环境生物学报, 2011, 17(1): 91−94.
[36] Suzuki K, Sakasegawa S, Misaki H, et al. Molecular cloning and expression of uricase gene frominand characterization of the gene product. J Biosci Bioeng, 2004, 98(3): 153−158.
[37] Zhang PC. Cloning expression and characterization of urate oxidase gene fromsp. ZZJ4-1 strain in. Hangzhou: Zhejiang University [D], 2012 (in Chinese).张鹏程. 微杆菌sp. ZZJ4-1尿酸氧化酶基因的克隆表达及重组酶性质的研究[D]. 杭州: 浙江大学, 2012.
(本文责编 郝丽芳)
Screening, characterization and expression of microbial urate oxidase
Jingnü Xian, Xin Guo, Bo Li, Haibo Peng, Xiaolong Wang, Jianye Zhang, and Gang Chen
Ocean University of China, Qingdao 266007, Shandong, China
Urate oxidase (Uox), an enzyme catalyzing oxidation of uric acid to allantoin, is widely used as diagnostic reagents and for treatments of uarthritis and hyperuricemia diseases. In our study, a higher Uox producer, bacterial strain OUC-1, was isolated from soil samples. The 16S rRNA gene sequence of strain OUC-1 showed 99% identity to the homologous fragments of. After purification, Uox showed the optimal pH and temperature was 10.0 and 40 °C. Themvalue of Uox was (0.15±0.04) mmol/L (=5) with uric acid as the substrate. Uox activity was enhanced by Mg2+, and seriously inhibited by Zn2+and SDS. Then thegene ofOUC-1 was amplified and sequenced. The 3D structures of Uox, predicted with SWISS-MODEL, showed a homotetramer structure with a subunit molecular weight of 35.38 kDa. Finally, the gene coding for theUox was successfully cloned and heterologously expressed in,which provides theoretical basis and technical support for improvement of Uox in the future.
urate oxidase,OUC-1, enzymatic properties, recombinant urate oxidase
December 27, 2017;
February 26, 2018
National Natural Science Foundation of China (No. 41476090).
Gang Chen. E-mail: chengang@ouc.edu.cn
国家自然科学基金 (No. 41476090) 资助。
2018-03-26
http//kns.cnki.net/kcms/detail/11.1998.Q.20180326.0926.002.html
10.13345/j.cjb.170524
