MicroRNA-29b表达改变对卵巢癌细胞增殖及侵袭的影响
2018-07-30季晓微刘素英
季晓微, 王 琳, 徐 军, 刘素英, 董 曦
复旦大学附属中山医院生殖医学中心,上海 200032
卵巢癌已成为目前威胁女性健康的常见恶性肿瘤之一。卵巢癌早期发病隐匿,缺乏特异性高的诊断技术,超过70%的患者在确诊时已处于晚期;并且其侵袭速度快、复发率高,患者的5年生存率低于30%[1]。因此,探索特异性强、灵敏度高的诊疗靶点成为目前亟待解决的热点问题。
MicroRNA(miRNA)是一类具有调控靶基因转录水平的内源性小分子非编码RNA,能通过与靶基因mRNA的3′非翻译区特异性结合,抑制mRNA的转录水平,实现对功能基因表达的调控,从而参与多种肿瘤细胞增殖和侵袭等恶性生物学行为的调控[2]。研究证实,miRNA-29b是一种能够发挥抑癌作用的microRNA分子。目前已经在多种恶性肿瘤中发现miRNA-29b的表达异常下降,包括肺癌、乳腺癌、胰腺癌、黑素瘤等多种肿瘤[3-4]。因此,本研究拟观察miRNA-29b对人卵巢癌细胞增殖的调控作用及其分子机制,旨在为卵巢癌的早期诊断和靶向治疗提供潜在的靶点。
1 材料与方法
1.1 主要试剂及仪器 人卵巢癌上皮细胞系SKOV-3及人正常卵巢上皮细胞系IOSE80购自美国ATCC细胞库;细胞培养试剂(DMEM培养基、胎牛血清、链霉素青霉素、胰蛋白酶)购自美国Gibco公司;细胞增殖活性检测试剂盒Cell Counting Kit-8购自日本同仁化学研究所;ECL化学发光试剂和BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;miRNA提取试剂盒、miRNA反转录和荧光定量试剂盒、LipofectamineTM2000转染试剂盒均购自美国Invitrogen公司;miRNA-29b mimic、mimic control miRNA由上海吉玛制药技术有限公司合成,miRNA-29b和U6引物由生工生物工程(上海)股份有限公司设计合成,其他常用生化试剂购自美国Sigma公司。
1.2 细胞培养 人卵巢癌上皮细胞系SKOV-3及人正常卵巢上皮细胞系IOSE80复苏后,使用含10%胎牛血清和1%双抗的DMEM培养基进行培养,恒温细胞培养箱条件为37℃、5% CO2,每天更换1次培养基,细胞融合度>80%进行消化、传代和接种,用于后续研究。
1.3 miRNA-29b表达水平的检测 采用real-time PCR检测SKOV-3细胞和IOSE80细胞中miRNA-29b表达水平。收集对数生长期SKOV-3细胞和IOSE80细胞,使用TRIzol试剂提取细胞总RNA,使用反转录试剂进行反转录得到总cDNA,使用荧光定量试剂进行定量,miRNA-29b表达检测使用U6作为内参。miRNA-29b相对表达按照2-ΔΔCt进行计算。
1.4 细胞转染 处于对数生长期的SKOV-3细胞消化收集,按照106/孔的密度接种于六孔板中,经过24 h培养后,使用LipofectamineTM2000转染试剂按照试剂盒操作方案将miRNA-29b mimic和mimic control miRNA分别转染到SKOV-3细胞中。将细胞分为空白组(Blank)、阴性对照组(Negative control)及miRNA-29b转染组(miRNA-29b)。
1.5 细胞增殖能力检测 采用CCK-8试剂检测SKOV-3细胞增殖能力,收集对数生长期的细胞,按照104/孔的密度接种于96孔板,细胞分组同上述3组,实验操作按照CCK-8试剂盒进行,采用全自动酶标仪检测光密度(D490)值,计算各组细胞增殖能力。
1.6 细胞侵袭能力检测 采用Transwell法检测miRNA-29b转染对SKOV-3细胞侵袭能力的影响。使用浓度为1 mg /mL的Matrigel胶体提前将Transwell培养板的上室进行包被,下室加入DMEM培养基,正常培养24 h后取出,放置于显微镜下随机选取视野进行计数。
1.7 细胞蛋白表达水平检测 采用Western 印迹法检测细胞中蛋白的表达水平。细胞分组同上,使用RIPA细胞裂解液裂解细胞得到总蛋白,使用BCA法进行蛋白浓度定量,使用SDS-PAGE进行蛋白电泳,使用PVDF膜进行电转,经4℃封闭过夜,次日使用相应二抗孵育后通过ECL试剂进行化学发光,定量检测目标蛋白表达水平。
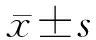
2 结 果
2.1 miRNA-29b在不同细胞中的表达差异 结果(图1)显示:人卵巢癌上皮细胞系SKOV-3细胞中miRNA-29b的表达显著下降,与人正常卵巢上皮细胞系IOSE80细胞差异有统计学意义(P<0.01)。
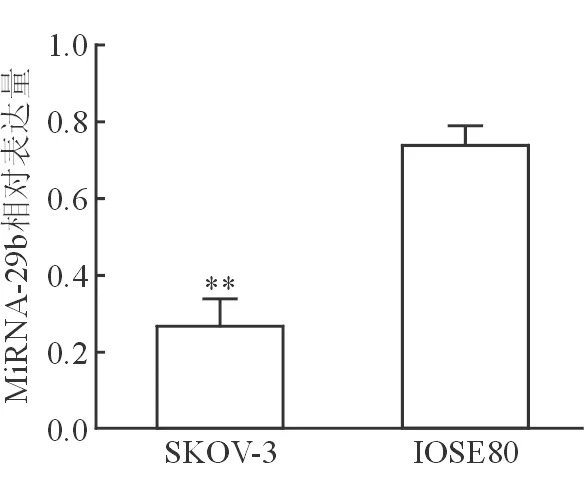
图1 不同细胞中miRNA-29b的相对表达水平
2.2 miRNA-29b mimic转染对SKOV3细胞增殖能力的影响 结果(图2)表明:SKOV3细胞转染miRNA-29b mimic后,细胞中miRNA-29b的表达上调,与阴性对照组差异有统计学意义(P<0.01)。CCK-8法检测结果(图3)显示:转染miRNA-29b组SKOV3细胞从第4天开始增殖能力下降,明显低于阴性对照组细胞(P<0.05)。而空白组及阴性对照组差异无统计学意义,证实miRNA-29b表达能够抑制SKOV3细胞增殖。

图2 各组细胞中miRNA-29b的表达水平
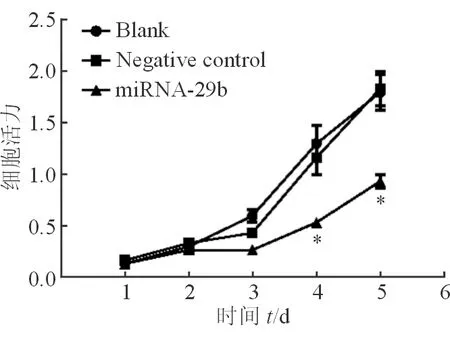
图3 各组细胞增殖能力的对比
2.3 miRNA-29b转染对SKOV3细胞侵袭能力的影响 结果(图4)显示:转染miRNA-29b显著减少了通过聚碳酸酯膜的SKOV3细胞数量,抑制了SKOV3细胞的侵袭能力,与阴性对照组相比差异有统计学意义(P<0.01),而空白组及阴性对照组相比差异无统计学意义。
2.4 miRNA-29b转染对凋亡相关蛋白Bcl-2和侵袭相关蛋白MMP-9表达的影响 结果(图5)显示:转染miRNA-29b mimic后,卵巢癌细胞SKOV3中抑制凋亡蛋白Bcl-2和侵袭相关蛋白MMP-9的表达均下调,与阴性对照组相比差异有统计学意义(P<0.05);空白组及阴性对照组差异均无统计学意义。

图4 各组细胞侵袭能力的对比

图5 各组细胞中Bcl-2和MMP-9蛋白表达水平的对比
3 讨 论
恶性肿瘤的发生涉及人体多种原癌基因和抑癌基因的表达失衡。与其他恶性肿瘤一样,卵巢癌的发生发展是多因素影响下的多基因、多步骤的恶性增殖的动态过程,其中miRNA所调控的基因表达机制在卵巢癌的发生发展中发挥了重要作用。miRNA-29是在2003年由Dostie等[5]在人神经元中发现,其编码序列位于人体染色体的1q32.2:207801852-207801939位点。miRNA-29家族成员主要包括miRNA-29a、miRNA-29b和miRNA-29c,其中miRNA-29b主要定位于细胞核中,能够与多种目标靶基因的mRNA发生特异性结合,从而在调控目标基因的表达水平[5]。Wang等[6]研究证实,人乳腺癌组织中miRNA-29b的表达异常增加;以人乳腺癌细胞MDA-MB-231为模型,发现抑制miRNA-29b的表达后能够促进抑癌蛋白PTEN的表达,从而抑制乳腺癌细胞的增殖和侵袭能力。而在人前列腺癌细胞PC3和LNCaP中,miRNA-29b的表达下降;通过慢病毒转染增强前列腺癌细胞中miRNA-29b的表达水平,能够显著抑制前列腺癌细胞的侵袭能力,其作用可能与E-cadherin相关信号通路有关[7]。在原发性肝癌中,血清miRNA-29b的表达下降程度与患者的疾病进展和预后显著相关,证实miRNA-29b在原发性肝癌中发挥抑癌作用[8]。本研究中,人卵巢癌上皮细胞系SKOV-3细胞中miRNA-29b的表达下降;与IOSE80细胞相比,转染miRNA-29b mimic后,SKOV-3细胞中miRNA-29b的表达水平增加,SKOV3细胞增殖能力从第4天开始下降,同时SKOV3细胞的侵袭能力下降,初步证实了miRNA-29b在卵巢癌中发挥了抑癌基因的作用。
B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)是重要的细胞凋亡蛋白之一。研究认为,Bcl-2能够显著抑制由多种细胞毒因素(如化疗)所引起的凋亡机制,同时能够增强肿瘤细胞对DNA损伤因子的抗性,可作为原发性上皮性卵巢癌的耐药性和预后判断的预测因子[9]。本研究发现,转染miRNA-29b mimic后,卵巢癌细胞SKOV3中抑制凋亡蛋白Bcl-2的表达降低,与阴性对照组相比差异有统计学意义(P<0.05)。基质金属蛋白酶-9(matrix metalloprotein-9, MMP-9)能够降解细胞外基质的锌离子依赖型内肽酶,与多种恶性肿瘤的侵袭性密切相关[10]。已有研究发现,MMP-9在卵巢癌组织中高表达,且其表达水平与卵巢癌患者的生存期负相关[11]。而Zou等[12]的研究显示,MMP-9调控卵巢癌细胞的侵袭能力是与IL-6的介导作用密切相关。转染miRNA-29b mimic后,卵巢癌细胞SKOV3中侵袭相关蛋白MMP-9的表达降低,与阴性对照组相比差异有统计学意义(P<0.05)。
综上所述,本研究发现,miRNA-29b能够抑制卵巢癌细胞的增殖和侵袭能力,具有作为卵巢癌早期诊断和靶向治疗的分子靶点的潜在价值,其作用可能通过抑制凋亡相关蛋白Bcl-2和侵袭相关蛋白MMP-9的表达来实现。
