PC4基因RNAi慢病毒载体的构建及有效靶序列鉴定
2018-07-30张真中杨春杰钱三立李冰玉邹云增
张真中, 杨春杰, 钱三立, 李冰玉, 邹云增
复旦大学附属中山医院上海市心血管病研究所,上海 200032
以往认为,哺乳动物的心肌细胞是终末分化细胞,不可再生。然而,近年来一系列研究表明,哺乳动物的少量心肌细胞能够再生。根据大气层中(14C)的变化,推测成人心肌细胞的年再生速率约为1%[1];出生7 d内的小鼠心脏在损伤后可以再生[2-4]。在动物中发现的再生心肌细胞由心肌细胞增殖而来,而非干细胞或者心肌祖细胞的分化形成[5]。然而,成熟心肌细胞再生的分子调控机制目前还不清楚。
本课题组前期研究发现,在通过二甲基亚砜(DMSO)定向诱导P19CL6细胞分化为心肌细胞的过程中,PC4发挥重要作用[6]。PC4是一个高丰度核蛋白,在基因转录、复制、修复和细胞转化过程中扮演重要角色。研究[7-8]报道,PC4为转录共激活因子,为成肌细胞分化所必需[7-8]。本研究采用慢病毒载体介导的RNA干扰技术降低大鼠心房肌细胞H9C2中PC4基因的表达,筛选出了有效的PC4 RNA干扰序列,现报告如下。
1 材料与方法
1.1 细胞株的来源及培养 H9C2和HEK-293T细胞株购自中国科学院典型培养物保藏委员会细胞库,由上海心血管疾病研究所液氮保种。H9C2细胞采用含10%胎牛血清的DMEM/F12培养基培养;HEK-293T细胞采用含10%胎牛血清的DMEM培养基培养。DMEM/F12培养基(11320-033)和DMEM培养基(11965-084)以及胎牛血清(10099-141)均购自Gibco公司。
1.2 候选干扰靶序列的设计及合成 通过Bioinformatics & Research Computing数据库(http://sirna.wi.mit.edu/)筛选3条潜在的PC4干扰靶序列,分别为shPC4-1、shPC4-2和shPC4-3,具体位置见图1。干扰靶序列(表1)由生工生物工程(上海)股份有限公司合成。

图1 PC4干扰靶序列设计示意图

名称 序列shPC4-1F5'-CTA GCA GAG ATG ATA ACA TGT TCC AGA CTC GAG TCT GGA ACA TGT TAT CAT CTC TGT TTT TG-3'shPC4-1R5'-AAT TCA AAA ACA GAG ATG ATA ACA TGT TCC AGA CTC GAG TCT GGA ACA TGT TAT CAT CTC TG-3'shPC4-2F5'-CCG GGG GCA TAT CAA GTC CAT TAT TCT CGA GTA ATG GAC TTG ATA TGC CCT TTT TTT G-3'shPC4-2R5'-AAT TCA AAA AGG GCA TAT CAA GTC CAT TAT TCT CGA GTA ATG GAC TTG ATA TGC CCT T-3'shPC4-3F5'-CTA GCC CAG ACT ACA TGG AGT CAA ATC TCG AGA TTT GAC TCC ATG TAG TCT GGG TTT TTG-3'shPC4-3R5'-AAT TCA AAA ACC CAG ACT ACA TGG AGT CAA ATC TCG AGA TTT GAC TCC ATG TAG TCT GGG-3'
1.3 慢病毒载体的构建、鉴定及转染效率的测定 使用二代慢病毒包装系统包装PC4慢病毒shPC4,所用的载体均来源于Addgene数据库,分别为干扰载体pLKO.1 puro、干扰对照载体pLKO.1 puro GFP、包装载体psPAX2和pMD2.G。使用AgeⅠ(R0552)和EcoRⅠ(R0101)内切酶(NEB公司)将pLKO.1 puro载体的多克隆位点进行双酶切,将干扰靶序列克隆到pLKO.1 puro载体上,PCR鉴定结果。
将重组的PC4-pLKO.1 puro,以及包装质粒和包膜质粒PC4-psPAX2、PC4-pMD2.G共同转染入HEK-293T细胞中,包装成慢病毒shPC4;对照组用pLKO.1 puro GFP代替PC4-pLKO.1 puro。H9C2心肌细胞培养48 h后转染慢病毒,继续培养48 h后荧光显微镜下观察转染效率。
1.4 不同靶序列干扰效果的对比
1.4.1 qRT-PCR检测PC4基因表达 取慢病毒感染3 d的H9C2心肌细胞,采用天根生化科技(北京)有限公司培养细胞/细菌总RNA提取试剂盒[DP430,天根生化科技(北京)有限公司]提取细胞RNA,经反转录后使用SYBR Premix EX Taq试剂盒(RR820A,TaKaRa公司)进行荧光实时定量PCR,引物信息见表2。

表2 qRT-PCR引物信息
1.4.2 Western印迹法检测PC4蛋白表达 取慢病毒感染4 d的H9C2心肌细胞,采用RIPA裂解液(P0013C,碧云天公司)提取慢病毒感染4 d的H9C2心肌细胞的总蛋白;用Pierce BCA Protein Assay Kit(23225,Thermo公司)测定总蛋白浓度。用Western印迹检测PC4的表达(将GAPDH作为对照)。PC4抗体(11956-1-AP)购自Proteintech公司,GAPDH(ab9485)购自Abcam公司。
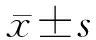
2 结 果
2.1 慢病毒载体的构建、鉴定及包装 PC4与pLKO.1 puro、psPAX2、pMD2.G、pLKO.1 puro GFP重组质粒经酶切、测序显示,构建成功(图2)。pLKO.1 puro GFP、psPAX2、pMD2.G重组质粒经HEK-293T细胞包装24 h后,发荧光的细胞比例占90%,提示包装成功(图3A)。

图2 shPC4慢病毒载体构建后酶切鉴定图
1. Marker; 2: shPC4-1质粒酶切片段; 3: shPC4-2质粒酶切片段; 4: shPC4-3质粒酶切片段; 5: pLKO质粒
2.2 shPC4慢病毒干扰效果 H9C2心肌细胞转染慢病毒shPC4,同时使用pLKO.1 puro GFP慢病毒作为阴性对照。pLKO.1 puro GFP慢病毒感染心肌细胞72 h后,绿色荧光的细胞占85%以上(图3B),说明包装出来的慢病毒能够有效感染心肌细胞。

图3 荧光显微镜下慢病毒载体的包装及转染细胞表现
A:HEK-293T细胞转染重组质粒24后;B:H9C2心肌细胞转染慢病毒后. Original magnification: ×200
2.3 不同靶序列shPC4慢病毒干扰效果对比 将慢病毒感染3、4 d的心肌细胞提取RNA和蛋白,从转录水平和蛋白水平分别检测3条候选靶序列对心肌细胞的PC4基因干扰效率。qRT-PCR结果表明:shPC4-1可使心肌细胞中PC4基因的表达水平下降60%,其抑制效率最高(P<0.05,图4A);蛋白免疫印迹表明:shPC4-1慢病毒质粒转染后抑制效率最高(P<0.05,图4B)。

图4 慢病毒转染心肌细胞后PC4基因(A)及蛋白(B)的表达
3 讨 论
PC4蛋白是只有127个氨基酸组成的细胞核冗余蛋白,首先在HeLa细胞系的核提取物中被发现。体外发现其N端具有增强转录的活性;C端能分别结合单链DNA和双链DNA,特别是对没有配对的DNA具有强亲和力[9]。此外,PC4能够与多个转录因子直接相互作用,从而增强其活性,如VP16、GAL4、AP2、SP1、TAT、TFIIB、p53等[9-11]。PC4与不同的转录因子作用位点不同。其能够结合在VP16、GAL4、AP2的活性区,TAT的RNA结合区,SP1和p53的DNA结合区,p53的C端调控区。这表明PC4在介导不同转录因子时作用机制不同。
PC4蛋白存在翻译后修饰,主要包括磷酸化修饰和乙酰化修饰。研究[12]发现,酪蛋白激酶2 (casein kinase Ⅱ,CKⅡ)可磷酸化PC4;PC4 的N端有一段富含丝氨酸的氨基酸序列(3~22),CKⅡ能同时磷酸化该区域的7~8个丝氨酸,从而抑制PC4的共激活功能。研究[13]发现,PC4能够被另一个转录共激活子p300乙酰化,从而促进PC4结合双链DNA的能力。此外,PC4磷酸化能抑制PC4乙酰化,而PC4乙酰化对其磷酸化没有影响[13]。
在世界范围内,心血管疾病正逐渐成为发病率和致死率的首要原因。哺乳动物心脏损伤后不能再生可能是心血管疾病患者死亡率高的原因。本研究首次报道用慢病毒载体系统介导的RNA干扰技术建立心肌细胞PC4敲除模型。慢病毒载体系统介导的RNA干扰技术可以作为一种快速、有效降低目的基因表达的研究手段。本研究成功构建了PC4 RNA干扰慢病毒表达载体PC4-pLKO.1 puro,经HEK-293T细胞包装后转染心肌细胞,感染效率达85%。qRT-PCR和Western印迹检测显示,3对干扰靶序列能不同程度降低PC4基因的表达量,第1对靶序列的干扰作用最明显。本结果为后期进一步研究PC4基因在心脏中的作用机制奠定了基础。
