组氨酸脱羧酶及组胺受体在前列腺癌中的表达及意义
2018-07-30胡晓勇
陈 俊 胡晓勇 傅 强
上海交通大学附属第六人民医院(上海 200233)
前列腺癌是威胁欧美等发达国家男性健康的最常见肿瘤,最近的研究显示,在美国男性新发癌症患者中,前列腺癌所占的比例接近20%,而由前列腺癌所导致的死亡患者也接近所有男性癌症患者死亡人数的10%,排名第三[1],在中国,前列腺癌的发病率也逐年增加并且已经成为泌尿外科男性患者中发病率最高的肿瘤[2]。目前,针对前列腺癌的治疗虽然有根治性手术、放化疗、雄激素剥夺疗法等多种选择,但复发性和转移性前列腺癌最终会进展为“去势抵抗前列腺癌”,而且90%的去势抵抗型前列腺癌会发生转移并成为前列腺癌死亡的主要原因[3]。因此,进一步探明前列腺癌尤其是去势抵抗型前列腺癌的新疗法以延长患者生存期、改善生存质量具有十分重要的意义。
前列腺癌的发病过程已经被发现是从激素敏感型发展为去势抵抗型,在这个转化过程中,雄激素的异常分泌和雄激素受体的过量表达或者突变是非常重要的相关因素。已有文章指出组胺可以直接激活雄激素受体[4],从而引发核转录的变化,当然组胺也作用于组胺受体(一种G蛋白偶联受体)而间接影响雄激素受体。组胺在100多年前就被Dale等发现和提取[5]。它是一种血管活性物质,存在于机体多个部位,广泛参与各种生理和病理过程,也被报道与多种肿瘤的形成、发展和转移相关,像胃癌、结直肠癌、白血病、乳腺癌、黑色素瘤等[6-9]。组胺作为一种配体,需要结合于组胺受体才能发挥生理学功能,组胺受体为G蛋白耦联受体,可分为4类,即组胺1型受体(histamine h1 receptor,HRH1)、组胺2型受体(HRH2)、组胺3型受体(HRH3)和组胺4型受体(HRH4)。组胺受体也已被报道在多种肿瘤中高表达,如组胺受体HRH3在恶性胶质瘤内高表达,且和肿瘤的生长、转移和上皮间质转化相关[10]。
然而,目前关于组胺和组胺受体在前列腺癌中的表达和作用的报道尚少,并且大都是选择其中某个受体直接进行研究[11],没有说明为什么选择这个组胺受体。因此,我们想系统探索4种组胺受体在前列腺癌中的表达情况,希望能给后续实验者有所指导。另外,组胺是从组氨酸脱羧而来,组氨酸脱羧酶(histidine decarboxylase,HDC)是催化这个过程的关键酶,我们也探索HDC的表达试图观察组胺信号是否在前列腺癌中被激活。本实验选择前列腺癌组织芯片和前列腺癌细胞来进行研究,选择前列腺癌LNCaP细胞代表阳性表达雄激素受体的激素敏感型前列腺癌,选择前列腺癌PC-3细胞代表阴性表达雄激素受体的去势抵抗型前列腺癌,选择前列腺癌22RV1细胞代表阳性表达雄激素受体的去势抵抗型前列腺癌,以揭示可能存在的组胺受体和雄激素受体之间的关联。
材料和方法
一、材料
正常人前列腺上皮细胞RWPE-1、前列腺癌细胞PC-3、LNCaP、22RV1细胞购于中国科学院上海细胞所,前列腺癌组织芯片购于西安艾丽娜生物科技有限公司; 胎牛血清、青-链霉素、胰蛋白酶购自美国GIBCO公司;RPMI-1640培养基、PBS购于美国Hyclone公司;RNA提取试剂盒、逆转录试剂盒、SYBR Green荧光定量试剂盒购自日本TAKARA公司、HDC、HRH1-4引物均由上海生工设计和合成;蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒购自江苏碧云天生物科技有限公司;化学发光液购自美国Millipore公司;HDC抗体购自美国SANTA CRUZ公司;HRH1、HRH2、HRH3、HRH4抗体购自英国ABCAM公司;HRP标记的羊抗兔、羊抗鼠、兔抗羊二抗购自美国CST公司。
二、细胞培养和传代
正常前列腺上皮细胞RWPE-1培养于RPMI-1640培养基加入20%胎牛血清和1%青-链霉素;前列腺癌细胞PC-3、LNCaP、22RV1细胞培养于RPMI-1640培养基加入10%胎牛血清和1%青-链霉素,2~3d换液一次,当细胞密度长至80%~90%时进行传代,吸除旧的培养基,PBS清洗一次,然后加入胰蛋白酶消化,以1 : 3~6的比例进行传代。
三、实时荧光定量聚合酶链式反应
实时荧光定量聚合酶链式反应(Real-time fluorescence quantitative polymerase chain reaction,RT-qPCR): 利用RNA提取试剂盒提取细胞RWPE-1、PC-3、LNCaP、22RV1的总RNA,再用逆转录试剂盒将提取的RNA逆转录为互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),最后利用SYBR Green试剂盒进行实时荧光定量PCR反应,利用2-ΔΔCT法计算基因相对表达量[12]。
四、免疫蛋白印迹(Western blot)
利用蛋白裂解液RIPA裂解细胞RWPE-1、PC-3、LNCaP、22RV1,提取总蛋白,再用蛋白定量试剂盒对提取的蛋白进行定量,然后加入loading buffer将蛋白煮沸变性进行SDS-PAGE聚丙烯酰胺凝胶电泳,转移至PVDF膜上进行封闭和抗体孵育,最后在LAS 4000 mini机器下曝光,条带经Image J 软件分析计算灰度值。
五、免疫组化
组织芯片制作方法参照文献[13],然后依次经过脱蜡、修复、封闭、孵育一、二抗、DAB显色后用苏木素复染、脱水和封片。最后在Nikon Eclipse 80i显微镜下观察并拍照,使用阴性(-)、弱阳性(+)、中等阳性(++)、强阳性(+++)表示染色的结果[14]。
六、统计学方法
应用SPSS 22.0软件和GraphPad Prism 5软件进行统计学分析和作图,计量资料采用(±s)表示;计量资料组间比较满足正态分布性和方差齐性者,单组和两组的独立样本采用t检验,多组比较则采用单因素方差分析,以P<0.05认为有统计学意义;计数资料间的比较采用U检验;Spearman相关表示HDC蛋白表达强弱和前列腺癌临床分期间的相关性。
结 果
一、HDC蛋白在前列腺癌组织芯片中的表达
在芯片的39例前列腺癌组织(芯片共有40例前列腺癌组织,其中1例脱片,剩下39例)和8例正常对照组织的染色中,我们发现HDC蛋白表达于胞质内,所有39例癌组织均阳性表达HDC蛋白(100%)而正常前列腺组织只有3例(3/8)弱阳性表达HDC蛋白,阳性率为37.5%(图1和表1),差异具有统计学意义(P<0.01)。

表1 芯片中不同前列腺组织的HDC蛋白阳性表达

图1 HDC蛋白在前列腺癌组织芯片中的表达
二、HDC蛋白表达和肿瘤临床分期的关系
在39例前列腺癌组织中,经Spearman相关分析显示,HDC表达的强弱和肿瘤分期呈现正相关(r =0.334, P=0.037),随着前列腺癌临床分期的升高,HDC的表达也增强(表2)。
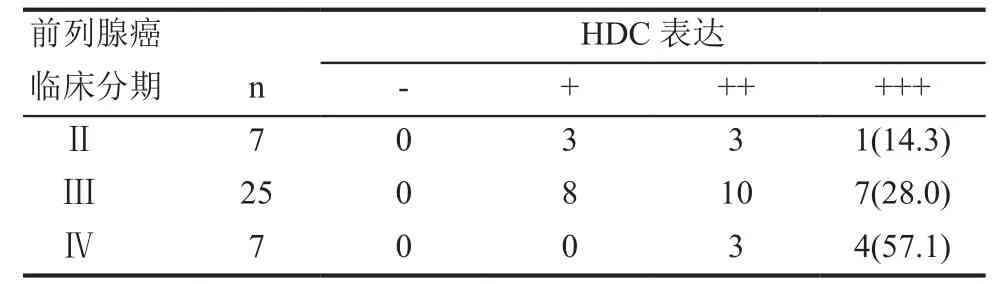
表2 HDC表达量和前列腺癌临床分期的关系 n(%)
三、HDC在前列腺上皮和前列腺癌细胞中的表达
通过将RWPE-1细胞的RNA表达量作为对照,RT-qPCR显示HDC基因在PC-3、LNCaP、22RV1细胞的相对表达量分别为0.85±0.16、4.19±2.16和1.67±0.75,三者分别与RWPE-1细胞之间比较均没有统计学差异;但是Western blot显示HDC蛋白在PC-3、LNCaP、22RV1细胞的相对表达量分别为2.31±0.20、2.33±0.31和1.44±0.11,三者分别与RWPE-1细胞比较均有统计学差异(P<0.01)(图2A,图2B),结果和免疫组化一致,表明HDC在前列腺癌细胞中表达高于正常前列腺上皮细胞,提示在前列腺癌细胞中存在高浓度的组胺。
四、组胺受体在前列腺上皮和前列腺癌细胞中的表达(图2)
HRH1基因:通过将RWPE-1细胞的RNA表达量作为对照,PC-3、LNCaP、22RV1细胞的HRH1基因的mRNA的相对表达量分别为1.59±0.03、0.004±0.001和0.002±0.002,三者分别与REPE-1细胞比较均有统计学差异(P<0.01);PC-3、LNCaP、22RV1细胞的HRH1基因的蛋白的相对表达量分别为2.36±0.85、2.97±1.20和2.27±0.88,三者与RWPE-1细胞比较,仅LNCaP差异有统计学意义(P<0.05)(图2C,图2D)。HRH2基因:通过将RWPE-1细胞的RNA表达量作为对照,PC-3、LNCaP、22RV1细胞的HRH2基因的mRNA的相对表达量分别为0.19±0.04、0.11±0.09和0.05±0.03,三者与RWPE-1比较均有统计学差异(P<0.01);PC-3、LNCaP、22RV1细胞的HRH2基因的蛋白的相对表达量分别为1.94±0.14、2±0.16和1.56±0.15(图2E,图2F),三者与RWPE-1比较也均有统计学差异(P<0.01)。HRH3基因:通过将RWPE-1细胞的RNA表达量作为对照,PC-3、LNCaP、22RV1细胞的HRH3基因的mRNA的相对表达量分别为0.62±0.36、37.25±2.01和678.47±67.41(P<0.01),三者分别与RWPE-1比较,后两者有统计学差异(P<0.01);PC-3、LNCaP、22RV1细胞的HRH3基因的蛋白的相对表达量分别为11.79±4.71、12.84±4.27和8.76±3.47(图2G,图2H),三者分别与RWPE-1比较,均有统计学差异(P<0.05,P<0.01和P<0.05)。HRH4基因:通过将RWPE-1细胞的RNA表达量作为对照,PC-3、LNCaP、22RV1细胞的HRH4基因的mRNA的相对表达量分别为2.65±1.01、3.12±0.82和5.03±1.67,三者分别与RWPE-1比较均有统计学差异(P<0.05);PC-3、LNCaP、22RV1细胞的HRH4基因的蛋白的相对表达量分别为1.49±0.17、1.81±0.38和 2.05±0.36(图2I,图2J),三者分别与RWPE-1比较均有统计学差异(P<0.05,P<0.01和P<0.01)。

图2 组胺受体基因HRH1-4和HDC在RWPE-1、PC-3、LNCaP、22RV1细胞系RNA和蛋白(protein)水平的表达情况与RWPE-1比较,*P<0.05,**P<0.01
讨 论
组胺和组胺受体广泛分布于人体组织中,像肺、胃肠道和皮肤等,并且参与各种生理和病理过程,如皮肤过敏反应,各种胃肠道反应,脓毒症和神经传递。早期研究发现组胺在肿瘤的形成和转移中发挥重要作用,许多研究认为组胺会促进肿瘤的生长和转移[15]。通过统计多个数据库,也有学者发现组胺受体基因和肿瘤存在相关性[16]。由于组胺受体拮抗剂可以阻断组胺的作用,而组胺受体拮抗剂已经长时间用于临床治疗多种疾病,像H1受体拮抗剂用于治疗过敏,H2受体拮抗剂用于治疗胃酸过多等疾病,是一种易于获得且价格低廉的药物。有研究认为组胺受体拮抗剂如西咪替丁具有抑制肿瘤的作用[17],后续也出现了许多相关的研究,比如将组胺受体拮抗剂和其他药物联合使用产生协同的抗肿瘤作用或者单独的组胺受体拮抗剂本身就可以治疗肿瘤[10,18],其中有学者发现组胺受体拮抗剂可以抑制前列腺癌细胞PC-3和DU-145的生长[11]。这些研究都提示组胺可能参与了某些肿瘤的形成、发展过程,组胺受体拮抗剂可以发挥抑制这些肿瘤的作用,但是,缺乏对机制和具体作用的靶点受体的研究和解释。
本研究发现,催化组胺生成的关键酶HDC不管在前列腺癌组织还是培养的前列腺癌细胞中都比正常的前列腺上皮表达量高,提示前列腺癌中存在高浓度的组胺,组胺信号在前列腺癌中激活加强,组胺可激活雄激素受体[4],导致细胞核转录变化,从而诱发前列腺癌。另外,在前列腺癌中,HDC的表达强弱和前列腺癌的临床分期呈正相关,提示HDC可能具有指示前列腺癌临床进展的作用。现有的临床最常用的前列腺癌筛查和治疗效果评估指标为前列腺特异抗原(prostate specific antigen,PSA),但良性前列腺增生、前列腺炎、前列腺外伤、检查操作等均可造成血清PSA水平的升高,提示PSA为非肿瘤特异性,其对前列腺癌的早期诊断缺乏敏感性和特异性,易造成假阳性率增高,不宜单独应用[19],而且前列腺癌早期临床症状不明显,许多患者诊断时已经是晚期,甚至到了远处转移阶段,因此,前列腺癌的早期筛查非常重要。我们的研究发现HDC和前列腺癌的临床分期呈正相关,因此其或许可以作为PSA的有效补充,以提高前列腺癌的早期筛查率,让更多的患者获益。
在前列腺癌的发生、发展过程中,雄激素和雄激素受体发挥了非常重要的作用,雄激素与胞质内的雄激素受体结合,导致雄激素受体构象改变,最终雄激素受体入核,从而引起多种生物活性分子的激活或抑制,对肿瘤的发生和发展起着关键的作用,因此,抗雄治疗成为了临床上常用的治疗前列腺癌的手段。在3种不同表达雄激素受体的细胞系中,结果显示HDC和组胺受体在阳性表达雄激素受体的细胞(LNCaP和22RV1)中的表达更强,提示在组胺受体和雄激素受体间可能存在协同情况。组胺和激活的组胺受体可以影响雄激素受体[4],从而触发雄激素受体的生理功能,诱导核转录等过程的变化,打开前列腺癌生长的开关,因此,组胺受体拮抗剂被发现具有抑制肿瘤的作用。本研究发现在前列腺癌细胞中,组胺受体处于高表达状态,证实了在前列腺癌中组胺信号被激活的设想,因此,进一步的研究应针对抑制组胺和组胺受体进行开展,从而更加深入揭示组胺、组胺受体在前列腺癌中发挥的功能。综上,我们发现HDC和组胺受体在前列腺癌中表达增强,并且和前列腺癌的临床分期密切相关,这些结果提示HDC、组胺和组胺受体可能具有成为前列腺癌早期筛查、治疗靶点及治疗效果评估的有效指标。
