幕上高血压性脑出血微创颅内血肿抽吸引流术1年预后相关因素分析
2018-07-30王文娟刘丽萍杨中华杨波李金鑫杜洋赵性泉
王文娟,刘丽萍,杨中华,杨波,李金鑫,杜洋,赵性泉
作者单位 1100050 北京首都医科大学附属北京天坛医院神经病学中心
2首都医科大学附属北京天坛医院血管神经病学科
3首都医科大学附属北京天坛医院重症医学科
脑出血(intracerebral hemorrhage,ICH)占卒中的6.5%~19.6%,急性期死亡率明显高于缺血性卒中[1-2]。我国ICH中46%的患者1年预后不良,高病死率和致残率给家庭和社会带来沉重的负担[3-6]。血肿体积是ICH临床预后的主要影响因素[7]。目前针对ICH的常规治疗对减少血肿体积、改善出血后继发性脑损伤效果并不理想[8-10]。血肿清除术可以缩短ICH患者的医疗过程,使ICH死亡率降低5.6%,但是并没有达到显著性差异[11-12]。微创血肿清除术联合使用阿替普酶研究(Minimally Invasive Surgery and rtPA in Intracerebral Hemorrhage Evacuation,MISTIE)证实了微创颅内血肿抽吸引流术的安全性,并有可能改善患者180 d的功能预后[13]。目前手术操作和对患者的选择标准不统一,缺乏术后预后的临床数据。本研究旨在研究幕上原发性ICH微创颅内血肿抽吸引流术1年临床预后及其相关的影响因素,为进一步探讨手术适宜人群提供依据。
1 对象与方法
1.1 研究对象 本研究为前瞻性、多中心、队列登记研究。共有8家医院参加此研究。研究者均进行统一的微创颅内血肿抽吸引流术培训,并获得手术资质证书。连续登记2014年1月-2016年8月在各研究中心行血肿微创抽吸引流术的ICH患者。研究方案经过首都医科大学附属北京天坛医院伦理委员会的批准,参加登记的患者或家属签署知情同意书。
入选标准:①根据世界卫生组织诊断标准确定为ICH,并经颅脑计算机断层扫描(computed tomography,CT)确诊[14];②高血压性幕上ICH;③发病时间≤24 h;④年龄18~80岁;⑤20 ml≤出血体积≤100 ml;⑥完成微创颅内血肿抽吸引流术;⑦完成1年随访。
排除标准:①继发性ICH(包括血管畸形、动脉瘤、颅内肿瘤等导致的脑出血)和原发性脑室出血;②幕下脑出血及幕上出血累及幕下;③发病前改良Rankin量表(modified Rankin scale,mRS)评分>2分或者既往严重躯体或者精神疾病,或者严重合并症,影响预后评估。
1.2 微创颅内血肿抽吸引流术规范
1.2.1 头部血肿穿刺点定位 根据术前基线头颅CT测量高度、长度及深度。高度:基线头颅CT外耳道层面至血肿最大层面距离;长度:在基线头颅CT血肿最大层面,前额切线至血肿中心的距离;深度:在基线头颅CT血肿最大层面,头皮穿刺点至血肿中心距离。以外耳门至外眦连线为基线,在垂直于基线的颅顶侧,以高度为刻度取为定点,经定点画与基线的平行线,为定位线。以前额切线为起点,以长度为刻度,在定位线上量取定位点。在定位点贴电极膜,使位于电极膜中心的金属位于定位点。复查头颅CT,明确电极膜金属标记与血肿最大层面关系,微调以确定穿刺定位点。
1.2.2 微创颅内血肿抽吸引流术过程 使用统一的颅脑外引流套装(颅钻、颅锥、导丝、引流管、引流袋)。术前适当镇静。侧卧位,出血侧朝上,头部矢状面与床面平行局部麻醉。颅钻于穿刺定位点进针,钻颅方向平行于最大血肿平面,垂直于正中矢状面,有突破感后停止钻颅。取引流管将其垂直置入颅内至血肿中心,拔出管芯,注射器接引流管末端,回抽观察有无暗红色血液,酌情抽取血肿总量30%~50%。引流管末端连接三通管、肝素帽及引流袋。于固定翼两侧缝合固定引流管,无菌敷料贴固定引流管根部,无菌引流袋固定于床头。复查头颅CT,明确引流管位置。
术后向血肿腔内注射尿激酶2万~4万U,夹闭引流管1 h后打开引流管,每日注射2~4次。每天引流量不超过250 ml。2~3 d后复查头颅CT,一般状况好转可拔除引流管,缝合包扎穿刺点。
1.3 影像学数据收集 患者到院及发病(24±2)h行头颅CT检查,确定患者血肿稳定。基线血肿体积以距离术前最近一次头颅CT计算。记录基线血肿体积及出血部位。术后24 h复查头颅CT,记录残余血肿体积,首次CT血肿清除率。记录术后有无再出血。
血肿体积使用公式A×B×C/2计算,其中A是血肿最大层面的血肿最长直径,B为垂直于A的血肿最宽径,C为血肿出现的层面(层厚1 cm)的厚度之和[15];出血部位分为脑叶出血、深部出血(包括基底节和丘脑)。出血破入脑室根据基线头颅CT进行记录;首次血肿抽吸量为术中注射器抽吸的血凝块体积总量。术后复查CT血肿残余率=(残余血肿体积/基线血肿体积)×100%。首次血肿抽吸率=(首次抽吸血肿量/基线血肿体积)×100%;术后CT血肿清除率=[(基线血肿体积-术后CT血肿体积)/基线血肿体积]×100%;再出血诊断为术后相邻2次CT比较,后一次血肿体积较前增大33%以上和(或)出现新的部位出血。影像学资料均由经过影像判读培训的临床医师进行独立盲法判读。
1.4 临床数据收集和随访 收集患者的人口学资料(如性别、年龄);既往史(包括糖尿病病史、高血压病史、脂蛋白代谢紊乱病史[16])及既往用药史(降压药物、抗血小板药物及口服抗凝药物)。由研究者在患者到院时对患者进行美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评分和格拉斯哥昏迷量表(Glasgow coma score,GCS)评分。记录到院血压及到院后第一次实验室检查等指标。
发病后1年对患者进行电话随访,获得患者1年mRS评分。1年预后不良定义为mRS>3分。1.5 统计学分析 采用SPSS 22.0统计软件对数据进行分析。计量资料符合正态分布用表示,两组间比较用独立样本t检验;计量资料不符合正态分布用中位数和四分位数间距表示,两组间比较用秩和检验;计数资料用百分位数表示,组间比较用卡方检验。用多因素Logistic回归模型分析1年预后不良相关因素。在单变量分析中,P<0.1的变量均作为协变量带入多变量分析。在多变量分析中关键协变量还包括年龄、性别、基线收缩压、基线NIHSS评分、基线GCS评分、术前出血体积、出血部位、出血破入脑室等。采用双侧检验,P<0.05为差异有显著性。
2 结果
2.1 基本数据 研究期间共有117例符合标准的ICH患者进行微创颅内血肿抽吸引流术并纳入此研究。患者平均年龄为(56.5±12.5)岁,男性90例(76.9%)。术前61例(52.1%)患者GCS评分为3~8分,73例(62.4%)患者术前NIHSS评分≥15分。平均血肿体积为(59.0±28.5)ml,80例(87%)患者ICH位于深部。术后首次复查头颅CT平均血肿体积为(38.5±25.1)ml,血肿残余率为(69±47)%。所有手术患者均放置引流管,101例(86.3%)患者使用尿激酶。3例(2.8%)发生颅内感染,5例(5.0%)发生术后颅内再出血。
2.2 单因素分析 59例(50.4%)ICH患者1年预后不良。与预后良好的患者相比,1年预后不良的患者年龄较大,到院GCS较高,基线CT血肿体积较大(表1、表2)。两组其他基线和临床资料及手术相关指标差异无统计学意义(表3)。
2.3 多因素Logistic回归分析 基线血肿体积20~50 ml是1年不良预后的保护性因素,比值比(odds ratio,OR)为0.161,95%置信区间(confidence interval,CI)0.034~0.748,P=0.020。年龄≤60岁(OR0.169,95%CI0.055~0.515,P=0.002)也是1年预后不良的保护性因素(表4)。
3 讨论
高血压性ICH微创手术技术在过去的20年间已经广泛应用于高血压性ICH的治疗[17]。MISTIE研究结果提示,虽然微创颅内血肿抽吸联合应用阿替普酶组发生症状性颅内再出血的风险高于保守治疗组,但是差异没有达到统计学意义。两组发病7 d和30 d死亡率没有显著性差异,证实了微创血肿抽吸引流术的安全性[13]。来自中国的两项研究结果显示,微创手术治疗可以显著降低发病90 d的死亡率和改善90 d的功能预后,但是缺乏1年预后的数据[18-19]。但是有观点认为微创手术不能很好地暴露血肿,因此清除血肿不彻底;并且,因为长时间留置引流管,会增加颅内感染的机会[20]。也有研究结果提示,与内科保守治疗相比,微创手术治疗并没有改善ICH的临床预后[21]。两种相反的研究结果提示,ICH的微创手术治疗需要选择最佳获益人群。
血肿体积是影响ICH患者微创颅内血肿抽吸引流术预后的重要影响因素。一项包括12项随机对照研究、1955例ICH患者的荟萃分析表明,血肿体积在25~40 ml的幕上ICH患者最有可能从微创手术治疗中获益[22]。一项关于立体定向血肿抽吸术的研究提示,即使血肿体积<30 ml的ICH患者,也可以在微创血肿抽吸术中获益[23]。另一项随机对照研究中,对于血肿体积<50 ml和血肿体积≥50 ml的ICH患者,微创血肿抽吸术都可以改善其短期和长期功能预后[24]。本研究中,微创颅内血肿抽吸引流术后1年预后不良占50.4%。预后不良组血肿体积显著高于预后良好组。在Logistic回归分析中,与血肿体积>80 ml的ICH患者相比,血肿体积20~50 ml的ICH患者预后不良的危险性降低约84%,提示血肿体积为20~50 ml的幕上ICH患者可能是微创颅内血肿抽吸引流术的适宜人群。
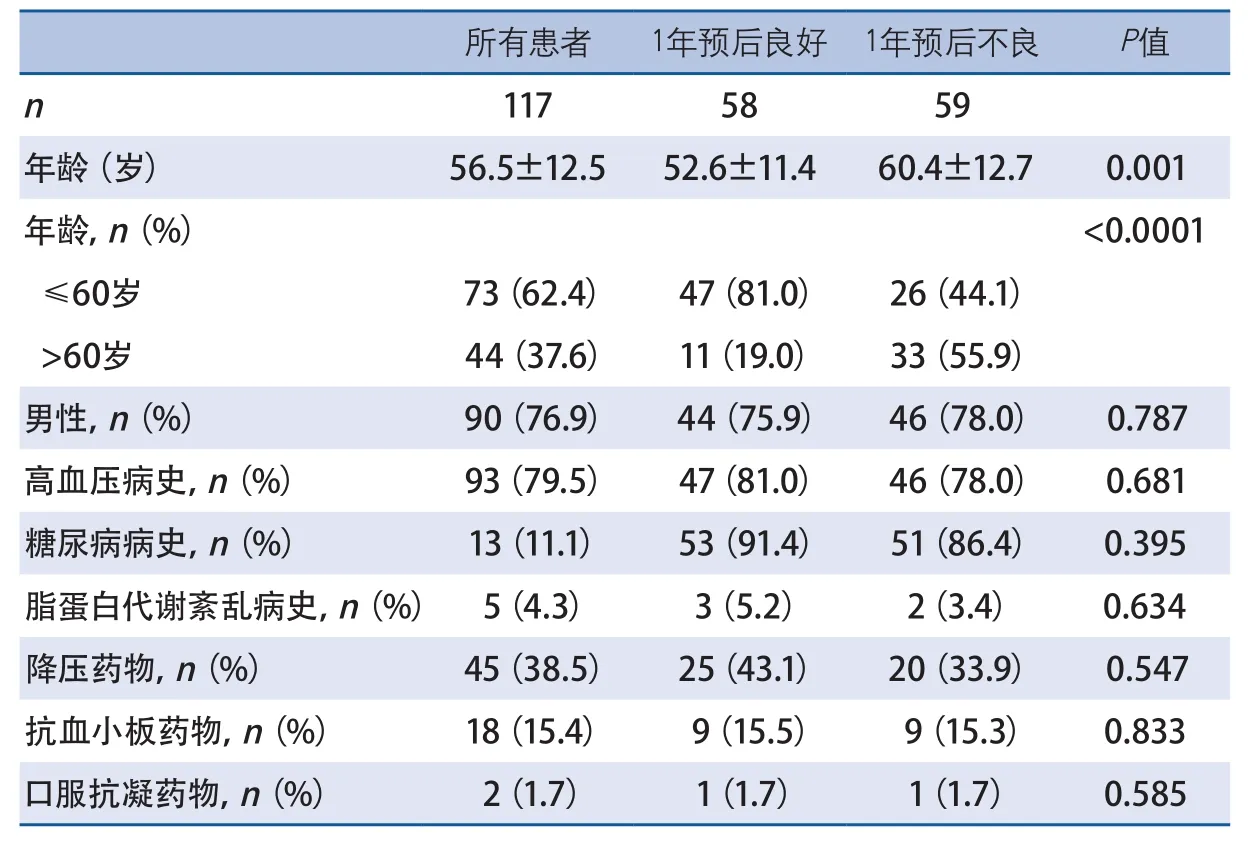
表1 脑出血微创颅内血肿抽吸引流术1年预后良好与预后不良组人口学特征比较
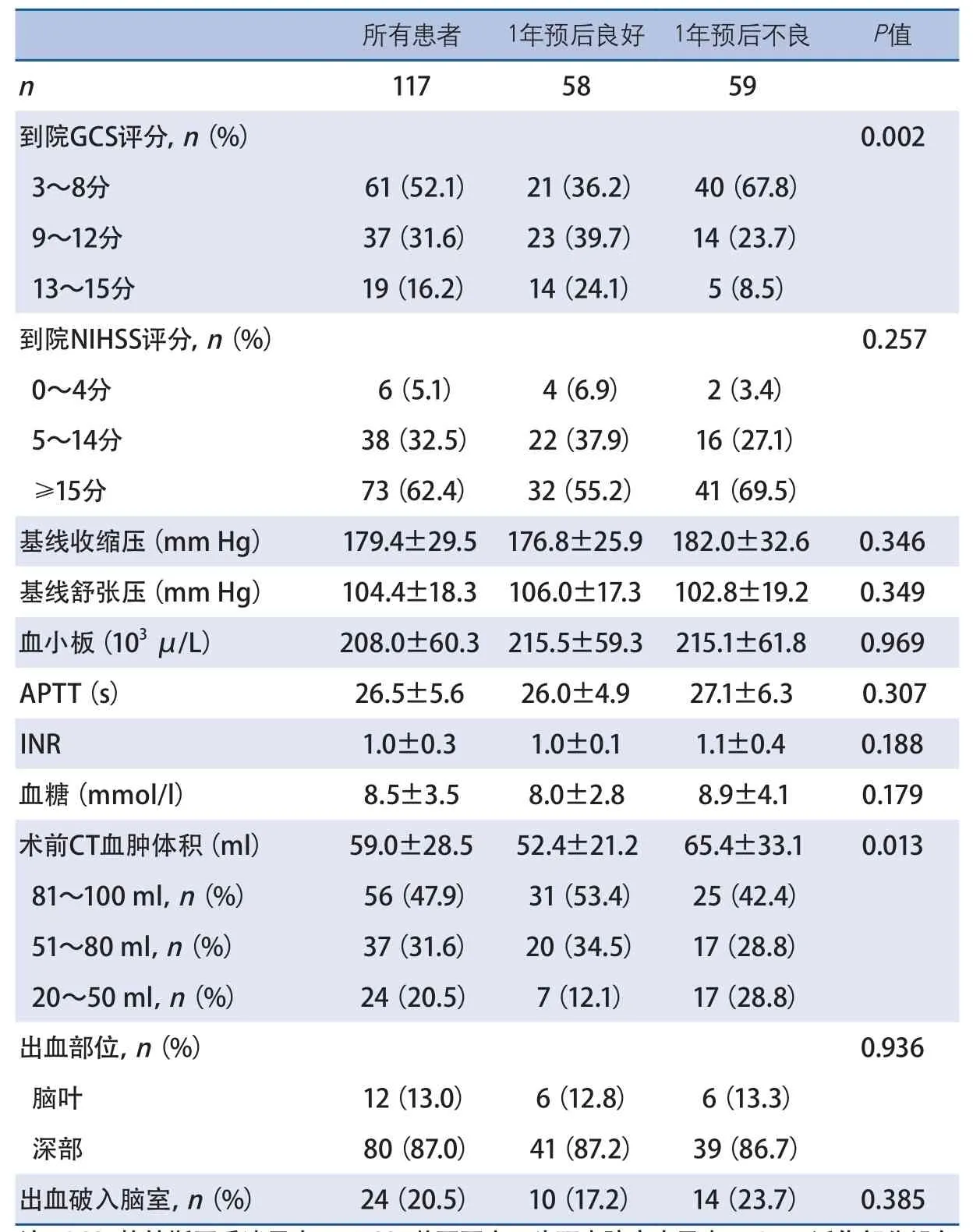
表2 脑出血微创颅内血肿抽吸引流术1年预后良好与预后不良组临床信息比较
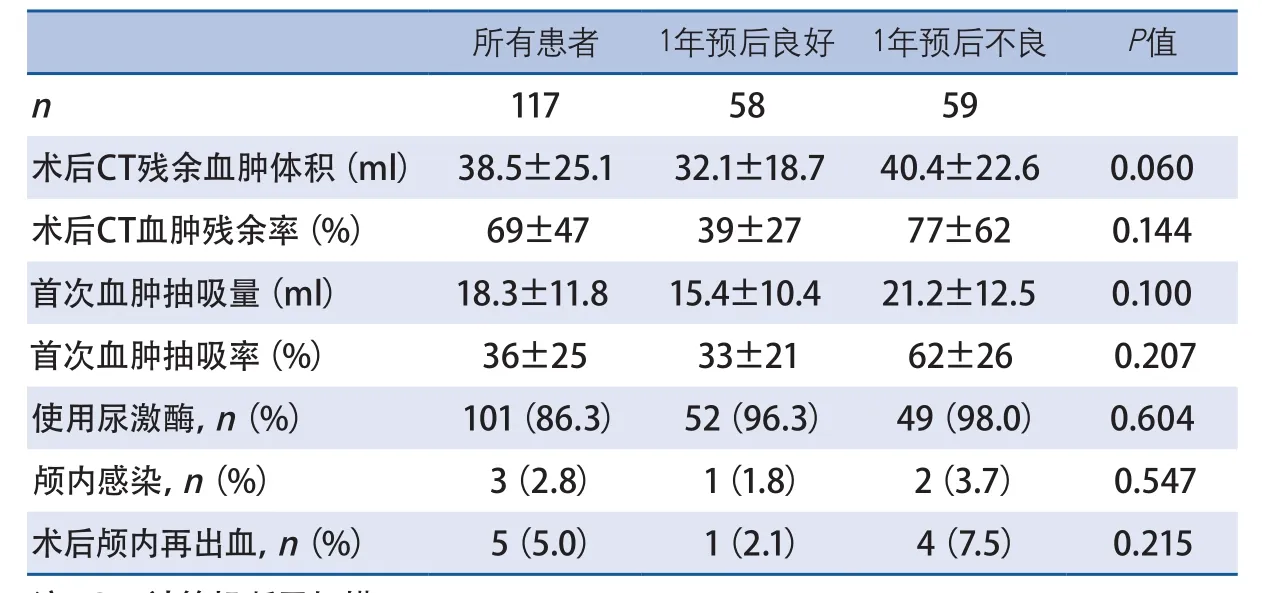
表3 脑出血微创颅内血肿抽吸引流术1年预后良好与预后不良手术相关指标比较
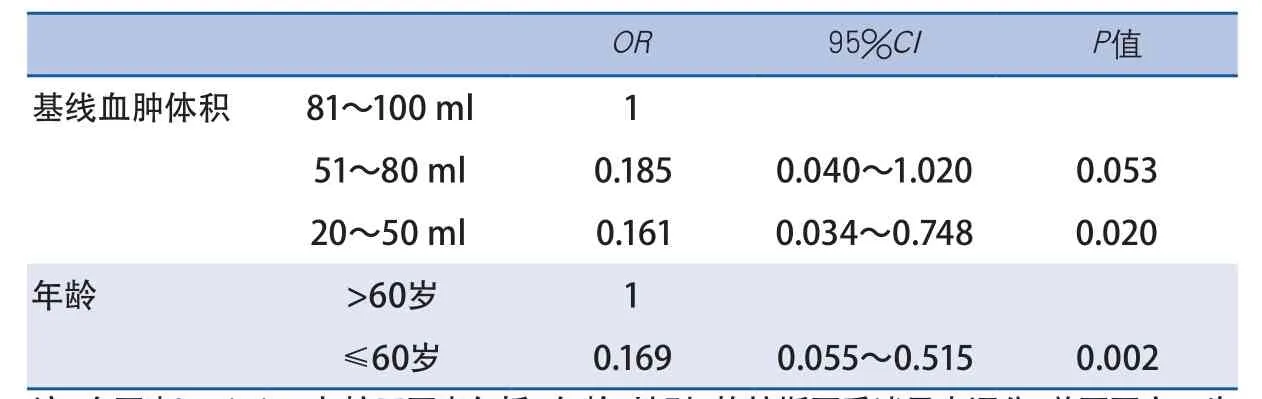
表4 脑出血微创颅内血肿抽吸引流术1年预后不良多因素分析
GCS评分是被证实影响ICH微创手术预后的独立危险因素[22,25-26]。国内一项研究发现,术前GCS<9分的ICH患者接受微创血肿抽吸引流术后1个月死亡风险是GCS≥9分者的3.11倍[25]。荟萃分析研究提示,术前GCS≥9分的幕上ICH患者可以从微创手术中获益[22]。本研究中,1年预后良好的患者GCS≥9分的比例显著高于预后不良的患者,但是多因素分析中,GCS不是影响术后预后的独立危险因素,这与来自MISTIE的结果类似[13]。考虑可能是因为GCS是评价患者意识水平的工具,患者的GCS评分与血肿体积紧密相关,GCS需要结合血肿体积共同评价患者是否适合微创血肿抽吸引流术。
年龄也是影响ICH预后的重要因素[7]。在本研究中,微创血肿抽吸引流术的患者年龄均<80岁。1年预后良好组年龄显著小于预后不良组。多因素分析中年龄≤60岁预后不良的危险性比年龄>60岁降低83%。提示年龄≤60岁的幕上ICH是微创血肿抽吸引流术的可能适宜人群。
本研究具有一定局限性:高龄ICH患者因其合并症多,手术耐受性差,因此关于ICH手术治疗的研究将纳入标准设定为年龄<80岁。因为微创颅内血肿抽吸引流术创伤小,局部麻醉下操作,手术时间短,部分高龄患者也可以耐受,因此需要研究继续探讨微创颅内血肿抽引流术是否可以改善年龄≥80岁的ICH患者的临床预后。
