直 链 醇 与 水 相 互 作 用 的 理 论 研 究
2018-07-27姜贤刚
姜贤刚, 张 晨, 冯 莉
(中国矿业大学 化工学院,江苏 徐州 221116)
0 引 言
褐煤作为一种低阶级煤在我国煤炭资源中占据很高的比例,但由于其较高的含水量使得褐煤并未得到高效利用[1-2]。鉴于褐煤结构的复杂性和组分多样性,已经观察到大量非共价分子间和分子内相互作用,主要包括氢键,范德华相互作用等[3]。褐煤中极性含氧官能团与水形成的氢键作用是其具有高含水量和易复吸水的主要原因[4-7],而将褐煤进行脱水处理是褐煤迈向高效利用和升级的关键一步。因此研究含氧官能团与水形成的氢键作用对指导褐煤的脱水提质具有重要的理论意义。
不同的含氧官能团与水之间的氢键作用有强有弱,与其他含氧官能团相比,具有高酸度的羧基是吸附的优先位置,其次是羟基。同时含氧官能团的浓度对煤表面水的吸附也起到了决定性作用,褐煤中的含氧官能团主要以酚羟基和醇羟基为主[8-10]。鉴于含氧官能团中的醇羟基与水之间的氢键作用对于褐煤表面的亲水性具有重要贡献,研究其与水的氢键作用不仅对褐煤脱水具有重要指导作用,并对构建褐煤分子模型提供理论支撑。
汤海燕等[11]研究了褐煤单体-水配合物中水分子簇的特征和稳定性,并分析了溶剂对几何形状和氢键能的影响。张卫清等[12]采用离子液体1-乙基-3-甲基四氟硼酸咪唑处理褐煤,研究了离子液体对褐煤中氢键活性的影响。Wu等[13]对褐煤-水配合物进行ESP和RDG分析,颜色映射的RDG等值面证明了褐煤-水配合物的非共价相互作用。虽然对煤与水形成氢键作用的研究很多,但利用量子化学方法对煤与水形成氢键作用进行的定量研究还不是很多。
本文选取直链醇为煤中含氧官能团片断,采用B3LYP/6-311++G(d,p)基组,从理论上计算了直链醇与水的结合能,并通过对直链醇与水形成复合体系前后结构参数变化进行研究。
1 计算方法
本文的所有计算均是在Gaussian09[14]软件包下完成的。在B3LYP/6-311++G(d,p)基组水平上,对直链醇、水、复合物进行优化和频率计算,并在优化结构的基础上,对复合物进行了单点能的计算。复合物的结合能EHB的计算使用counterpoise correction方法来消除基组重叠误差[15],并对零点能进行校正,计算公式如下:
EHB=E体系-E直链醇-E水+EBSSE+ΔEZP
对计算出的稳定频率,矫正因子采用0.961 3对其进行矫正。对直链醇-水复合物采用与几何优化相同的基组水平下,即B3LYP/6-311++G(d,p)计算得到波函数导入AIM2000软件进行电子密度拓扑分析。
2 结果与讨论
2.1 体系结构参数分析
直链醇与水分子之间的弱相互作用力是典型的O—H…O氢键,是由醇羟基的氢作为氢键供体,而水分子中的氧原子作为氢键受体缔合形成的,图1为丙醇与水相互作用的结合位置,这样缔合形成氢键的构型是相互作用能最低的点。由于水中氧原子具有很强的电负性使得直链醇与水形成氢键以后,醇羟基的键长都得到了拉伸,约6.7×10-13,如表1所示也可表明形成氢键后醇羟基的键长不随碳链增长呈明显变化。由于形成的氢键与醇羟基共价键不在一条直线上,而是与∠COH呈内错角,因此形成氢键后,∠COH 略微增大,甲醇分子的∠COH 变化可忽略不计,其余醇增加约0.17°~0.24°。直链醇与水分子结合能的范围在18.964 5~19.808 1 kJ/mol,甲醇结合能为19.808 1 kJ/mol,乙醇为19.130 1 kJ/mol,降低了0.678 kJ/mol,结合能下降速度最快,此后随着碳链的增长,结合能下降速度减缓,到丁醇以后结合能下降趋于平缓,如图2所示。此外,氢键键长范围为(1.942 2~1.949 5)×10-10,而O—H…O氢键键长与O和H原子的范德华半径之和[16](1.52+1.2=2.72)×10-10相比显然要小,表明O和H这两个原子是相互渗透的,O与H原子之间的正相互渗透被认为是褐煤中含氧官能团与水之间缔合成氢键的绝对指标。同时也满足结合能与氢键键长的比例关系即氢键键长越长,结合能越小,计算的结果基本满足上述比例关系。如图3所示,丙醇和己醇的结合能出现了轻微的反常,这可能是由于计算的收敛精度不够造成的。

图1 丙醇与水体系结构优化图

体系ROH×1010∠COH/(°)RH…O×1010 BSSE/(kJ·mol-1)EHB/(kJ·mol-1)甲醇-水0.968 0(0.961 4)108.775 6(108.767 7)1.942 23.388 3 19.8081乙醇-水0.968 4(0.961 8)109.094 8(108.922 9)1.947 63.441 4 19.130 1丙醇-水0.968 4(0.961 7)109.156 5(108.926 8)1.947 33.414 0 19.114 1丁醇-水0.968 4(0.961 7)109.134 3(108.894 1)1.948 33.404 9 19.020 5戊醇-水0.968 4(0.961 7)109.121 8(108.881 9)1.949 23.443 3 18.991 1己醇-水0.968 4(0.961 7)109.135 0(108.889 5)1.949 13.435 2 18.982 0庚醇-水0.968 4(0.961 7)109.127 4(108.880 5)1.949 53.449 2 18.964 5
注:括号内为醇分子;扩号外为醇-水体系

图2 碳原子数和结合能的关系

图3 键长和结合能的关系
2.2 密度拓扑分析

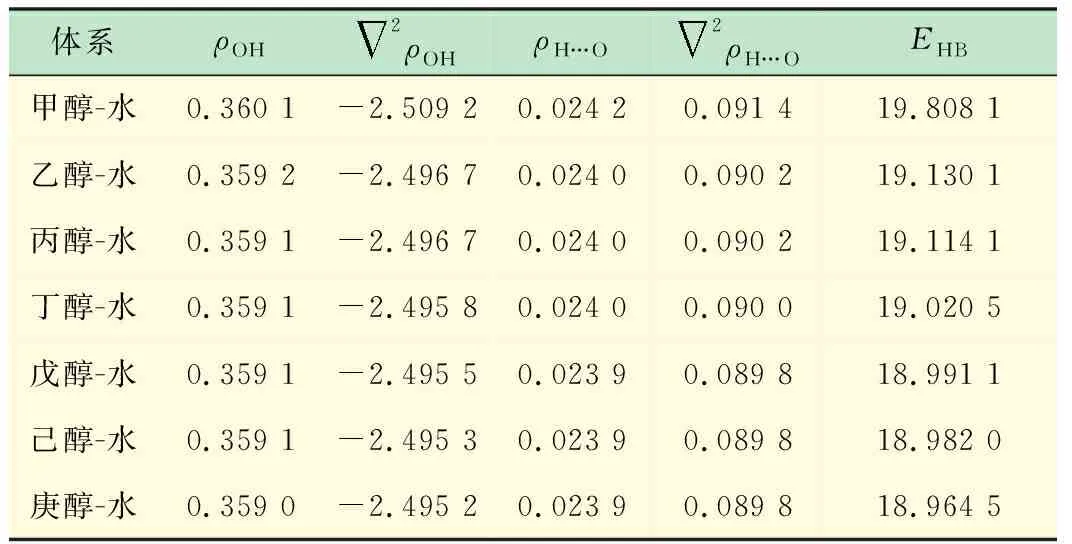
表2 拓扑参数(单位a.u.)结合能 kJ/mol
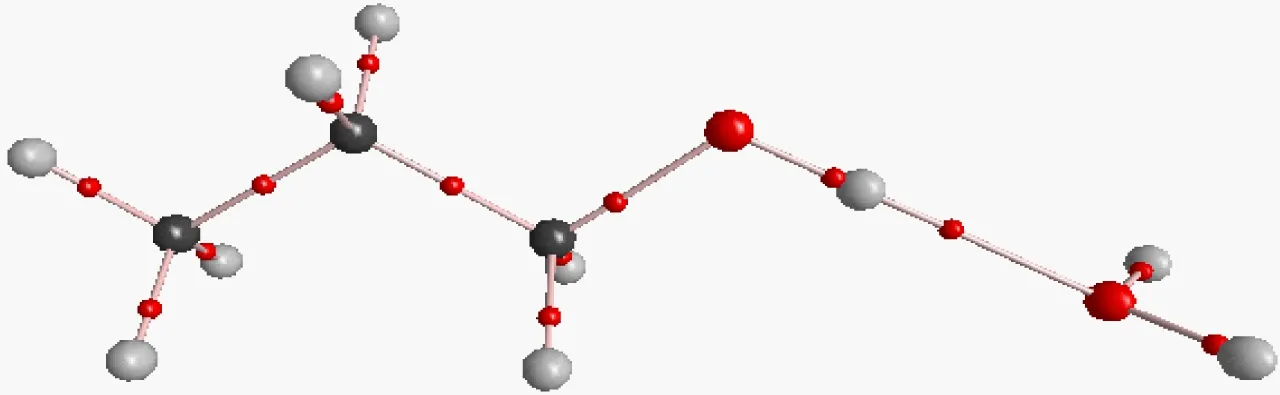
图4 乙醇与水密度拓扑图

图5 ρO…H与结合能的关系
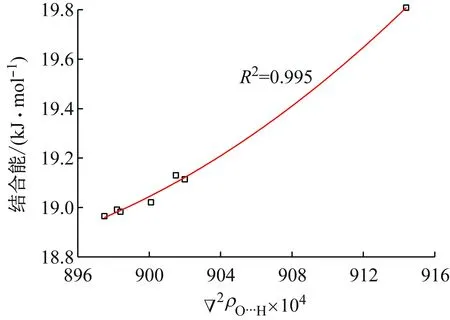
图6 2ρO…H与结合能的关系
2.3 红外光谱分析
表3列出了直链醇羟基与缔和醇羟基的频率数值,得到体系的计算红外光谱,并与实验红外光谱进行对比(见图7)。从图7(a)可以发现,谱图的峰形较为相似,峰位置较为接近,峰强度比例一致,但在波数高的峰位出现轻微偏差,这可能是计算忽略了非简谐振动导致的,可通过频率校正因子来校正。两谱图吻合度非常高,说明本文采用的计算方法是可以达到要求的。醇类的羟基典型振动模式为羟基的伸缩振动吸收,在3 000 cm-1波数以上,很容易区分。醇羟基的自由振动在3 843 cm-1左右,当与水缔合形成氢键后,醇羟基的伸缩振动频率发生红移,迁移至3 723 cm-1处,羟基波数红移了120 cm-1左右且振动强度增加非常明显,在游离的醇分子中,羟基的振动强度不强,但形成氢键以后的羟基振动增强,成为谱图中的最强峰。这也能说明羟基与水形成的氢键结合能要强于单纯的羟基官能团 。

表3 羟基振动频率 cm-1
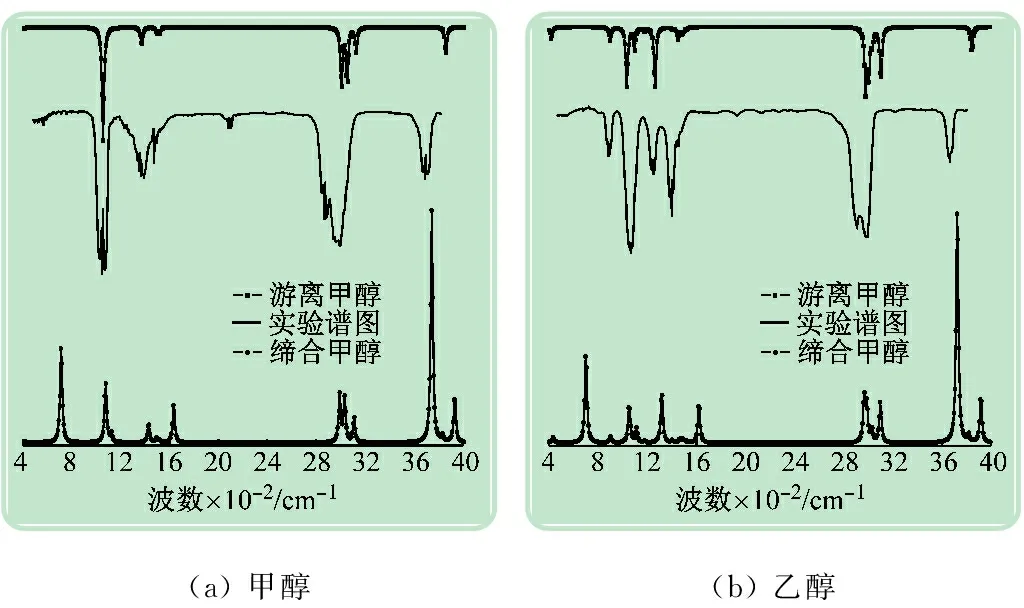
(a) 甲醇(b) 乙醇
图7 计算红外光谱与实验光谱的对比
2.4 Mulliken电荷分布
表4给出了直链醇与水缔合成氢键前后原子上电荷的变化,醇羟基的氢原子所带正电荷电量从0.2增多到0.4左右,是因为氢原子作为氢键的供体即受到醇羟基自身氧原子的吸引又受到水中氧的吸引使得电荷量增加。水中的氧与醇羟基的氧的负电荷的电量都有增加,但水中氧原子的负电荷的增加幅度比醇羟基中氧的要大,主要是因为氢键是弱相互作用力,没有醇羟基中氧与氢形成的共价键的作用力强。
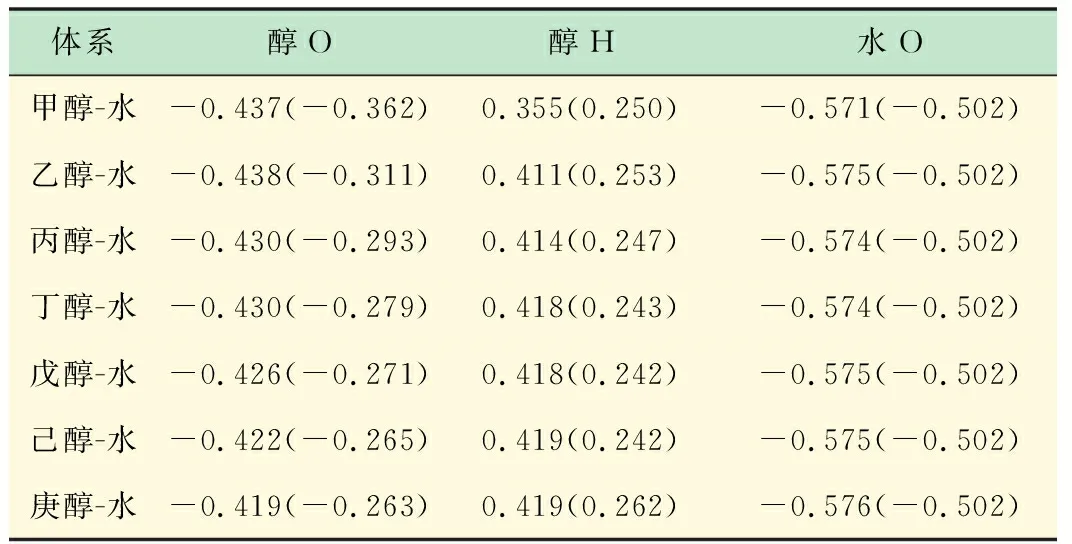
表4 Mulliken电荷分布
括号内为单分子,括号外为醇-水体系
3 结 语
在B3LYP/6-311++G(d,p)基组水平上研究了直链醇与水的相互作用。结果表明:直链醇类与水的结合能范围在18.9~19.8 kJ/mol,碳链的增长对结合
能的影响不是很大,随着碳链的增长,结合能呈下降的趋势,当链上碳原子数在4以后,结合能变化不大。形成氢键后,使得醇羟基被拉伸,增长约6.7×10-13,羟基的的波数红移了约120 cm-1左右且成为谱图中最强峰。将实验红外光谱与计算红外光谱进行比较发现,两图谱吻合度较好,说明本文的计算方法是可行的,结果是可靠的。
