干扰素诱导蛋白Nmi与人巨细胞病毒皮层蛋白UL23相互作用区域的研究*
2018-07-27叶倩宸陈业伟傅政民李晓钿冯琳远杨晓苹冉艳红李弘剑
叶倩宸, 陈业伟, 傅政民, 李晓钿, 冯琳远, 杨晓苹, 冉艳红, 李弘剑
(暨南大学生命科学技术学院, 广东 广州 510632)
人巨细胞病毒(human cytomegalovirus, HCMV)属于β疱疹病毒,在人群中感染率高,在发达国家有50%的感染率,而在多数发展中国家感染率则高达100%[1]。在美国,每年有2~3万名婴儿感染HCMV,而在印度等发展中国家,则超过25万名;受感染婴儿中有30%呈HCMV先天性感染[2]。感染HCMV是发达国家胎儿先天性畸形最常见的原因,也会导致胎儿神经发育迟缓,胎儿或新生儿死亡,肺炎、支气管发育不良、神经系统后遗症和感觉神经性耳聋等疾病[3]。HCMV通常呈隐性感染,健康的人群感染后没有明显症状。免疫功能不全的个体或者当机体免疫力低下时,HCMV感染会导致视网膜炎、脑炎、肝炎、黄疸、听力损害,动脉粥样硬化等疾病的发生甚至危及生命[4]。
UL23是HCMV的皮层蛋白,聚集在细胞质中的核周边区域,其基因属于US22基因家族的一员。US22基因家族包括12个成员:UL23、UL24、UL28、UL29、UL36、UL43、TRS1、IRS1、US22、US23、US24和US26,这些基因广泛参与病毒的生长增殖过程[5]。目前对UL23的功能研究并不多,前期发现UL23可以和胰岛素样生长因子结合蛋白4(insulin-like growth factor binding protein 4,IGFBP4)以及ATP酶抑制因子1(ATPase inhibitory factor 1, ATIF1)相互作用[6-7]。课题组前期工作中,以人巨细胞病毒蛋白UL23为诱饵蛋白,通过酵母双杂交系统筛选出与其相互作用的干扰素诱导蛋白N-Myc相互作用因子(N-Myc interactor, Nmi)[8]。
Nmi是干扰素诱导蛋白,被首次发现于1996年。Nmi的结构可分Coiled-Coil、NID1和NID2 3个部分[9]。Nmi与人干扰素诱导蛋白IFP35同源,并通过相互作用增强IFP35的稳定性[10]。除此之外,Nmi还会与多种蛋白相互作用,包括IFN信号通路中的核心蛋白信号转导及转录激活因子(signal transducers and activators of transcription,STAT;除STAT2 外)、乳腺癌1号基因、组蛋白乙酰化转移酶Tip60、读码框移位蛋白(alternative reading frame protein,ARF)、性别决定区Y框蛋白10和酪蛋白激酶2-相互作用蛋白1等[9]。课题组前期通过酵母双杂交实验表明UL23可以与干扰素诱导蛋白Nmi相互作用,且Nmi与UL23相互作用的关键区域位于Nmi 的NID2结构上[8]。在此基础上,本文的研究进一步证实干扰素诱导蛋白Nmi与人巨细胞病毒皮层蛋白UL23相互作用的现象,探讨了Nmi与UL23相互作用的区域。本文的实验结果为研究UL23的功能奠定了基础,也为研究HCMV的潜伏感染机制提供了思路。
材 料 和 方 法
1 实验材料
宫颈癌细胞HeLa、大肠杆菌DH5α和大肠杆菌Rosetta(DE3)感受态细胞为本实验室保存。质粒pGEX-4T-1、pGEX-4T-1-Nmi、pcDNA4-Myc、pcDNA4-Nmi-Myc和pcDNA3.1(+)-UL23-Flag本实验室保存。限制性内切酶BamHⅠ、XhoⅠ及预染蛋白分子量标准Marker购自Thermo Fisher Scientific;T4 DNA连接酶购自TaKaRa;质粒小提试剂盒、琼脂糖凝胶回收试剂盒和PCR产物清洁试剂盒购自Omega;Fast Pfu DNA高保真聚合酶购自全式金公司;胎牛血清和DMEM培养基购自Gibco;DNA分子量标准 Marker 购自广州东盛生物科技有限公司; ECL发光液购自Millipore;谷胱甘肽(GSH)琼脂糖珠和Protein A/G购自Life;Lipofectamine 2000和Myc单克隆抗体购自Cell Signaling Technology;Flag单克隆抗体购自Proteintech;羊抗鼠Ⅱ抗和羊抗兔Ⅱ抗购自碧云天公司。引物由生工生物工程有限公司合成,引物序列见表1、2。

表1 截短突变型Nmi PCR引物
The underlined italics denote the restriction enzyme cutting sites.

表2 缺失突变型Nmi PCR引物
The underlined italics denote the restriction enzyme cutting sites.
2 主要方法
2.1截短突变型Nmi克隆的构建 根据NCBI的GenBank中收录的Nmi基因序列(序列号NM_004688)设计引物,引物设计如表1所示,上游引物含BamHⅠ酶切位点,下游引物含XhoⅠ酶切位点。以pcDNA4-Nmi-Myc为模板,通过PCR扩增两端带有酶切位点的目的片段。反应程序为:95 ℃ 5 min; 95 ℃ 30 s、54 ℃ 30 s、72 ℃ 40 s的程序进行35个循环;72℃ 10 min。纯化后的PCR扩增产物和经过BamH Ⅰ和XhoⅠ酶切后的表达载体质粒pGEX-4T-1,在T4连接酶的作用下,与带有黏性末端的目的片段16 ℃连接过夜制备克隆连接液。将连接液转化至大肠杆菌感受态细胞后,挑取阳性克隆进行双酶切鉴定,并对阳性质粒进行测序分析。
2.2缺失突变型Nmi克隆的构建 分别以5个、6个和11个氨基酸为单位,设计Nmi各个缺失型片段的上下游引物(见表2)来构建缺失突变型Nmi克隆。构建缺失192~202 aa这11个氨基酸的Nmi是以pcDNA4-Nmi-Myc为模板,设计引物分别扩增N端带有BamHⅠ酶切位点的Nmi_1aa-191aa和C端带有XhoⅠ 酶切位点的Nmi_203aa-307aa这两段基因片段,扩增程序为:95℃ 5 min;95 ℃ 30 s、54 ℃ 30 s,72 ℃ 40 s的程序进行35个循环;72 ℃ 10 min。得到相应的目的片段纯化后和经过BamHⅠ和XhoⅠ 双酶切过的载体质粒pcDNA4-Myc,利用同源重组方法50 ℃反应15 min。连接液转化至大肠杆菌感受态细胞后提取阳性质粒进行双酶切鉴定,并对阳性质粒进行测序分析。其余2个缺失突变型克隆的构建均参考以上方法。
2.3细胞培养和转染 HeLa细胞使用含有10%胎牛血清的DMEM高糖培养液,在37 ℃、5% CO2的恒温培养箱里培养。细胞转染步骤严格按Lipofectamine 2000说明书操作。
2.4GST-pulldown实验 将pGEX-4T-1和pGEX-4T-1-Nmi以及截短突变型Nmi原核表达载体分别转化至大肠杆菌Rosetta(DE3)感受态细胞,挑取单克隆到带有氨苄抗性的LB液体培养基中,37 ℃、250 r/min条件下培养,直到A600为0.6~0.8。加入IPTG至终浓度为0.2 mmol/L,25 ℃、150 r/min诱导5 h,收集菌体进行超声破碎。GSH琼脂糖珠用预冷的细菌裂解液清洗3次,加入超声破碎后的上清,4℃条件下,旋转培养器上孵育2 h。孵育结束后清洗5次,加入转染有UL23-Flag的全细胞裂解液混合,4℃孵育过夜,后清洗10次。Western blot法分析结果。
2.5免疫共沉淀(co-immunoprecipitation,Co-IP) 将pcDNA3.1(+)-UL23-Flag分别与pcDNA4_NmiΔ192aa-197aa-Myc(缺失Nmi的第192~197位氨基酸)、pcDNA4-Nmi_Δ197aa-201aa-Myc(缺失Nmi的197~201位氨基酸)和pcDNA4-Nmi_Δ192aa-202aa-Myc(缺失Nmi的第192~202位氨基酸)质粒共转染入HeLa细胞,36 h后裂解细胞,离心后收集上清,加入Flag抗体,4 ℃孵育过夜。再与预处理后的ProteinA琼脂糖珠在4 ℃条件下孵育过夜。孵育结束后,用Western blot及IP裂解液清洗5~7次,最后用Western blot法分析结果。
2.6Western blot 收集含有总蛋白的细胞裂解液,或者收集附着有蛋白的谷胱甘肽琼脂糖珠和Protein A琼脂糖珠缓冲液,按照比例加入5×SDS蛋白上样缓冲液,煮沸10~15 min,离心后取上清。经10% SDS-PAGE分离后的蛋白转移至PVDF膜上,随后用含5%脱脂奶粉的TBST缓冲液封闭1 h。经过封闭的PVDF膜分别与含有Flag抗体、Myc抗体或α-tubulin抗体的抗体稀释液在4 ℃条件下孵育过夜。TBST洗膜3次,每次20 min。加入辣根过氧化物酶标记的羊抗鼠抗体或羊抗兔抗体4 ℃孵育2 h,TBST洗膜3次,每次20 min。ECL显色发光,凝胶成像仪拍照分析。
结 果
1 截短突变型Nmi目的基因的扩增和重组质粒的鉴定
根据NCBI上已公布的Nmi(GenBank:NM_004688)的基因序列,将Nmi上NID2结构域划分成10个截短突变型片段。以pcDNA4-Nmi-Myc(全长)为模板,分别通过PCR进行扩增。10个截短突变型Nmi的PCR产物经琼脂糖凝胶电泳后结果显示,PCR扩增出的基因条带均与目的基因条带分子量吻合,见图1A。挑取单克隆,提取对应质粒进行双酶切鉴定,鉴定结果如图1B所示,表明各截短突变型Nmi成功插入载体。经酶切鉴定后的质粒送生工生物公司测序,测序结果显示截短突变型Nmi重组质粒构建成功。
2 缺失突变型Nmi目的基因的扩增和重组质粒鉴定
根据实验结果,将Nmi上第192~202位氨基酸划分成3个缺失型片段,以pcDNA4-Nmi-Myc(全长)为模板,PCR扩增出5个不同长度的Nmi片段,PCR产物分子量大小与预期一致,结果显示不同长度的Nmi片段通过PCR扩增成功,见图1C。
提取阳性单克隆的质粒进行双酶切鉴定,结果如图1D所示,阳性重组质粒经双酶切得到的片段与缺失突变型Nmi分子量一致,表明目的片段成功插入载体。测序的结果证实缺失突变型Nmi真核表达载体构建成功。pcDNA4-Nmi_Δ192aa-197aa-Myc表示缺失Nmi的第192位~197位氨基酸,其余2个缺失突变型克隆均采用此法表示。

Figure 1. Indicated fragments amplified by PCR and identification of recombinant plasmids with restriction enzyme. A: truncatedNmifragments amplified by PCR.1~10: Nmi_1aa-192aa, Nmi_1aa-202aa, Nmi_1aa-212aa, Nmi_1aa-222aa, Nmi_1aa-232aa, Nmi_1aa-252aa, Nmi_1aa-262aa, Nmi_1aa-272aa, Nmi_1aa-282aa, Nmi_1aa-292aa, respectively. B: recombinant plasmids digested byBamHⅠ andXhoⅠ. 1~10: pGEX-4T-1-Nmi_1aa-192aa, pGEX-4T-1-Nmi_1aa-202aa, pGEX-4T-1-Nmi_1aa-212aa, pGEX-4T-1-Nmi_1aa-222aa, pGEX-4T-1-Nmi_1aa-232aa, pGEX-4T-1-Nmi_1aa-252aa, pGEX-4T-1-Nmi_1aa-262aa, pGEX-4T-1-Nmi_1aa-272aa, pGEX-4T-1-Nmi_1aa-282aa, pGEX-4T-1-Nmi_1aa-292aa, respectively. C:Nmideletion fragments amplified by PCR. 1~5: Nmi_1aa-191aa, Nmi_1aa-196aa, Nmi_198aa-307aa, Nmi_202aa-307aa, Nmi_203aa-307aa, respectively.D: identification of recombinant plasmids aboutNmideletion mutants digested byBamHⅠ andXhoⅠ. M: marker.1~3: pcDNA4-Nmi_Δ192aa-197aa, pcDNA4-Nmi_Δ197aa-201aa, pcDNA4-Nmi_Δ192aa-202aa.
图1截短突变型Nmi克隆和缺失突变型Nmi克隆的构建
3 GST-pulldown法探究Nmi与UL23相互作用的位点
将pGEX-4T-1(GST)、pGEX-4T-1-Nmi以及C端截短突变型pGEX-4T-1-Nmi原核表达载体转化至大肠杆菌感受态细胞。含原核表达载体pGEX-4T-1(GST)、 pGEX-4T-1-Nmi以及截短突变型Nmi的Rosetta菌株经异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)诱导后分别表达出分子量大小与预期相吻合的蛋白,说明12个目的蛋白成功诱导表达。诱导前的菌种所表达的蛋白如图2A和图2B所示,诱导后的菌种蛋白表达如图2C和图2D所示。

Figure 2. SDS-PAGE analysis of the fusion protein expression induced with IPTG. A and B: bacteria induced without IPTG; C and D: bacteria induced with 0.2 mmol/L IPTG.
图2截短突变型GST-Nmi蛋白的诱导表达
经GSH琼脂糖珠亲和层析纯化之后,相应的目的蛋白均有一定的富集,并且只含有目的蛋白条带,说明GST蛋白、GST-Nmi蛋白和截短突变型GST-Nmi蛋白在体外能够得到有效的纯化,结果如图3A所示。GSH琼脂糖珠亲和层析纯化后的12个目的蛋白与真核表达载体表达的融合蛋白UL23-Flag混合、孵育、清洗,通过 Western blot进行检测。真核表达载体表达的融合蛋白UL23-Flag结果如图3B所示。GST蛋白与融合蛋白UL23-Flag的pulldown结果为阴性对照,GST-Nmi蛋白与融合蛋白UL23-Flag的pulldown结果为阳性对照,在所有的截短突变型GST-Nmi蛋白中,只有GST-Nmi_1aa-192aa这段蛋白不能在体外与融合蛋白UL23-flag相互作用(图3A),从而初步筛选出Nmi与UL23相互作用的区域为Nmi上第192~202位氨基酸。

Figure 3. Identification of domains on Nmi that mediate the interaction with UL23 by GST-pulldown test. A: SDS-PAGE analysis of purified fusion proteins (top panel) stained by Coomassie brilliant blue, and Western blot results showing abilities about full-length Nmi and its mutants to interact with UL23-Flag (bottom panel); B: pcDNA3.1(+)-UL23-Flag and pcDNA3.1(+) transfected into HeLa cells. The cell lysates were immunoblotted with anti-Flag.
图3GST-Pulldown检测Nmi与UL23的相互作用区域
4 免疫共沉淀法验证Nmi与UL23相互作用的区域
将pcDNA3.1(+)-UL23-Flag分别与pcDNA4和野生型Nmi及缺失突变型Nmi共转染到HeLa细胞中。收集细胞裂解液与Protein A/G琼脂糖珠、Flag抗体孵育后检测蛋白的相互作用情况。以pcDNA4与UL23-Flag的体内相互作用作为阴性对照,融合蛋白Myc-Nmi与融合蛋白UL23-Flag的体内相互作用作为阳性对照,实验结果如图4所示,融合蛋白UL23-Flag能够在各实验组中表达,野生型Nmi和缺失型突变Nmi均能表达。免疫共沉淀实验结果表明,阳性对照中融合蛋白Myc-Nmi能与融合蛋白UL23-Flag相互作用,再一次证实Nmi可与UL23相互作用。过表达Myc-Nmi_Δ192aa-197aa(即Myc-Nmi缺失第192~197位氨基酸)和Myc-Nmi_Δ197aa-201aa(即Myc-Nmi缺失第197~201位氨基酸)均能与UL23-Flag相互作用。融合蛋白Myc-Nmi_Δ192aa-202aa(即Myc-Nmi缺失第192~202位氨基酸)不能与融合蛋白UL23-Flag在体内发生相互作用,与GST-pulldown实验的结果相一致,见图5。
讨 论
人巨细胞病毒在人群中呈普遍性感染,同时HCMV也与多种疾病的发生均有密切关联,因而HCMV感染的诊断和治疗显得尤其重要。本研究通过GST-pulldown和Co-IP实验证实了Nmi与UL23在体内存在相互作用并且进一步确定了Nmi与UL23相互作用的区域。免疫共沉淀实验结果表明,缺失11个氨基酸的融合蛋白Myc-Nmi_Δ192aa-202aa不会与融合蛋白UL23-Flag相互作用,而缺失5个氨基酸的融合蛋白Myc-Nmi_Δ197aa-201aa和缺失6个氨基酸的融合蛋白Myc-Nmi_Δ192aa-197aa均能与UL23-Flag发生相互作用,猜测是因为Nmi上192~202aa中有某几个间隔的氨基酸联合作用于UL23,也可能是该区域具有特殊的空间构象有助于Nmi与UL23结合。

Figure 4. Verification of Nmi deletion mutants in interaction with UL23 by Co-IP assay. HeLa cells were transfected with Flag-tagged UL23 and indicated by Myc-tagged plasmids. The cell lysates were immunoprecipitated with anti-Flag. Immunoprecipitates were analyzed by immunoblot with anti-Myc or anti-Flag.
图4免疫共沉淀方法验证缺失突变型Nmi与UL23相互作用
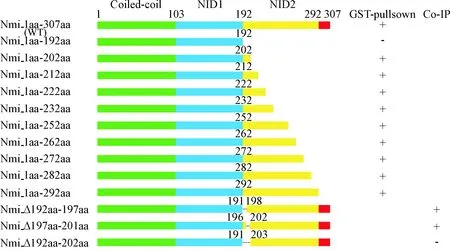
Figure 5. Schematic diagram of Nmi domains that mediate the interaction with UL23.
图5Nmi与UL23相互作用位点示意图
Nmi 可以增强干扰素α启动子的活性,抑制水疱性口炎病毒的生长[11]。Nmi与干扰素信号通路核心分子STAT家族中的STAT1和STAT5结合,从而促进STAT1与CBP/p300的相互作用,放大干扰素信号通路的生物学效应,使得抗病毒蛋白生成[12]。由于Nmi在抗病毒过程中发挥着重要角色,病毒通过干扰Nmi的功能抵抗宿主的免疫反应来促进病毒自身的增殖。Nmi增强干扰素信号通路中干扰素刺激应答元件IRSE启动子的转录活性,而诺如病毒编码的小分子RNA tth8能减少Nmi的表达,并减弱ISRE启动子的转录活性[13]。Nmi与泡沫病毒的反式激活因子Tas相互作用后,阻碍Tas进入细胞核,干扰Tas的激活功能,从而抑制泡沫病毒的复制[14]。Nmi与UL23相互作用的区域位于Nmi上 NID2这个区域,而Nmi与Tip60相互作用区域与其部分重叠,位于Nmi上126~197aa区域。Nmi与Tip60相互作用后可以增强自身的稳定性,但Nmi是否可以通过与UL23相互作用来促进自身的降解或者提高UL23的稳定性,从而帮助病毒达到免疫逃避的目的有待进一步的研究。
蛋白相互作用缺失或者蛋白发生不恰当的相互作用都容易导致细胞或机体内环境稳态被破坏,细胞或机体生命活动受影响,从而引起疾病的发生甚至危害生命。UL23能与Nmi发生相互作用,前期实验结果也表明,UL23能与多个宿主蛋白相互作用[6-7],猜测HCMV可能利用UL23干扰宿主的生命活动,达到免疫逃避的目的。Nmi在细胞中主要定位在细胞核,而在稳定表达UL23的细胞系中,Nmi与UL23主要定位于细胞质,Nmi和UL23相互作用后改变了Nmi的核定位。感染HCMV病毒后,Nmi通过与UL23相互作用抑制Nmi与STAT1的相互作用,阻止STAT1进入细胞核[8]。STAT1经过磷酸化后形成同源二聚体,进入细胞核与GAS启动子结合,起始抗病毒基因的转录[15]。UL23可能通过与Nmi相互作用抑制STAT1入核,使STAT1参与的JAK-STAT信号通路受到影响,相应的抗病毒基因的转录被抑制,这有利于HCMV进行免疫逃避。本研究确认了Nmi与UL23的相互作用并且找到Nmi与UL23相互作用的关键氨基酸为Nmi上第192~202位氨基酸,这为阐明UL23帮助HCMV在宿主体内潜伏的分子机理提供了基础,加深了我们对两者相互作用的认识,为研究HCMV感染宿主的致病机理提供理论基础。
