慢病毒介导转染Adra1d基因shRNA对大鼠主动脉血管平滑肌细胞钙离子和钙调蛋白的影响*
2018-07-27赵良渊侯晓敏秦小江
赵良渊, 侯晓敏, 秦小江
(山西医科大学 1体育教学部, 2基础医学院, 3公共卫生学院, 山西 太原 030001)
血管舒张功能减弱是高血压的发病原因之一[1]。在血管壁的结构中,主要调控血管舒缩活动的是血管中膜,而血管中膜主要由血管平滑肌细胞(vascular smooth muscle cells,VSMCs)组成。VSMCs收缩可减小血管直径,进而引起血压的升高,反之VSMCs舒张则可降低血压[2]。α1-肾上腺素能受体(α1-adrenergic receptor,α1-AR)主要包括α1A、α1B和α1D3种亚型[3],其中α1A和α1D对血压的调节非常重要,且有研究表明α1D亚型参与VSMCs的收缩与舒张相关信号调控过程[4-5],而胞内Ca2+浓度及钙调蛋白(calmodulin,CaM)水平与VSMCs的收缩活动密切相关[4-7]。本课题组此前对自发性高血压大鼠(spontaneous hypertensive rats,SHR)和正常对照大鼠(Wistar-Kyoto RAT,WKY大鼠)的主动脉组织进行全基因表达谱检测,发现与WKY大鼠相比,SHR的Adra1d基因(α1D-AR的基因)表达量显著升高[8]。因此我们推测,Adra1d基因可通过调控Ca2+浓度及CaM的表达对VSMCs的舒缩活动进行调节。
针对Adra1d基因的mRNA编码区设计同源shRNA,把shRNA与载体质粒GV248结合为重组质粒并导入慢病毒内。慢病毒侵染大鼠主动脉VSMCs后,病毒携带的shRNA被导入大鼠主动脉VSMCs中并与之基因组相结合,从而导致Adra1d基因表达沉默,且shRNA可以在细胞中被稳定表达[9],可保证3代以上细胞的转染效果。本实验针对Adra1d基因设计进行RNA干扰(RNA interference, RNAi)实验,建立shRNA慢病毒表达载体,探讨Adra1d基因与大鼠主动脉VSMCs内Ca2+浓度和CaM变化的关系。
材 料 和 方 法
1 主要材料与试剂
雄性SD大鼠,150~180 g,购自山西医科大学动物中心,许可证号为SCXK(晋)2009-0001。HEK293细胞(上海中科院细胞库)。
慢病毒载体GV248(吉凯基因化学技术有限公司);Lipofectamine 2000(Thermo Scientific);兔抗鼠 Adra1d多克隆抗体(Abcam)。
2 方法
2.1原代VSMCs的培养及鉴定 大鼠麻醉后,快速取其胸主动脉,采用组织块贴壁法培养VSMCs。选取第4~6代细胞进行实验。采用免疫组化染色法对VSMCs进行鉴定,I 抗为抗α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体,胞质着棕色的细胞为VSMCs。
2.2Adra1dshRNA慢病毒载体的构建和稳定转染细胞的筛选 根据分析结果,设计得到4条shRNA靶点序列。另外,选择scrambled序列[10]作为RNAi阴性转染组。设计得到的shRNA1序列为5’-GCTCAAGTACCCAGCCATTAT-3’,shRNA2序列为5’-GCCAAAGGATATCCCGGAACA-3’,shRNA3序列为5’-GCTGTCATCTGCCAGGCTTAT-3’,shRNA4序列为5’-AAACTACTTAGTCAACTCCTA-3’,scramble序列为5’-TTCTCCGAACGTGTCACGT-3’。
根据以上shRNA靶点序列,分别设计合成正、反2条单链寡核苷酸。将重组质粒转化至感受态细胞DH5α,扩增得到shRNA-Adr载体。寡核苷酸序列见表1。
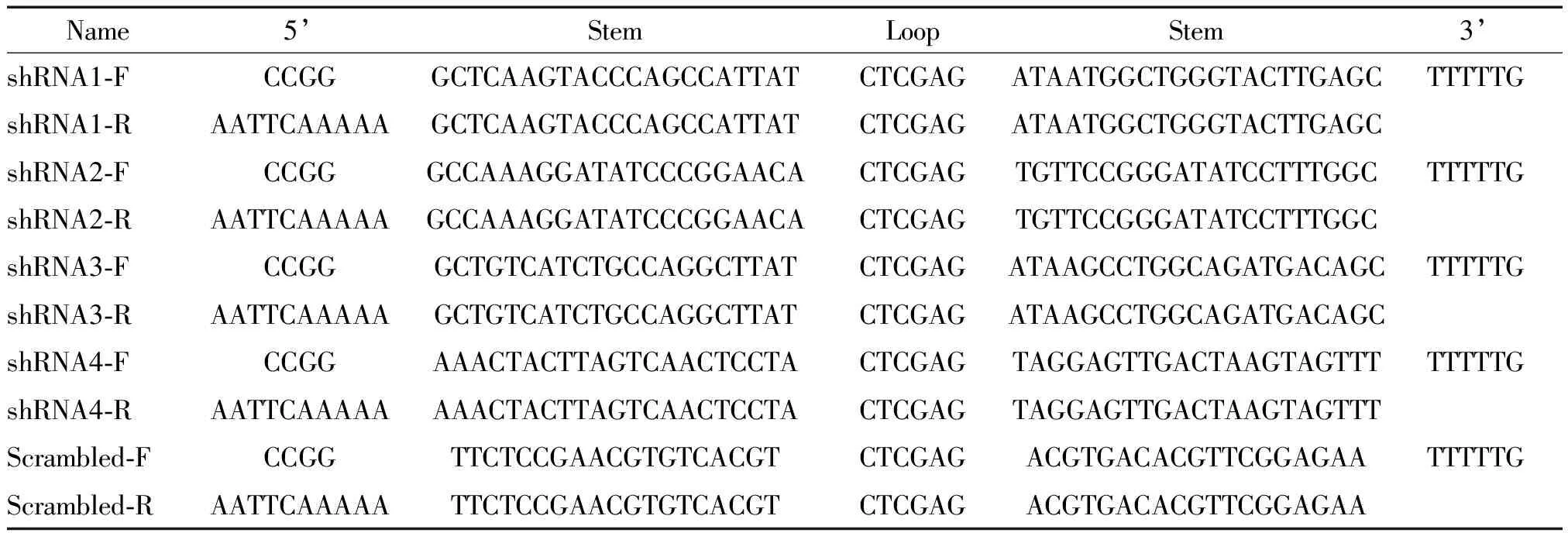
表1 合成的shRNA寡核苷酸序列
对载体进行酶切、退火、连接、转化、菌落鉴定等操作[11-12]。5种质粒分别命名为shRNA1-Adr、shRNA2-Adr、shRNA3-Adr、shRNA4-Adr和scrambled。
用RT-qPCR筛选干扰效果。分别用shRNA1-Adr、shRNA2-Adr、shRNA3-Adr、shRNA4-Adr、scrambled载体与表达载体共同转染293T细胞,测定Adra1d mRNA的表达水平。Adra1d的正向引物序列为5’-TCAAGCCTACT CAACTGCTGG-3’,反向引物序列为5’-TGTTACAACGAAAGGCAGACTG-3’;β-actin的正向引物序列为5’-CAGGGCGTGATGGTGGGCA-3’,反向引物序列为5’-CAAACATCATCTGGGTCATCTTCTC-3’。
选定合适的shRNA载体,将其与辅助质粒共转染293T细胞。5种病毒分别命名为Lv-shRNA1-Adr、Lv-shRNA2-Adr、Lv-shRNA3-Adr、Lv-shRNA4-Adr和Lv-scrambled。对慢病毒进行浓缩纯化,测定滴度和感染复数(multiplicity of infection,MOI)。用含8 mg/L转染增强液的培养液对慢病毒原液稀释,使其MOI值分别为15、30、45、60和75。用不同MOI值的稀释液培养VSMCs。
将VSMCs接种入96孔板中,培养过夜。24 h后,细胞汇合度达30%~40%可进行转染。向VSMCs加入最适MOI值的稀释后培养液,转染12 h后换液。3 d后,更换为含1 μg/L嘌呤霉素的筛选培养基。20 d后,向VSMCs中加入含0.5 μg/L嘌呤霉素的培养液。冻存同一批次的细胞20支备用。
2.3RT-qPCR检测Adra1d和CaM的mRNA表达 收集转染后的VSMCs测定Adra1d mRNA的相对表达量。分别收集正常和转染的VSMCs测定CaM mRNA相对表达量。以β-actin为内参照。冰上收集细胞并裂解,提取总RNA。CaM的正向引物序列为3’-ACTCCACCTACGACTACC-5’,反向引物序列为 5’-TGAGGTGGATGCTGATGG- 3’。依据说明加入反转录体系,室温放置10 min,之后42 ℃和95 ℃下分别15 min和5 min,反转录之后得cDNA模板。将模板加入扩增反应,反应条件为: 95 ℃ 45 s, 60 ℃ 45 s, 72 ℃ 1 min,连续循环30次;最后在72 ℃条件下持续5 min。计算CaM mRNA的相对表达量。
2.4Western blot检测Adra1d和CaM蛋白的表达 收集转染后的VSMCs测定Adra1d的蛋白表达量。分别收集正常的和转染后的VSMCs测定CaM的蛋白表达量。以β-actin为内参照。冰上收集细胞并裂解,提取蛋白质。取40 μg蛋白质经凝胶电泳分离,恒压电转到NC膜上,脱脂牛奶封闭 3 h, TBST 连续3次洗膜。将NC膜置于相应的Ⅰ抗溶液中(CaM稀释比例为1 ∶1 000,β-actin稀释比例为1∶4 000),4 ℃过夜。用TBST连续3次洗膜,然后将膜置于HRP标记的Ⅱ抗(稀释比例为1∶4 000),室温孵育2 h,连续3次洗膜。向NC膜滴加ECL(300 μL)显色液,显影检测,扫描条带,然后用ImageJ对各条带的灰度值进行计算。
2.5VSMCs内钙离子浓度的测定 Fluo-4/AM(3 μmol/L)标记大鼠主动脉VSMCs内Ca2+,激光共聚焦显微镜检测VSMCs内Ca2+荧光强度的变化,以之间接反映VSMCs内游离Ca2+浓度。
3 统计学处理
采用SPSS 19.0进行统计分析,数据以均数±标准差(mean±SD)表示,组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 原代大鼠主动脉VSMCs的培养及鉴定
大鼠胸主动脉组织块培养1周后出现VSMCs,12 d后VSMCs汇合,见图1A;经α-SMA免疫组化染色后,可见胞质呈棕色,见图1B。
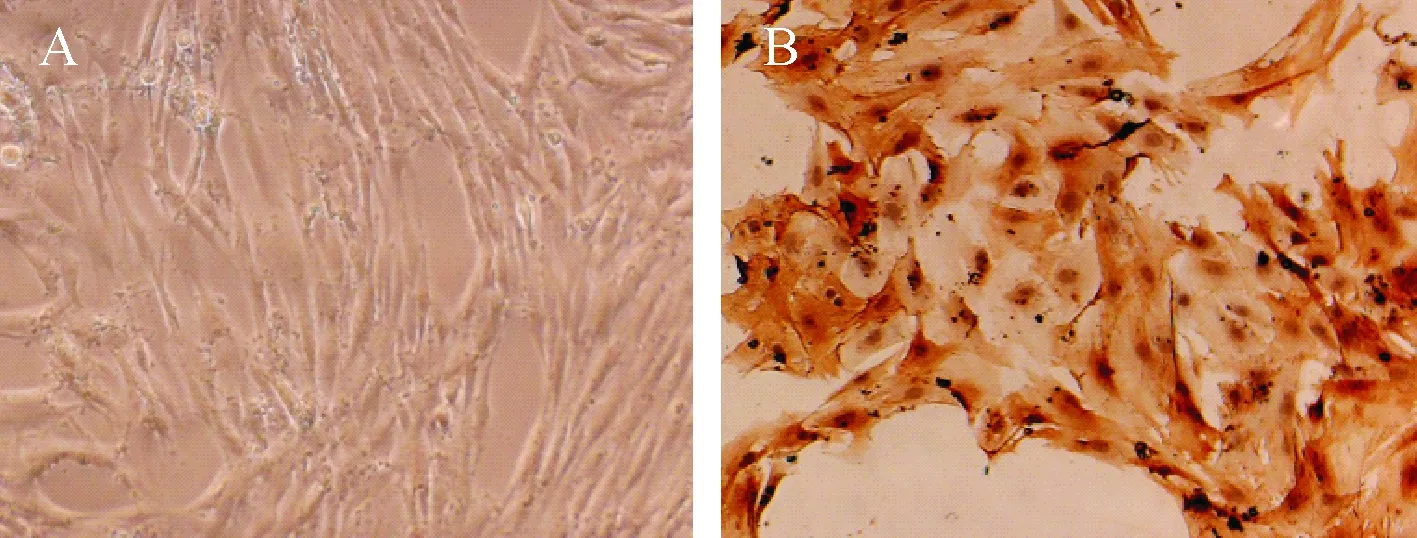
Figure 1. Primary culture and identification of rat aortic VSMCs (×100). A: primary culture of VSMCs; B: identification of VSMCs by immunocytochemical staining of α-SMA.
图1大鼠主动脉血管平滑肌细胞的培养和鉴定
2 RT-qPCR筛选干扰效果
RT-qPCR结果显示,与scrambled组相比,shRNA1、shRNA2、shRNA3和shRNA4组中Adra1d的mRNA表达差异均有统计学意义(P< 0.05),且shRNA4组的Adra1d mRNA表达量最低,见图 2。因此,我们选择shRNA4序列构建载体,并包装慢病毒。
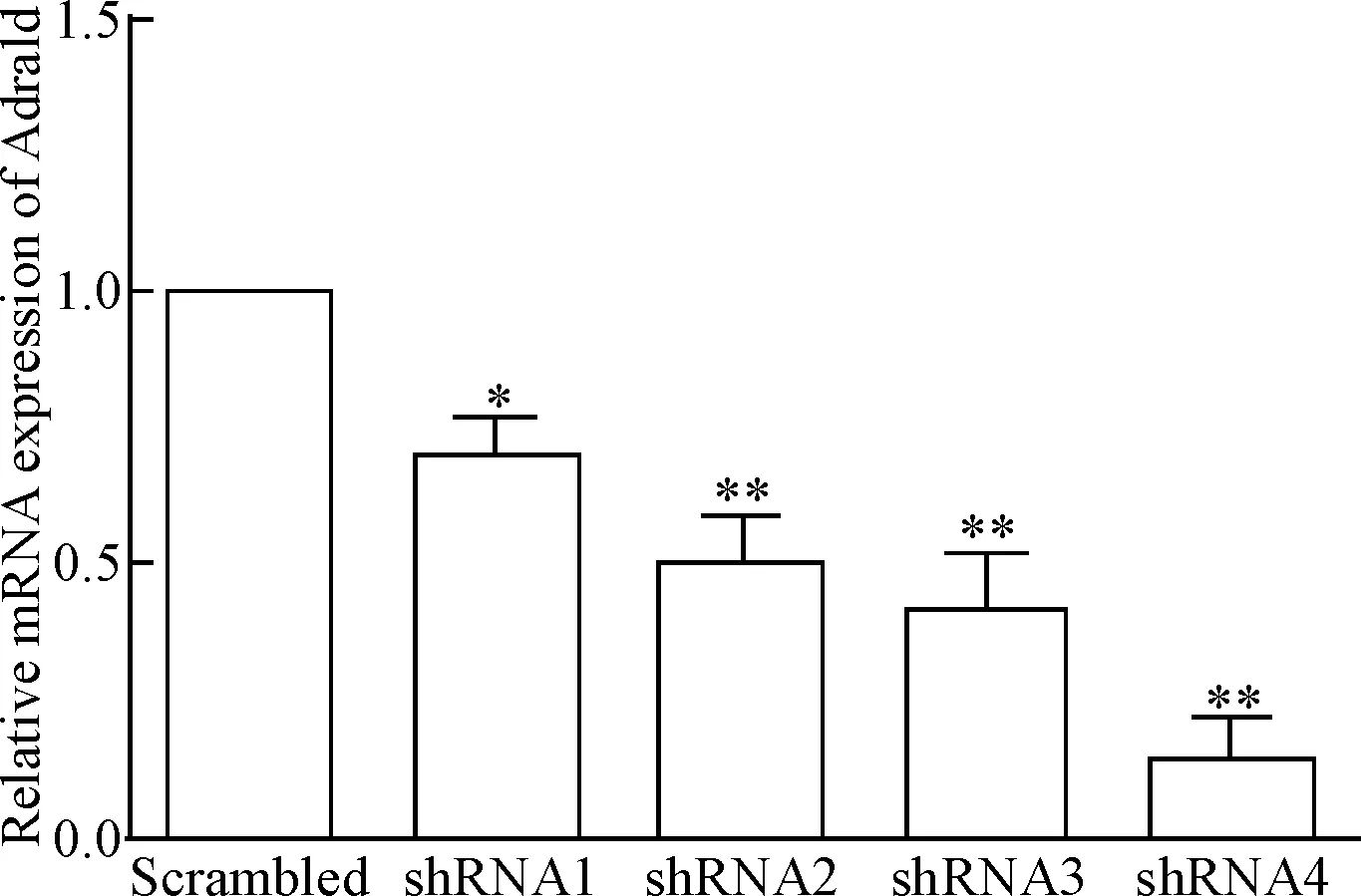
Figure 2. The mRNA expression of Adra1d in 293T cells after transfection with 5 different shRNA plasmids. Mean±SD.n=6.*P<0.05,**P<0.01vsscrambled group.
图25种不同的shRNA质粒转染293T细胞后的Adra1dmRNA表达
3 慢病毒转染后大鼠主动脉VSMCs内Adra1d的mRNA和蛋白表达
与scrambled组比较,转染后VSMCs的Adra1d mRNA和蛋白表达量均显著下调(P<0.01),见图3。
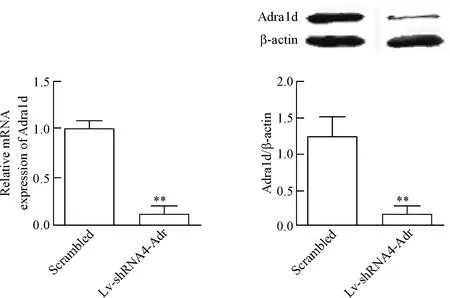
Figure 3. The expression of Adra1d at mRNA and protein levels in the VSMCs after Lv-shRNA4-Adr transfection. Mean±SD.n=6.**P<0.01vsscrambled group.
图3Lv-shRNA4-Adr转染大鼠主动脉VSMCs后Adra1d的mRNA和蛋白表达
4 大鼠主动脉VSMCs内Ca2+浓度的变化
Adra1d基因靶向沉默后,VSMCs的Ca2+荧光强度显著高于scrambled组(P<0.01),见图4。

Figure 4. The changes of [Ca2+]iintensity in rat aortic VSMCs (×100). Mean±SD.n=6.**P<0.01vsscrambled group.
图4大鼠主动脉VSMCs内Ca2+浓度的变化
5 慢病毒转染后CaM表达量的变化
对比正常大鼠主动脉VSMCs,Adra1d基因靶向沉默后, VSMCs中CaM的mRNA和蛋白表达量均显著增加(P<0.05),见图5。
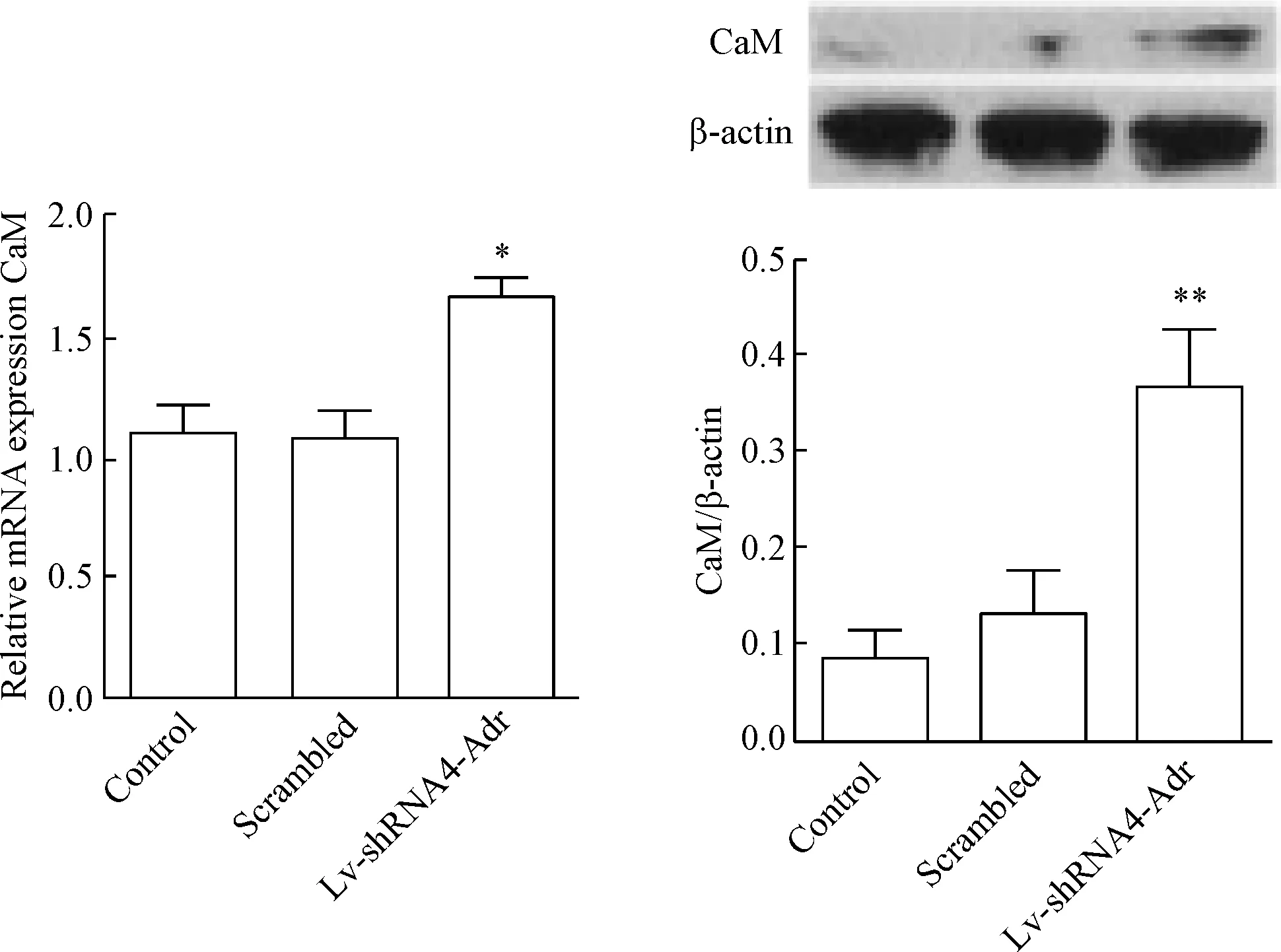
Figure 5. The expression of CaM in the rat aortic VSMCs. Mean±SD.n=6.*P<0.05,**P<0.01vsscrambled group.
图5大鼠主动脉血管平滑肌细胞CaM的mRNA和蛋白表达
讨 论
VSMCs通过调控多种收缩蛋白、离子通道和信号分子而调节血管的舒缩活动。α1D-AR存在于细胞膜上,可调控收缩舒张信号通路。α1D-AR的升压作用可能与它促进细胞收缩有关[13],在苯肾上腺素导致VSMCs收缩的过程中,VSMCs的收缩速度与α1-AR的各亚型分布有关[14],α1-AR各亚型可能通过影响交感神经调节血压的频率和振幅从而调节血压。相关研究表明,在儿茶酚胺所引起的升压作用中,约有70%的作用是由α1D-AR引起的[14],α1D-AR在大动脉收缩过程中发挥重要作用[15]。α1D-AR不仅可以直接调控血管收缩[16],还可能通过调节其它亚型α1-AR的表达量从而发挥作用[17]。可见,Adra1d基因与血压升高过程密切相关,该基因对高血压有潜在的治疗作用,因此,构建Adra1d基因的shRNA慢病毒载体有重要意义。
本实验结果显示,慢病毒介导转染Adra1d基因shRNA可增加大鼠主动脉VSMCs内Ca2+浓度,Adra1d基因被靶向沉默后,大鼠主动脉VSMCs的Ca2+荧光强度显著高于scrambled组。而且与scrambled组相比较,转染Adra1d基因shRNA的大鼠主动脉VSMCs中的CaM mRNA和蛋白表达量均显著增加,而Ca2+和CaM作为细胞收缩过程中的关键因子和蛋白,其浓度增加之后,均可引发VSMCs发生收缩。
Sun等[6]针对Adra1d基因设计合成了siRNA,将siRNA导入大鼠VSMCs中,发现Adra1d基因的蛋白表达量显著下降。本实验结果显示,慢病毒介导转染Adra1d基因shRNA可显著降低大鼠VSMCs内Adra1d的mRNA和蛋白表达量。基于Adra1d基因与血压升高过程密切相关,所以本次研究结果将对指导临床高血压的治疗,寻找新的治疗靶点有重要意义。
