基于HepG2细胞胰岛素抵抗模型探讨miR-7-5p对Itch基因的靶向作用*
2018-07-27吴亚柳于曼丽王文栋常晓彤
吴亚柳, 马 玉, 于曼丽, 王文栋, 郝 敏, 常晓彤
(河北北方学院临床检验诊断学重点实验室, 河北 张家口 075000)
胰岛素抵抗(insulin resistance)发病机制复杂,涉及多个代谢组织、多种调控因子和多条信号通路的交互作用[1]。微小RNA(microRNAs,miRNAs,miR)是一类广泛存在于真核生物中的内源性短链非编码RNA分子,在转录和转录后水平调控基因表达。已有研究表明,多种胰岛素作用的靶组织如胰腺、脂肪及肝脏组织等miRNAs表达谱发生改变[2-4]。泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是机体蛋白质降解的主要途径,可靶向降解胰岛素和炎症等相关信号通路的信号分子,阻断其信号转导,直接或间接影响机体糖脂代谢[1]。目前,关于胰岛素信号通路、UPS和miRNAs三者之间是否存在交互作用尚无报道。
本课题组前期通过基因芯片筛选出高脂饮食诱导的胰岛素抵抗小鼠肝脏组织mmu-miR-7a-5p(MIMAT0000677)显著下调[5]。经miRBase数据库(http://microrna.sanger.ac.uk)分析证实,mmu-miR-7a-5p与人类hsa-mir-7-5p(MIMAT0000252)同源性可达100%。生物信息学分析表明,其预测靶基因较多的富集于UPS,其中E3泛素连接酶Itch可与磷脂酰肌醇3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunit alpha,PIK3CA)直接相互作用,降低胞内磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)的p110催化亚基的生成,直接影响胰岛素信号通路重要分支PI3K-蛋白激酶B(protein kinase B,Akt)通路的正常转导。目前关于miR-7-5p对Itch蛋白表达的调控作用及其与胰岛素抵抗的相关性尚无报道。为此,本研究基于miR-7-5p在多个物种间的同源性,建立软脂酸(palmitic acid,PA)诱导的人肝癌细胞HepG2胰岛素抵抗模型,检测miR-7-5p及其预测靶基因Itch的表达变化,探讨miR-7-5p对Itch基因的靶向作用及其与胰岛素抵抗的关系。
材 料 和 方 法
1 细胞
人肝癌细胞HepG2购自上海沪震生化有限公司。
2 主要试剂和仪器
DMEM低糖培养基和胎牛血清购自Gibco;软脂酸和胰岛素购自Sigma;不含脂肪酸的牛血清白蛋白和BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;总RNA提取试剂TRIzol、逆转录试剂FastQuant RT Kit (With gDNase)和实时荧光定量PCR试剂SuperReal PreMix Plus (SYBR GreenⅠ)均购自北京天根生化科技有限公司;葡萄糖测定试剂盒(葡萄糖氧化酶法)购自中生北控生物科技股份有限公司;尼罗红购自MCE;CCK-8试剂盒和Hoechst 33258 染色液购自碧云天生物技术公司;抗Itch抗体购自北京博奥森生物技术有限公司。T6新世纪紫外可见分光光度计购自北京谱析通用仪器有限责任公司;Multiskan MK3型酶标仪购自Thermo; Rotor-Gene Q实时荧光定量PCR仪购自QIAGEN;Omega Lum G凝胶成像系统购自环亚生物科技有限公司。
3 主要方法
3.1细胞培养 人肝癌细胞HepG2生长于含10%胎牛血清,1‰青、链霉素的DMEM低糖培养基中,在37 ℃、5% CO2、饱和湿度条件下常规培养。当细胞贴壁生长至80%~90%融合时,用0.25%胰蛋白酶消化后,按1∶2比例传代培养,取对数生长期细胞用于实验。
3.2软脂酸溶液的配制 准确称取51.3 mg软脂酸加入5 mL 40 mmol/L NaOH溶液,70 ℃水浴加热,振荡至液体澄清,配制成40 mmol/L的PA溶液。将1 mL 40 mmol/L的PA溶液缓慢溶于19 mL 10%不含脂肪酸的牛血清白蛋白溶液中,配制成2 mmol/L PA母液,针筒滤器过滤除菌。用含10%胎牛血清的DMEM低糖培养基按比例稀释成不同浓度的PA处理液。
3.3HepG2细胞胰岛素抵抗模型的建立 取对数生长期的HepG2细胞,调整细胞密度为5×107/L,接种到相应的细胞培养板中。选定生长24~48 h之间的细胞[6-7],给予不同浓度的PA诱导,以确定使其产生胰岛素抵抗的最适宜PA浓度。实验设空白对照组、阴性对照组和3个胰岛素抵抗实验组,每组3个平行孔。空白对照组不加细胞只含有DMEM低糖培养基,阴性对照组为不加PA诱导的HepG2细胞,3个胰岛素抵抗组是浓度分别为0.25、0.50和0.75 mmol/L PA诱导的HepG2细胞。
3.4CCK-8法检测PA对HepG2细胞活力的影响 取对数生长期HepG2细胞,并调整其细胞密度为5×107/L,每孔100 μL接种于96孔板,37 ℃培养24 h后,弃去培养基,用PBS洗涤3次。阴性对照(control)组只加入细胞培养液,处理组加入含有不同浓度(0.25、0.50和0.75 mmol/L)PA的处理液,培养24 h后,每孔加入10 μL CCK-8溶液孵育2 h。以加了相应量的细胞培养液和CCK-8溶液但没有加入细胞的孔作为空白对照(blank)组,酶标仪在450 nm处测定各孔吸光度(A)。细胞活力(%)=(处理组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。
3.5葡萄糖氧化酶法检测各组细胞葡萄糖消耗量 同理将细胞密度为5×107/L的细胞培养液接种于24孔板,每孔500 μL,37 ℃培养24 h。细胞分组与软脂酸处理如前所述,PA处理液诱导24 h后,弃去培养基,PBS洗涤3次,加入含有1×10-9mol/L胰岛素的正常培养液孵育12 h。以加入相应量的细胞培养液但没有加入细胞的孔作为空白对照,用葡萄糖氧化酶法检测细胞培养上清液中葡萄糖含量,计算各组细胞葡萄糖消耗率。葡萄糖消耗率(%)=(空白对照组葡萄糖含量-各组细胞上清液葡萄糖含量)/空白对照组葡萄糖含量×100%。
3.6尼罗红染色观察HepG2细胞内的脂质堆积 选取对数生长期的细胞,调整细胞密度为5×107/L,每孔2 mL接种到6孔板内的爬片上。按上述细胞模型建立的方法进行不同的处理后,弃去培养基,用PBS液洗涤3遍。用固定液固定细胞10 min,PBS摇床洗涤2遍,每次3 min,每孔加入0.5 mL尼罗红染液,室温摇床避光染色20 min,PBS摇床洗涤2遍,每次3 min;每孔加入0.5 mL Hoechst染液,室温摇床避光染色5 min,PBS摇床洗涤2遍,每次3 min;晾干后用荧光抗淬灭剂封片,荧光显微镜下观察细胞形态。
3.7RT-qPCR检测miR-7-5p的表达差异 在HepG2细胞胰岛素抵抗模型建立的基础上,运用课题组前期的实验方法[5],即TRIzol法提取HepG2细胞总RNA,经FastQuant RT Kit (With gDNase)反转录得到cDNA,采用SYBR GreenⅠ荧光定量试剂盒检测miR-7-5p的表达情况。miR-7-5p所用茎环引物为5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTG-GATACGACACAACA-3’,上游引物为5’-GTGGAAGACTAGTGATTTTGTTGTGT-3’,下游引物为5’-CGCAGGGTCCGAGGTATTC-3’,内参照U6的上游引物为5’-ATTGGAACGATACAGAGAAGATTAGC-3’,下游引物为5’-TGGAACGCTTCACGAATTTG-3’。反应体系为20 μL,条件为95 ℃ 15 min预变性;95 ℃ 10 s、61 ℃ 20 s、72 ℃ 27 s采集荧光信号,共40个循环。以U6作为内参照,2-ΔΔCt法计算其相对表达量。
3.8生物信息学分析 利用TargetScan数据库(http://www.targetscan.org/vert-50/)和miRDB数据库(http://www.mirdb.org/miRDB/)共同预测miR-7-5p的靶基因,KEGG数据库(http://www.kegg.jp/)分析差异表达的miR-7-5p靶基因可能富集的生物学信号通路。STRING 10.0(http://www.string-db.org/)对预测靶基因与胰岛素信号通路相关蛋白的相互作用进行分析。
3.9RT-qPCR检测miR-7-5p预测靶基因Itch转录水平的表达差异 方法同3.7,利用Itch基因的上游引物5’-GAATATGCAGGGAAGGATAACTACT-3’和下游引物5’-CAACTGGTTTGTTCAAGATACGC-3’,采用SYBR GreenⅠ荧光定量试剂盒检测胰岛素抵抗状态下HepG2细胞中Itch mRNA的表达差异。
3.10Western blot检测miR-7-5p预测靶基因Itch翻译水平的表达变化 用RIPA裂解液提取胰岛素抵抗状态下HepG2细胞的总蛋白质,取100 μg的蛋白质样品经8% SDS-PAGE分离蛋白质。恒压13 V,湿转12 h,将分离后的目的蛋白转移至硝酸纤维素膜上,5%的脱脂奶粉封闭过夜。然后加入兔抗人Itch抗体(1 ∶200),4 ℃过夜。用PBS/PBST洗膜后加入HRP标记的羊抗兔IgG(1 ∶2 000),室温摇床孵育1 h,经PBS/PBST再次洗膜后加入ECL发光液曝光显影,分析灰度值。
4 统计学处理
实验数据采用SPSS 19.0统计软件进行分析,结果用均值±标准差(mean±SD)表示,两组间的差异用Student’st检验分析,两组以上的组间差异采用单因素方差分析进行比较。以P<0.05为差异有统计学意义。
结 果
1 HepG2细胞胰岛素抵抗模型建立
1.1不同浓度PA对HepG2细胞活力的影响 与正常对照组相比,0.25 mmol/L PA作用于HepG2细胞24 h,对细胞增殖没有明显的抑制作用;但当PA浓度由0.50 mmol/L增大至0.75 mmol/L时,对细胞活力产生明显的抑制作用,细胞数目减少,出现明显的细胞损伤,差异有统计学意义(P<0.01),见表1。
1.2不同浓度PA对HepG2细胞葡萄糖消耗率的影响 与阴性对照组相比,PA浓度由0.25 mmol/L增加到0.75 mmol/L时,处理组细胞对葡萄糖的消耗率逐渐降低,差异均有统计学意义(P<0.01),PA浓度为0.75 mmol/L时培养基中葡萄糖消耗率达到最低,提示经PA诱导后,HepG2细胞对胰岛素的敏感性下降,葡萄糖利用降低,产生了胰岛素抵抗,见表1。
1.3尼罗红染色观察HepG2细胞的脂质堆积情况 不同浓度的PA作用于HepG2细胞24 h后,在荧光显微镜下观察细胞形态,细胞质内的脂滴经尼罗红染成鲜红色,细胞核经Hoechst染成深蓝色。正常细胞胞质中仅见少量较小脂滴,处理组细胞随着PA浓度的增加,胞质内堆积的鲜红色脂滴逐渐增多、增大,见图1。
表1不同浓度软脂酸对HepG2细胞活力和葡萄糖消耗率的影响
Table 1. The effects of PA at different concentrations on the viability and glucose consumption of HepG2 cells (Mean±SD.n=3)

GroupA450Cellviability(%)Glucose▲(mmol/L)Glucoseconsumptionrate(%) Control2.3700±0.0184100%3.2767±0.075747.19% Blank0.1135±0.002106.2050±0.03540 0.25mmol/LPA2.2725±0.031895.68%3.6633±0.0635∗∗40.96% 0.50mmol/LPA2.1535±0.0276∗90.40%3.9200±0.0624∗∗36.82% 0.75mmol/LPA1.8245±0.0304∗∗75.82%4.3700±0.0854∗∗29.57%
▲the glucose concentration in the culture supernatant of the HepG2 cells;*P<0.05,**P<0.01vscontrol group.
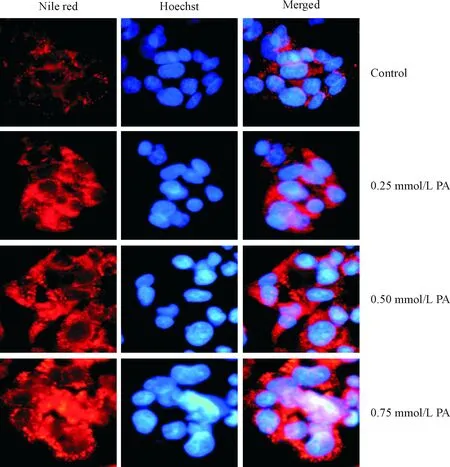
Figure 1. Lipid accumulation in the cytoplasm of HepG2 cells treated with different concentrations of PA (Nile red staining, ×400).
图1不同浓度PA作用于HepG2细胞后胞质内脂质堆积情况
综上所述,与正常对照组相比,当0.25 mmol/L PA作用于HepG2细胞24 h后,细胞活力较好,对葡萄糖利用率降低,胞质内脂质堆积增加,所以当PA作用时间为24 h时,诱发HepG2细胞产生胰岛素抵抗最适宜的浓度为0.25 mmol/L。
2 miR-7-5p在胰岛素抵抗HepG2细胞中显著下调
分别从正常HepG2细胞和经0.25 mmol/L PA干预24 h后的HepG2细胞中抽提总RNA,随后反转录总RNA,用miR-7-5p特异性引物进行RT-qPCR。结果显示,miR-7-5p在HepG2细胞胰岛素抵抗模型中的表达水平显著低于正常HepG2细胞(P<0.01),见表2。这提示miR-7-5p可能参与了HepG2细胞胰岛素抵抗过程。
表2胰岛素抵抗状态下HepG2细胞中miR-7-5p和ItchmRNA表达的相对定量结果
Table 2. The relative quantitative results of miR-7-5p and Itch mRNA expression in the HepG2 cells with insulin resistance (ΔCt. Mean±SD.n=3)

GroupmiR⁃7⁃5pItchmRNA Control-3.480±0.2159.532±0.312 Insulinresistance-2.510±0.448∗∗9.470±0.166
**P<0.01vscontrol group.
3 生物信息学分析
经miRBase数据库证实miR-7-5p在不同的物种间具有较好的同源性,见图2。对TargetScan和miRDB预测出的miR-7-5p靶基因进行KEGG信号通路分析发现,miR-7-5p的靶基因富集于多条与胰岛素抵抗相关的信号通路,如MAPK信号通路、Toll样受体(Toll-like reporters,TLRs)信号通路及2型糖尿病信号通路等。值得注意的是,其中有相当数量的靶基因富集于泛素-蛋白酶体系统。蛋白质互作网络表明E3泛素连接酶Itch可与胰岛素信号通路相关蛋白PIK3CA直接相互作用。E3泛素连接酶Itch在不同物种间具有较好的同源性,且预测分值较高,miR-7-5p与Itch 3’-非翻译区(3’-untranslated region,3’-UTR)的结合位点见图3。
Figure 2. The homology of miR-7-5p in different species.
图2不同物种间miR-7-5p同源性比对
Figure 3. The homology ofItchgene in different species and the binding site between miR-7-5p and Itch 3’-UTR.
图3Itch基因在不同物种间的同源性及miR-7-5p与Itch3’-UTR的结合位点
4 胰岛素抵抗状态下miR-7-5p预测靶基因Itch在翻译水平表达上调
运用RT-qPCR的方法检测miR-7-5p预测靶基因Itch的mRNA表达量,结果显示胰岛素抵抗组中Itch基因在转录水平的表达与正常对照组比较,差异无统计学显著性,见表2。Western blot检测结果显示胰岛素抵抗组中Itch基因在翻译水平的表达量比正常对照组上调,差异具有统计学意义(P<0.01),见图4。这提示miR-7-5p可能与Itch mRNA的3’-UTR种子序列结合,在翻译水平影响Itch蛋白表达,从而参与胰岛素抵抗的发生与发展。
讨 论
胰岛素抵抗相关的信号通路作用网络复杂,目前已知其病理机制涉及炎症、内质网应激和肠道菌群失调[8]。研究表明,miRNAs作为一种调控的媒介,除了能作用于胰岛素信号通路的各级信号分子,也广泛参与了炎症等相关信号通路介导的胰岛素抵抗的发生。既有研究表明,高脂饮食小鼠体内JNK1磷酸化的增强可导致miR-122表达下调,蛋白质酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)是miR-122的直接靶蛋白,后者的表达升高可使胰岛素受体(insulin receptor,IR)和胰岛素受体底物(insulin receptor substrate,IRS)酪氨酸残基去磷酸化而抑制胰岛素信号通路,诱导胰岛素抵抗发生[9];在线粒体功能失调的条件下,表达上调的miR-96也可直接靶向抑制IRS1,诱发胰岛素抵抗,降低糖原合成[10]。
Figure 4. The expression of predictive target geneItchof miR-7-5p under insulin resistance. Mean±SD.n=3.**P<0.01vscontrol group.
图4胰岛素抵抗状态下miR-7-5p预测靶基因Itch的蛋白表达
本实验通过建立HepG2细胞胰岛素抵抗模型,在细胞水平证实胰岛素抵抗状态下miR-7-5p表达下调,揭示miR-7-5p表达的改变与胰岛素抵抗的发生发展存在一定的相关性。Zhang等[11]应用RNA-seq技术,比较第1天和第7天产后大鼠乳腺RNA样本中的miRNAs表达谱,发现rno-miR-7a-5p表达下调,推测其可能参与了乳腺发育和功能的调节。在长期缺氧的情况下,大鼠心脏δ-类鸦片活性肽受体的活化能使miR-7a-5p表达下调,揭示其可能与心脏缺氧/缺血性损伤相关[12]。Li等[13]的研究表明,miR-7a/b对于缺血/再灌注损伤是敏感的,并且通过负向调节多聚ADP-核糖聚合酶[poly(ADP-ribose) polymerase,PARP]的表达,在保护心肌细胞应对I/R-诱导凋亡方面起到重要作用。目前,尚未看到miR-7-5p与胰岛素抵抗的相关性报道。
我们通过对miR-7-5p的靶基因进行预测和KEGG信号通路分析,发现有一定数量的靶基因富集于UPS。UPS可参与细胞内80%以上蛋白质的降解,其功能的发挥有赖于3种酶的调控,分别为E1泛素活化酶、E2泛素结合酶和E3泛素连接酶,其中E3泛素连接酶对底物蛋白的特异性识别是启动泛素化降解的关键步骤[14]。Itch是E3泛素连接酶HECT家族的成员,本研究结果表明,胰岛素抵抗状态下,Itch在翻译水平表达上调,可能通过选择性降解PIK3CA,抑制胰岛素PI3K-Akt信号通路转导。既有文献报道Itch蛋白水平降低与胰岛素抵抗状况改善相关。Itch-/-小鼠肝脏中,抗炎细胞因子白细胞介素13(interleukin-13,IL-13)表达增加,后者作用于肝脏IL-13Rα1/IL-4Rα,使信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)磷酸化增强,进而降低葡萄糖产量,抑制糖异生基因表达,改善了胰岛素抵抗状态[15]。研究揭示,用高脂饮食喂养的Itch-/-小鼠,其脂肪组织中浸润的巨噬细胞中抗炎的M2型巨噬细胞比例明显增加,胰岛素抵抗症状明显改善[16]。但是在胰岛素抵抗状态下,关于Itch的上游调控分子及其与胰岛素信号通路关键蛋白的直接相互作用,尚未见报道。
综上所述,本研究以HepG2细胞胰岛素抵抗模型为基础,在细胞水平上首次证实miR-7-5p在胰岛素抵抗状态下显著下调,并且初步验证了miR-7-5p与其预测靶基因Itch存在相互作用。该结果为研究胰岛素抵抗的发病机制提供了一种新的可能。未来,需要通过双萤光素酶报告基因实验进一步验证miR-7-5p与Itch之间的直接靶向关系,并深入研究二者的生物学作用及其与胰岛素抵抗的相关性。
