牛磺酸锌对血管性痴呆小鼠学习和记忆能力的影响*
2018-07-27齐汝霞杨欣欣程葆华
齐汝霞, 张 鹏, 孙 涛, 杨欣欣, 程葆华△
(济宁医学院 1药理学教研室, 2解剖学教研室, 3临床医学院, 山东 济宁 272067)
血管性痴呆(vascular dementia,VD)是脑血管疾病引起的以大脑认知和记忆功能障碍为主要临床表现的临床综合征,是老年性痴呆的常见的病因之一。60 岁以上老年人发生脑缺血性疾病后,约26.3%患者继发痴呆。随着人口老龄化及脑卒中治疗后存活率的提高,VD发病率呈上升趋势,严重影响人们生活质量。VD是老年性痴呆中唯一可以防治的痴呆,如果早期治疗具有可逆性[1]。牛磺酸是一种含硫的非蛋白氨基酸,在海马、大脑皮层和小脑等神经系统中含量丰富。牛磺酸通过提高抗氧化酶活性,产生抗炎抗氧化作用[2];降低大脑组织中脂褐质的含量,提高超氧化物歧化酶(superoxide dismutase,SOD)活性;拮抗兴奋性递质谷氨酸的毒性,有效清除脑内自由基、抗脂质过氧化,促进大鼠的学习和记忆能力[3]。牛磺酸通过抑制c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)及细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2, ERK1/2) 的激活,减轻氧化应激及炎症反应[4]。锌是人体必需的微量元素之一,调节人体生长发育、内分泌、免疫和生殖遗传等生理功能,内源性锌通过NMDA受体激活离子通道,还可以激活NMDA受体,目前认为NMDA受体是缺锌影响学习和记忆的重要机制之一[5]。牛磺酸锌(taurine-zinc,TZC)是牛磺酸和无机锌盐的螯合物, 作为一种新的治疗药物或金属元素补充剂[6],其对血管性痴呆小鼠的记忆功能是否有保护作用,尚未见报道。据此,本研究旨在观察牛磺酸锌对血管性痴呆小鼠学习和记忆功能的影响,通过检测肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达和一氧化氮(nitric oxide,NO)含量,进一步探讨其机制。
材 料 和 方 法
1 材料
1.1实验动物 SPF级健康昆明种小鼠60只,雄性,体重20~25 g,由山东鲁抗医药股份有限公司提供,许可证号为SCXK(鲁)20130001。实验前动物在恒温、恒湿实验室饲养1周,自由进食,自由饮水。
1.2实验药品 牛磺酸锌,纯度 99%,医药食品级(石家庄维平功能食品科技有限公司);醋酸地塞米松注射液(江苏豪森药业股份有限公司,批号国药准字20000462);水合三氯乙醛(上海白鹤化工厂,批准文号为国药准字H37022673);TNF-α和IL-1β ELISA试剂盒均购自武汉博士德生物工程有限公司。
1.3实验仪器 计重秤ACS-D11(上海乾峰电子仪器有限公司);BS2242电子天平(北京赛多利斯仪器系统有限公司);UV-2000紫外可见分光光度计[尤尼柯(上海)仪器有限公司];程控水迷宫SMG-2(医科院药研所);跳台自动测试仪DT-200(成都泰盟科技有限公司);MK3型酶标仪(Labsystem Dragon)。
2 实验方法
2.1实验分组和给药方法 将小鼠随机分为5组:模型(model)组、假手术(sham)组、TZC 50 mg/kg、100 mg/kg和200 mg/kg组。给药组按10 mL/kg灌胃,模型组和假手术组均给予等体积生理盐水灌胃,连续14 d后造模。
2.2血管性痴呆模型的制备 小鼠术前禁食12 h,不禁水,采用双侧颈总动脉反复缺血再灌注法制备VD动物模型。用10%水合氯醛0.35 g/kg腹腔注射麻醉后,仰卧位固定,消毒后,在颈部正中切开并分离双侧颈总动脉,暂时性夹闭双侧颈动脉造成脑缺血,20 min后,再灌注10 min,连续2次,同时尾部放血大约 0.3 mL[7]。假手术组小鼠只分离双侧颈总动脉,不夹闭动脉,也不进行尾部放血,观察时间与其它组相同。造模后腹腔注射盐酸地塞米松注射液50 mL/kg。术后观察小鼠肢体瘫痪,站立,肢体屈曲和行走情况。采用Longa的“5分法”进行神经学评分,一侧前肢不能完全伸直,向一侧旋转,行走向一侧倾斜,均为有效模型[8]。
2.3ELISA法检测TNF-α和 IL-1β含量 造模成功后6 h,取大脑组织100 mg,按1∶9比例加入冰生理盐水,制成10%脑组织匀浆,在4 ℃、 3 500 r/min离心10 min,取上清液,测定蛋白浓度,分别按其ELISA试剂盒说明书测定TNF-α和IL-1β。
2.4脑组织中iNOS和NO水平的测定 造模成功后24 h用分光光度法检测VD小鼠脑组织iNOS和NO的浓度变化。术后24 h脱臼处死小鼠后,立即在冰浴中取其脑组织,用冰生理盐水冲洗,制成10%的组织匀浆,取上清液50 μL用分光光度计在530 nm波长下测其吸光度(A值),计算iNOS活力(×103U/g),取上清液用硝酸还原酶法在550 nm下测其吸光度(A值),进行NO含量(μmol/L)的测定。
2.5小鼠的行为学检测 造模后第3天继续按上述方法灌胃,直至实验结束。术后第20~24天进行小鼠水迷宫实验;术后第27~29天进行小鼠的跳台实验,测试小鼠的空间学习和记忆能力。
2.5.1水迷宫实验 水迷宫以棕黑色有机树脂玻璃为材料,数个垂直挡板构成的立方形槽式水池。大小为80 cm×37 cm×20 cm,水深12 cm,水温22~25 ℃。挡板构成的通道有4个视觉盲点。水池右下方迷宫的出口处有10层台阶供小鼠游出水面。测试需要3 d,前2 d为训练期,第3天是实验期,训练期每天训练2次,每次约120 s,小鼠从左上角入水到达台阶,在台阶上停留5 s,一次训练完成。实验从小鼠入水时开始计时,小鼠到达台阶终点时计时结束。小鼠从起点到达台阶的时间即为“潜伏期”,当小鼠2 min内游回台阶记录时间,若小鼠2 min内无法游回台阶则记录为120 s,由实验员引导至台阶停留5 s,记录错误次数。
2.5.2跳台实验 小鼠跳台反应箱大小80 cm×20 cm×20 cm,分为2间。箱底为提供24~32 V连续电刺激的铜栅,每间右后角设置一个高度为4 cm,直径也为4 cm的橡胶垫,可作为小鼠回避电击的安全区。训练时先将小鼠放入仪器中适应3 min,然后将小鼠置于仪器内的安全区,设定试验参数后底部通上28 V的电流,当小鼠从跳台上跳下四肢接触铜栅时会受到电击,正常的回避反应是跳上跳台返回安全区。小鼠受到电击后跳上安全区的时间为潜伏期,5 min内受电击次数为错误次数,作为小鼠学习能力的评价指标。24 h后正式实验,记录小鼠潜伏期和错误次数。
3 统计学处理
采用SPSS 17.0统计软件进行数据处理和统计分析。数据用平均值±标准差(mean±SD)表示,先采用单因素方差分析进行多组间比较,后采用SNK(Student-Newman-Keuls)法进行两两比较q检验,以P<0.05为差异有统计学意义。
结 果
1 各组小鼠脑组织中TNF-α和IL-1β表达的变化
与假手术组相比,模型组TNF-α和IL-1β均升高(P<0.05);与模型组比较,TZC 50 mg/kg组、TZC 100 mg/kg组和200 mg/kg组中TNF-α表达降低(P<0.05或P<0.01),且剂量越大,作用越强,TZC 50 mg/kg组、100 mg/kg组和200 mg/kg组中IL-1β含量减少(P<0.05),但无剂量依赖性,见表1。
表1各组小鼠脑组织中TNF-α和IL-1β表达的比较
Table 1. The expression of TNF-α and IL-1β in the brain tissues (μg/g. Mean±SD)
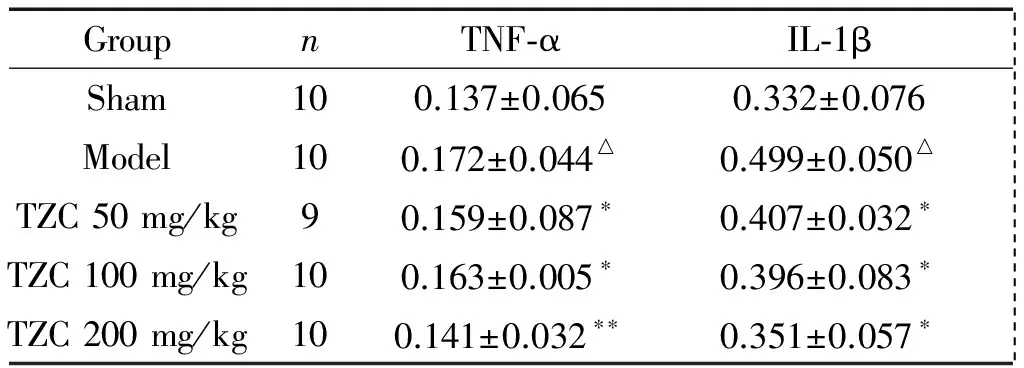
GroupnTNF⁃αIL⁃1β Sham100.137±0.0650.332±0.076 Model100.172±0.044△0.499±0.050△ TZC50mg/kg90.159±0.087∗0.407±0.032∗ TZC100mg/kg100.163±0.005∗0.396±0.083∗ TZC200mg/kg100.141±0.032∗∗0.351±0.057∗
△P<0.05vssham group;*P<0.05,**P<0.01vsmodel group.
2 各组小鼠脑组织iNOS和NO比较
与假手术组相比,模型组的iNOS和NO均升高(P<0.05);与模型组比较,TZC 50 mg/kg组、100 mg/kg组和200 mg/kg组的iNOS活性降低(P<0.05或P<0.01),TZC 50 mg/kg组、100 mg/kg组和200 mg/kg组NO含量明显减少(P<0.05或P<0.01),见表2。
表2各组小鼠脑组织iNOS活性和NO含量比较
Table 2. Comparison of iNOS activity and NO content (Mean±SD)
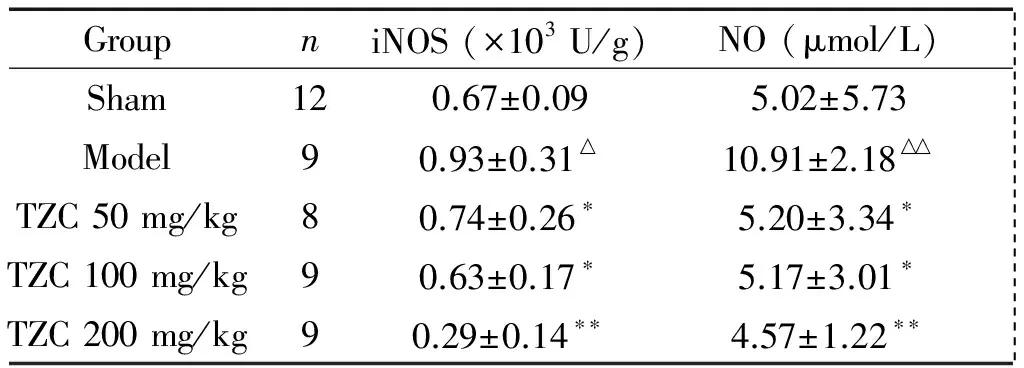
GroupniNOS(×103U/g)NO(μmol/L) Sham120.67±0.095.02±5.73 Model90.93±0.31△10.91±2.18△△ TZC50mg/kg80.74±0.26∗5.20±3.34∗ TZC100mg/kg90.63±0.17∗5.17±3.01∗ TZC200mg/kg90.29±0.14∗∗4.57±1.22∗∗
△P<0.05,△△P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
3 各组小鼠在水迷宫实验中潜伏期和错误次数比较
与假手术组比较,模型组在小鼠水迷宫实验中的错误次数明显增多(P<0.01),潜伏期明显延长(P<0.05);与模型组比较,TZC 50 mg/kg组、100 mg/kg组和200 mg/kg组小鼠在水迷宫错误次数显著减少(P<0.05或P<0.01),TZC 100 mg/kg和200 mg/kg组潜伏期明显缩短(P<0.05),见表3。
表3各组小鼠在水迷宫实验中潜伏期和错误次数的比较
Table 3. Comparison of latency and error times in water maze test (Mean±SD)

GroupnLatency(s)Errortimes Sham1251.2±37.35.5±2.9 Model975.4±23.6△11.4±3.3△△ TZC50mg/kg867.8±41.67.9±4.3∗ TZC100mg/kg944.2±18.2∗4.7±2.4∗∗ TZC200mg/kg920.1±7.1∗5.1±3.2∗∗
△P<0.05,△△P<0.01vssham group;*P<0.05,**P<0.01vsmodel group.
4 各组小鼠在跳台实验中潜伏期和错误次数比较
与假手术组比较,模型组在小鼠跳台实验中的错误次数明显增多(P<0.05),潜伏期明显缩短(P<0.05);与模型组比较,TZC 50 mg/kg组、100 mg/kg和200 mg/kg组错误次数明显减少(P<0.05),TZC 50 mg/kg组、100 mg/kg组和200 mg/kg组小鼠的潜伏期明显延长(P<0.05或P<0.01),见表4。
表4各组小鼠在跳台实验中潜伏期与错误次数的比较
Table 4. Comparison of latency and error times in step-down test (Mean±SD)

GroupnLatency(s)Errortimes Sham12181.3±85.60.5±0.6 Model949.8±37.9△1.4±0.5△ TZC50mg/kg8143.8±92.1∗0.7±0.8∗ TZC100mg/kg9177.5±106.3∗∗0.6±0.5∗ TZC200mg/kg9203.4±89.5∗∗0.4±0.6∗
△P<0.05vssham group;*P<0.05,**P<0.01vsmodel group.
讨 论
脑缺血是引起血管性痴呆和阿尔茨海默病等多种神经系统疾病的重要病理过程。本实验采用双侧颈总动脉缺血再灌注方法,制备VD模型,造成小鼠进行性的学习和记忆损伤。利用水迷宫和跳台实验,观察TZC对VD小鼠学习和记忆能力的影响;检测小鼠脑组织TNF-α、IL-1β、iNOS和NO水平的变化,进一步探讨其作用机制。
NO在脑缺血过程中发挥重要作用,一方面与缺血产生的氧自由基协同作用,造成神经细胞损伤[9];另一方面可以缩小梗死范围,增加皮质供血[10]。NOS是NO合成过程中的重要限速酶,iNOS是NOS中的一种,其在病理情况下表达后,可以生成大量的NO,过多的NO具有一定的细胞毒性作用[11],大量神经毒性物质的分泌,引起中枢神经系统损伤,使机体记忆功能减退。NO通过抑制线粒体呼吸功能和糖酵解功能、造成细胞能量代谢障碍,进而抑制DNA合成并损害DNA结构[12]。高浓度NO不但可生成NO-自由基,NO还可与超氧阴离子反应产生过氧化亚硝酰基离子(ONOO-)。大量氧自由基的生成,导致神经元死亡及脑组织损伤[13],进而影响机体的学习记忆功能,因此,NO含量升高是引发VD的重要病理生理学机制之一。本研究显示,TZC降低iNOS 活性,减少NO的产生;TZC干预后小鼠在水迷宫中的潜伏期明显缩短、错误次数减少,且具有剂量依赖性,证实其能改善VD小鼠的空间定向学习障碍。跳台实验是观察动物的被动回避能力,反应其记忆力的高低,TZC高、中、低剂量组均可使小鼠的跳台潜伏期明显延长,错误次数明显减少,说明其可提高VD小鼠的记忆能力。以上结果提示TZC通过降低iNOS 活性、减少NO生成,阻止脑缺血所致神经元的进行性损伤,提高VD小鼠的学习和记忆能力。
已有研究证实,脑缺血后,脑组织中某些炎性因子如TNF-α和IL-1β等表达增加,介导神经毒作用,引起神经元损伤[11],导致与记忆有关的神经递质如乙酰胆碱、去甲肾上腺素和5-羟色胺等的减少,促使 VD 的发生。而这些炎性因子也能从基因水平增加细胞内iNOS 的表达[14]。预先应用TZC治疗后,脑缺血后6 h脑组织中TNF-α和IL-1β表达减少,且呈明显的量效关系,说明TZC通过降低炎症介质TNF-α和IL-1β的表达,产生一定抗炎作用,减轻炎症反应对神经元的损伤。脑缺血24 h后发现iNOS和NO含量减少,证明其与TNF-α和IL-1β表达下降有相关性,与资料相符。
综上所述,TZC可提高VD小鼠的学习和记忆能力。其机制可能与其降低脑组织TNF-α、IL-1β、iNOS和NO水平,产生对VD小鼠早期的神经保护功能有关。脑缺血导致VD的机制是非常复杂的,TZC中的牛磺酸和锌对VD小鼠的学习和记忆功能有何影响以及TZC能否通过其它途径发挥作用还有待进一步研究。
