羟基磷灰石诱导脂肪间充质干细胞成骨分化的实验研究
2018-07-27程胜承刘义景亚青鞠明艳李光
程胜承,刘义,景亚青,鞠明艳,李光
间充质干细胞(mesenchymal stem cells,MSCs)是一类具有自我更新能力和多向分化潜能的单克隆成体干细胞,可以在一定诱导条件下向成肌、成脂、成骨、成软骨等多个方向分化[1]。MSCs具有支持造血、低免疫原性等优势[2],可用于自体或同种异体治疗[3]。MSCs分布广泛,骨髓、脂肪、骨片、牙髓、胎盘、脐带等多种组织中均可分离培养出MSCs[4]。其中,骨髓来源的MSCs——骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是目前研究最为清楚的MSCs之一,但是可提取的细胞数量相对较少,传代能力较弱,通常传代次数不超过6~10代[5]。脂肪来源的MSCs——脂肪间充质干细胞(adipose derived stem cells,ADSCs)因来源较容易、细胞数量较多、增殖能力较BMSCs更强,且对生物体的损伤也更小,近年来被广泛应用[6]。然而,相对于BMSCs,较弱的成骨能力限制了ADSCs在骨相关疾病中的治疗作用。羟基磷灰石[Ca10(PO4)6(OH)2](hydroxyapatite,HA)是人或动物骨骼和牙齿无机质的主要成分,在人体的骨骼中质量分数约为60%,而在牙齿中可高达95%以上[7]。人工合成的HA的组成和结晶结构均类似于人体自然骨骼,并且相态比较稳定、无毒性,不会引起炎症反应,具有良好的生物活性和生物相容性,适用于引导骨骼的生长[8],因此近年来成为了骨修复的良好材料之一[9]。本文通过研究HA对ADSCs成骨能力的影响,以拓展ADSCs在骨组织工程中的应用。
1 材料与方法
1.1 实验材料 6周龄C57BL/6雄鼠(北京维通利华实验动物技术有限公司),0.25%胰蛋白酶-EDTA消化液(含酚红)、Ⅰ型胶原蛋白酶、胎牛血清[赛默飞世尔科技(中国)有限公司],离心机(艾本德中国有限公司),水浴锅(天津欧诺仪器股份有限公司),40µm细胞筛(美国康宁公司),鼠源抗体(北京安必奇生物科技有限公司),光学倒置显微镜[尼康仪器(上海)有限公司],Nanodrop 2000、逆转录试剂盒[赛默飞世尔科技(中国)有限公司],恒温细胞培养箱[雅马拓科技贸易(上海)有限公司],酶标仪(上海Bio-Rad Laboratories有限公司),碱性磷酸酶检测试剂盒(上海碧云天生物技术有限公司),实时荧光定量逆转录PCR仪(上海睿铂赛生物科技有限公司),CCK-8试剂盒(北京智杰方远科技有限公司),羟基磷灰石粉末(上海阿拉丁生化科技股份有限公司)。
1.2 实验方法
1.2.1 ADSCs原代分离培养 选取6周龄无特定病原体(specific pathogen free,SPF)级的野生型C57BL/6雄鼠,麻醉后颈椎脱臼法处死,用体积分数75%的乙醇浸泡5 min。在无菌操作台中,使用剪刀和镊子剥离小鼠腋下、腹股沟皮下和附睾周围脂肪组织。将分离的脂肪组织放置在培养皿中,用含有青链霉素的PBS冲洗2~3次,洗去杂质,并快速剪碎脂肪团块。用0.2%的Ⅰ型胶原酶溶液于37℃恒温摇床200 r/min消化0.8~1 h,加入含0.2%胎牛血清的α-MEM细胞培养基终止消化反应。用孔径为40µm筛网滤去脂肪残块,细胞悬液收集至50 mL离心管中。1 500 r/min离心5 min,弃上清,用含15%胎牛血清的α-MEM细胞培养基重悬细胞沉淀,并将悬液移至10 cm培养皿中,在37℃、5%CO2的细胞培养箱中培养。
1.2.2 ADSCs的纯化及传代培养 脂肪细胞培养72 h后,吸去3 mL培养液,并加入3 mL新的培养液。培养96 h后吸去培养液,并用PBS洗2遍,再加入6 mL含有1%青链霉素混合液、15%胎牛血清的α-MEM培养基,以后每隔48 h更换1次培养液。待原代细胞密度长至90%左右,使用0.25%胰蛋白酶-EDTA消化细胞,按照1∶2的比例进行传代。
1.2.3 ADSCs的鉴定 (1)取培养至第二代的ADSCs,用0.25%胰蛋白酶-EDTA消化液37℃处理4 min,加入含0.2%胎牛血清的α-MEM细胞培养基终止消化,1 500 r/min离心5 min收集细胞。弃上清,将收集到的细胞用PBS重悬,再次1 500 r/min离心5 min收集细胞。重复以上操作1次。(2)再次将收集到的细胞沉淀用1 mL的PBS重悬,平均分配到5个1.5 mL无菌无酶的EP管中(200µL/管),1 500 r/min离心5 min,弃掉上清液,使用剩下的50µL PBS继续重悬细胞,分别将 5个 EP 管标记为:Blank、FITC-CD45、PE-CD44、PECD29、PE-Sca1,分别加入相应鼠源抗体1µL(抗体放置于冰箱内4℃保存)。(3)4℃避光孵育30 min,加入200µL PBS后,1 500 r/min离心5 min,弃掉上清,加入200µL 4%多聚甲醛(paraformaldehyde,PFA)重悬细胞并固定1 h,,固定完成后,1 500 r/min离心5 min,弃掉PFA,用PBS重新悬浮细胞,4℃冰箱保存,以待流式细胞仪测试。
1.2.4 HA细胞毒性检测 将ADSCs提前接种至96孔细胞培养板中(1×104个/孔),24 h后细胞完全贴壁,按浓度梯度(0、5、10、20、50、100、500 mg/L)加入配制好的HA悬浮液,37℃、5%CO2培养24 h后,每孔加入10µL CCK-8试剂,继续培养4 h后用酶标仪测定450 nm处的吸光度(A)值。
1.2.5 HA对ADSCs的成骨诱导作用 将分别含有0、5、10、20、50、100、500 mg/L的HA混合液以每孔500µL接种到24孔细胞培养板中,静置4 h后每孔接种6×104个ADSCs。置于37℃、5%CO2细胞培养箱中培养24 h后取出,观察细胞的贴壁情况。之后每48 h更换含5%胎牛血清的α-MEM细胞培养基,15 d后完成诱导过程,使用4%PFA固定30 min后,对细胞进行碱性磷酸酶染色,并观察染色结果。
1.2.6 实时荧光定量逆转录聚合酶链反应(qRT-PCR)检测HA对ADSCs成骨能力的影响 Trizol法提取HA成骨诱导15 d后ADSCs的总RNA,使用逆转录试剂盒将RNA逆转录为cDNA。qRT-PCR测定经HA诱导的ADSCs成骨相关基因骨钙素(BGLAP)、碱性磷酸酶(ALP)、Ⅰ型胶原(COL1A1)、骨桥蛋白(OPN)、Runt相关转录因子2(Runx2)mRNA表达量,引物序列见表1。反应条件:95℃5 min;95 ℃ 10 s,60℃ 30 s,40个循环。通过熔解曲线分析初步鉴定PCR反应的特异性。数据的收集由实时荧光定量逆转录PCR仪自带软件完成,采用2-ΔΔCt法进行数据分析,以0 mg/L的HA诱导组数据作为参照。
1.3 统计学方法 采用SPSS 17.0软件进行分析,所有数据以均数±标准差(±s)表示,组间数据比较用单因素方差分析,多重比较采用LSD-t检验法。P<0.05时为差异有统计学意义。
2 结果
2.1 ADSCs的生长情况 原代细胞培养至72 h,显微镜下观察到较多的脂肪滴及过滤沉淀杂质,见图1A。72 h后,细胞的数量开始增多,96 h时可见大部分细胞呈梭形或多边形,不规则贴壁生长,并有较多圆形细胞悬浮,见图1B。传代后细胞增殖的速度加快,细胞呈长梭形,细胞质有突起且丰富,细胞轮廓清晰,整体呈旋涡状排列,具有典型的ADSCs形态特点,见图1C、D。

Tab.1 Primer for qRT-PCR表1 qRT-PCR引物列表
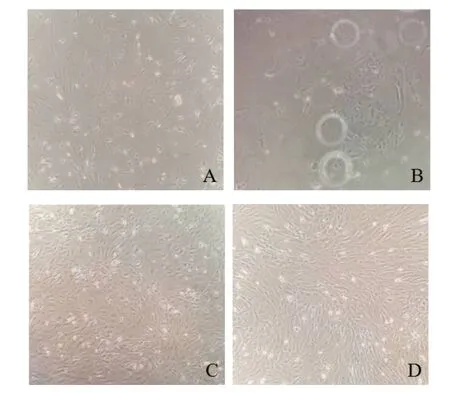
Fig.1 Isolation and culture of primary ADSCs(×100)图1 原代ADSCs的分离培养(×100)
2.2 ADSCs的鉴定 结果显示,造血干细胞表面标志物FITC-CD45(1.23%)阴性表达,间充质干细胞表面标志物PE-CD29(98.8%)、PE-CD44(81.4%)、PESca1(81.3%)阳性表达,见图2。
2.3 HA对ADSCs增殖的影响 加入CCK-8检测试剂4 h后,加入HA的培养基颜色变化如图3A~G,0、5、10、20 mg/L这4个梯度培养基的颜色变化差异较小,从50 mg/L开始颜色变淡,说明较高浓度的HA会抑制ADSCs的增殖。HA≤20 mg/L时,对细胞的生长无明显影响,见图3H。
2.4 HA诱导ADSCs成骨分化 经HA诱导15 d的ADSCs进行ALP染色,结果显示0 mg/L HA诱导组未出现蓝色,20 mg/L HA诱导组染色面积最大,证明有较好的诱导成骨分化作用,见图4。
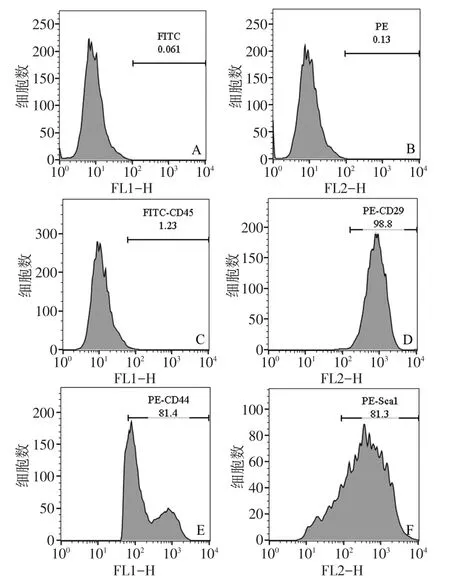
Fig.2 Flow cytometry detection of ADSCs图2 流式细胞仪检测ADSCs
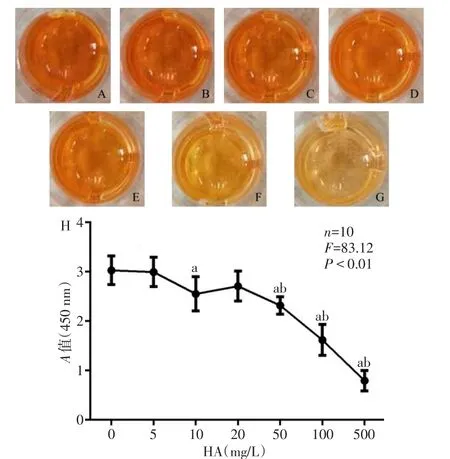
Fig.3 The effect of HA on the proliferation of ADSCs图3 HA对ADSCs增殖的影响
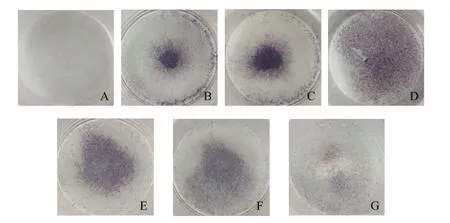
Fig.4 ALPsecretionofADSCsinducedbydifferentconcentrationsofHA图4 不同浓度HA诱导ADSCs后ALP的分泌量变化
2.5 qRT-PCR结果分析 通过对诱导ADSCs基因表达量检测,分析了不同浓度HA对ADSCs成骨相关基因表达的影响,见图5。与0 mg/L组相比,其余各组 ALP、COL1A1、OPN、Runx2表达均升高,在BGLAP中,与0 mg/L组相比,20 mg/L表达升高,100 mg/L表达降低,其余各组无差别。与20 mg/L组相比,5 mg/L、50 mg/L、100 mg/L组中BGLAP的表达量降低,COL1A1的表达量无差别。
3 讨论
目前,MSCs是临床应用范围最广、安全性最高的干细胞之一,其来源十分广泛,从骨髓、脂肪、牙髓、真皮、软骨膜、关节软骨、脐带、胎盘等众多组织中均可分离提取。ADSCs主要来源于脂肪组织,容易大量获取细胞,在近年来的研究中越来越受关注[10]。
3.1 ADSCs具有成骨分化的能力 ADSCs具有来源充足、免疫原性低[11]、体外容易培养、增殖能力较强的特点。有研究显示,经过多种诱导因子的加入,可以使ADSCs向成骨细胞诱导分化,以此来治疗骨损伤[12]。原代ADSCs多呈集落样贴壁生长,细胞形态呈长梭形或多边形[13]。ADSCs完成原代集落形成后即可稳定扩增。经过成骨诱导的ADSCs通常会表达ALP和COL1A1,随后在基质中出现钙沉积,进而形成钙结节。COL1A1的分泌是增殖期开始的标志,成骨细胞分化早期的标志是ALP的分泌,分泌量越高,说明其活性越高,向成骨细胞分化的能力越强[14]。
3.2 HA具有成骨诱导能力 目前,HA作为骨组织工程中的常用支架材料,可与多种MSCs和生物因子混合制作成种类繁多的骨修复材料[15-16],并且HA对成骨细胞有较强的黏附性,可以促进成骨细胞的增殖[17],以及细胞外基质的分泌,调节修复部位的微环境,促进胶原形成,进而促进骨折损伤后修复[18-19]。有研究表明,利用HA与COL1A1支架与BMSCs共培养21 d后,通过电镜扫描分析,发现支架上形成了大量的矿物沉积,部分细胞发生钙化,说明HA对BMSCs具有良好的成骨诱导能力[19]。
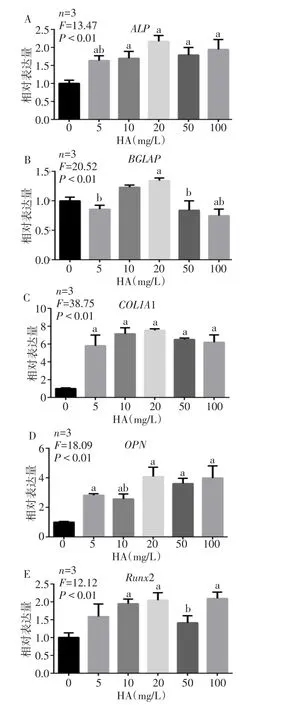
Fig.5 Osteogenic gene expression of ADSCs induced by hydroxyapatite图5 经HA诱导后的ADSCs成骨基因表达
3.3 HA对ADSCs具有成骨诱导作用 本文针对HA对ADSCs的成骨分化能力进行探究,选用了7个浓度梯度来观察不同量的HA对ADSCs的影响,结果表明,在≤20 mg/L时,HA对ADSCs的增殖影响较小。随后通过ALP染色,观察HA对ADSCs的诱导成骨分化作用,结果显示,经HA诱导的细胞均被染上蓝色,说明HA具有诱导ADSCs成骨分化的能力[20-21]。为了进一步验证成骨分化能力,qRT-PCR检测了成骨相关基因的表达情况,结果显示,20 mg/L的HA诱导ADSCs向成骨细胞分化的作用最明显,成骨相关基因的表达明显升高。BGLAP是骨组织的特异性蛋白,也是骨细胞分化成熟的标志。HA为20 mg/L时,BGLAP表达较高,结合所有基因的表达情况,证明HA可以诱导ADSCs向成骨细胞分化。
综上所述,HA具有诱导ADSCs向成骨细胞分化的能力,为两者混合制作成新的骨支架修复材料提供了理论基础。
