CaMKⅡδ慢病毒过表达载体构建及其对破骨细胞分化的影响
2018-07-26张艳波戚孟春董伟张广峰冯晓洁温黎明孙红
张艳波 戚孟春 董伟 张广峰 冯晓洁 温黎明 孙红
华北理工大学1口腔医学院口腔颌面外科教研室,2基础医学院病理教研室(河北唐山 063000)
破骨细胞是体内唯一骨吸收的细胞,与许多疾病的骨吸收有关[1⁃3]。活化T细胞核因子c1(nuclear factor of activated T cells cytoplasmic 1,Ca2+/Calmodulin/NFATc1)信号通路在破骨细胞分化中发挥着重要作用;而钙离子/钙调蛋白依赖性激酶(Ca2+/Calmodulin dependent kinases,CaMKs)是钙信号轴中传递钙信号的重要分子[4⁃6]。研究显示,CaMKII作为CaMKs家族中成员,其δ亚型(CaM⁃KIIδ)在破骨细胞分化过程中持续高表达[7⁃8],提示其可能发挥关键作用,但其作用及机制目前尚不清楚。本实验通过构建小鼠CaMKIIδ过表达慢病毒载体,探索其过表达对破骨细胞分化及骨吸收的影响,以进一步揭示CaMKIIδ在破骨细胞分化中的作用。
1 材料与方法
1.1 主要实验材料 RAW264.7细胞(小鼠单核巨噬细胞白血病细胞),购于中国科学院上海生命科学研究院细胞资源中心;小鼠核因子κB受体激活蛋白配体(receptor activatior of nuclear factor κB ligand,RANKL),美国Peprotech公司;DMEM高糖培养基、胎牛血清,以色列Biological industries公司;TRAP染色试剂盒,美国Sigma公司;CaMKIIδ抗体,美国Santa cruz公司;反转录试剂盒及PCR试剂盒,日本TAKARA公司;引物由上海生工公司合成。
1.2 破骨细胞分化中CaMKIIδ高转录本的筛选经GeneBank检索,小鼠CaMKIIδ共有7个转录本;为了确定过表达载体所采用的序列,针对上述7个转录本设计引物(表1),通过RT⁃PCR确定在破骨细胞分中高表达的转录本,用于过表达载体构建。
RAW264.7细胞以2×104个/cm2密度接种于60 mm培养皿中,24 h后加入50 ng/mL RANKL向破骨细胞诱导;于诱导第0、1、3、5 d收获细胞,Trizol提取总RNA,逆转录合成cDNA;PCR扩增;反应条件如下:95 ℃ 3 min;95 ℃ 30 s、56 ℃ 30 s、72℃ 1 min,30个循环;72℃ 10 min;扩增产物用2%琼脂糖凝胶电泳检测。

表1 CaMKIIδ基因7种转录本引物设计Tab.1 Primers of different transcription variants of CaMKIIδ used in RT⁃PCR
1.3 CaMKIIδ重组载体构建 针对实验1.2中筛选出的CaMKIIδ高表达转录本(转录本2),应用携带增强型绿色荧光蛋白(EGFP)的慢病毒进行过表达载体构建。在最佳MOI(multiplicity of infec⁃tion)=30[9]条件下应用空载体及重组载体分别转染RAW264.7细胞,72 h后用4 μg/mL嘌呤霉素筛选稳定转染细胞株,共处理4 d。
1.4 重组CaMKIIδ在细胞中的表达检测 RAW 264.7细胞分为三组:对照组、空载体组、CaMKIIδ过表达组。对照组细胞不转染;后两组分别为转染空载体及重组载体的第三代稳定转染细胞株;细胞培养3 d后进行检测。
Real⁃time PCR 检测:Trizol提取细胞总RNA,逆转录合成cDNA;在QuantStudioTM6 Flex实时荧光定量PCR仪上检测;反应条件:95℃3 min;95℃15 s、56 ℃ 20 s、72 ℃ 30 s,共40个循环。所用引物为:CaMKIIδ转录本 2,上游 5′⁃CAGTGGTGAGAA⁃GATGTATG⁃3′,下游5′⁃TTCAAGAGACGGCAGATT⁃3′,产物130 bp;β⁃actin,上游5′⁃GACGTTGACATC⁃CGTAAA⁃3′,下游 5′⁃AGCAGTAATCTCCTTCTG⁃3⁃,产物102 bp。
Western blot检测:提取细胞总蛋白,测定蛋白浓度;5×蛋白上样缓冲液稀释,煮沸、变性、转膜;5%脱脂牛奶封闭1 h;兔抗鼠一抗4℃过夜,羊抗兔二抗37 ℃ 0.5 h,ECL(Enhanced chemiluminescence)显色1 min。经Image⁃pro plus 6.0软件分析蛋白条带积分光密度值(IOD);以β⁃actin为内参。目的蛋白条带IOD值与β⁃actin条带IOD值的比值代表目的蛋白相对水平;实验重复3次。
1.5 CaMKIIδ过表达对破骨细胞分化及功能的影响 实验分组同实验1.4。细胞接种同实验1.2,采用100 ng/mL RANKL进行诱导分化。TRAP染色:诱导5 d后,收获细胞并按照试剂盒说明书进行TRAP染色,200倍显微镜下观察。每张细胞爬片随机取6个视野,计算TRAP+且胞核≥3个的细胞数目,取其平均值;每组测量5个细胞爬片[10]。吸收陷窝检测:制备0.2 mm厚牙本质磨片并接种细胞;诱导14 d后收获细胞,500倍下扫描电镜(SEM)选取6个视野,检测每个视野吸收陷窝数目及面积,取平均值;每组检测5个质磨片[10]。
1.6 统计学方法 定量数据用均数±标准差表示。使用SPSS 17.0软件对各组参数进行单因素方差分析;P<0.05为差异具有统计学意义。
2 结果
2.1 CaMKIIδ高表达转录本筛选 破骨细胞分化不同时间点CaMKIIδ各转录本PCR产物电泳条带见图1。条带1、9、13分别代表转录本1、5、7,有微弱条带出现,提示这3个转录本表达较弱;条带7、11分别代表转录本4、6,无条带出现,提示无表达;条带3、5分别代表转录本2、3,条带较亮,提示高表达。由于转录本2引物还能扩增转录本6,转录本3的引物还能扩增转录本2和6(表1),其中转录本6不表达,提示条带3中均是转录本2,而条带5中除转录本3外还含有转录本2,即在破骨细胞分化中只有转录本2、3高表达。
2.2 CaMKIIδ过表达载体构建 应用携带绿色荧光蛋白的慢病毒过表达载体和空载体分别转染RAW264.7细胞,经嘌呤霉素筛选,可见几乎全部细胞都带有绿色荧光标记(图2),建立了稳定转染细胞株。
2.3 重组CaMKIIδ在细胞中的表达 Real⁃time PCR检测:过表达组CaMKIIδ mRNA水平为2.176±0.266,显著高于对照组的0.955±0.199和空载体组的1.172±0.118(P<0.05),分别升高了107.8%和85.7%;提示重组CaMKIIδ mRNA在RAW264.7细胞中得到了有效表达。
Western⁃blot检测见图3:过表达组CaMKIIδ蛋白条带IOD比值为0.958±0.087,显著高于对照组的0.698±0.017(P<0.05)和空载体组的0.699±0.077(P<0.05),分别上升了37.2%和37.1%;而空载体组与对照组比较差异无显著性(P>0.05);提示重组CaMKIIδ蛋白在RAW264.7细胞中得到了有效表达。
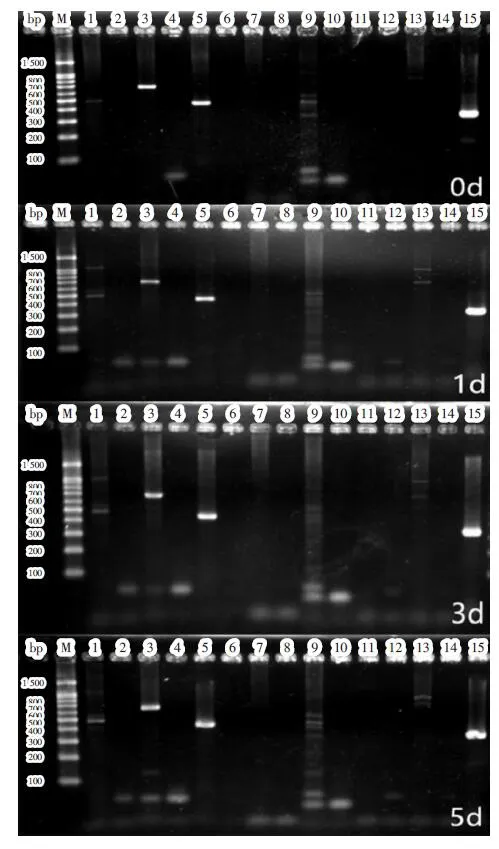
图1 破骨细胞分化第0、1、3、5 d CaMKIIδ各转录本表达情况Fig.1 Detection of different transcript variants of CaMKIIδ at day 0,1,3,5 during osteoclast differentiation

图2 慢病毒稳定转染株筛选(荧光倒置显微镜,×200)Fig.2 Screening of RAW264.7 cells stably infected by lentivirus(fluorescent inverted microscope,× 200)
2.4 CaMKIIδ过表达对破骨细胞分化及功能的影响 TRAP染色显示三组经诱导后均出现TRAP+多核细胞(图4);其中过表达组破骨细胞数目为(22.8±5.1)个,与对照组的(23.8±4.3)个和空载体组的(21.2±2.5)个比较差异无统计学意义(P>0.05)。扫描电镜(SEM)可见(图4),三组细胞在牙本质磨片上均有吸收陷窝形成;过表达组吸收陷窝数、吸收陷窝面积分别为(2.4±0.9)个和(1 262.720± 477.855)μm2,与对照组[(2.4± 0.5)个和(1 165.200± 572.415)μm2]和空载体组[(2.8±0.8)个和(1 143.760 ± 392.864)μm2]比较差异无统计学意义(P>0.05)。上述结果提示,CaMKIIδ过表达对破骨细胞分化及骨吸收功能无显著影响。
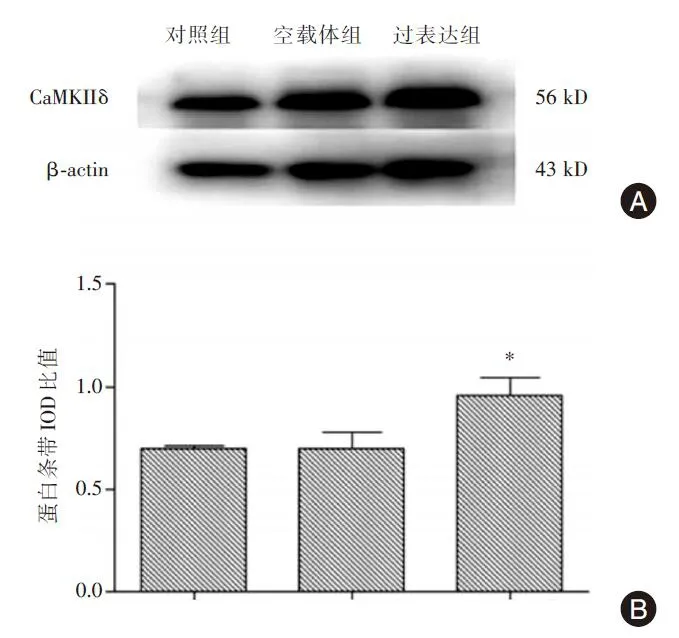
图3 Western⁃blot检测三组细胞CaMKIIδ蛋白水平Fig.3 Detection of CaMKIIδ protein level among three groups by western⁃blot
3 讨论
破骨细胞分化或活性增强会引起过度骨吸收,从而导致骨质疏松症、关节炎、牙周炎和骨肿瘤等疾病的发生[1⁃3];因而破骨细胞分化调控研究对上述疾病治疗有重要意义。
Ca2+/Calmodulin/NFATc1信号轴对破骨细胞分化至关重要;在该信号轴中,CaMKs是传递钙信号的重要分子。研究发现,CaMKII和CaMKIV在破骨细胞分化中发挥主要作用[4⁃5,11⁃13]。CaMKIV 可以通过CREB信号调控破骨细胞分化[13];而PARK⁃MIN[14]及 WILLIAM 等[15]研究发现,RANKL 刺激可使破骨细胞分化中CaMKII磷酸化,显著提高其蛋白活性;但CaMKII发挥的作用目前还远未弄清。
CaMKII有α、β、γ、δ四个异构体;国外学者及我们前期研究发现,CaMKIIδ在破骨细胞分化中表达最高,且随时间表达逐步增强[7⁃8],提示其作用可能极为关键。CHANG等[11]研究显示,CaMKIIδ基因敲除及抑制剂KN93处理,均可使TRAP+破骨细胞前体百分比显著下降,并破骨细胞前体逆转成TRAP阴性细胞;本团队研究发现,CaMKIIδ RNA干扰不仅抑制多核破骨细胞生成,而且显著下调破骨细胞分化相关因子NFATc1、TRAP、非受体酪氨酸激酶(c⁃Src)的基因表达[9];因而推断CaMKIIδ在破骨细胞分化信号调控中发挥着重要作用。
小鼠CaMKIIδ由于mRNA不同剪切,共有7个转录本。在破骨细胞分化调控中,是否这些转录本均参与其中呢?为了解决这个问题,本研究通过设计特异性引物,对破骨细胞分化过程中CaM⁃KIIδ 7个转录本的表达情况进行检测。结果发现,只有转录本2和3高表达,转录本1、5、7表达较弱,而录本4、6则无表达。上述结果提示,CaMKIIδ转录本2和3可能在破骨细胞分化调控中发挥着关键作用。上述发现国内外尚无文献报道。
为了进一步证实CaMKIIδ在破骨细胞分化中的作用,本研究筛选并构建了CaMKIIδ转录本2的基因重组载体,以探讨其过表达是否会促进破骨细胞分化。结果发现,重组CaMKIIδ在破骨细胞中得到有效表达,说明重组载体构建是成功的;然而,在RANKL诱导的破骨细胞分化中,过表达组中破骨细胞数目、牙本质吸收陷窝数与吸收陷窝面积与对照组和空载体组并无明显差异,说明CaMKIIδ过表达对破骨细胞生成和功能无明显影响。
上述结果似乎与CHANG等[11]及我们前期研究[9]结论相矛盾;分析原因,这可能与破骨细胞分化中所需CaMKII信号水平有关。破骨细胞分化离不开 CaMKIIδ 的信号刺激[7,9,11],因而 CaMKIIδ随着破骨细胞分化而逐渐表达增强[7-8];但细胞分化所需CaMKIIδ的量可能是一定的,过多的超出生理水平的CaMKIIδ并不能促进破骨细胞分化;或者破骨细胞内存在负反馈信号系统,过高水平的CaMKIIδ被其他信号分子的作用所抵消。然而,上述解释是否正确?哪些负反馈系统可能参与CaMKIIδ的负反馈?有待于进一步研究证实。
