葡糖转运蛋白1和葡糖转运蛋白2在槲皮苷和异槲皮苷跨膜吸收中的作用
2018-07-26李素云高薇娜李敬来张振清郭长江
李素云,李 峥,高薇娜,李敬来,张振清,郭长江
(1.首都医科大学附属北京世纪坛医院临床营养科,北京 100038;2.军事科学院军事医学研究院环境医学和作业医学研究所,天津 300050;3.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
日常膳食和中草药中含有的大量植物化合物如黄酮类等,具有抗氧化、抗炎、抗肿瘤和保护心血管等生物学作用。正常情况下,每人每天摄取的总黄酮为0.1~1.0 g,其中相当一部分是槲皮素及其糖苷衍生物[1],如槲皮苷(quercitrin,Que)(槲皮素-3-L-鼠李糖苷)和异槲皮苷(isoquercitrin,IQue)(槲皮素-3-L-葡萄糖苷)等。糖苷衍生物是槲皮素在自然界中的主要存在形式。
早期研究认为,由于槲皮素糖苷的亲水性,类黄酮物质进入体内后很少被吸收,吸收速度慢和生物利用率低是其主要特点[2]。近年来研究表明,肠道可以吸收类黄酮物质[3],且槲皮素糖苷的吸收与糖基的替代位置及种类有关[4]。葡糖转运蛋白1(glucose transporter 1,GLUT1)作为葡萄糖的主动转运蛋白,介导槲皮素肠道吸收的入胞过程[5-7],但对于GLUT1是否直接参与槲皮素糖苷的吸收转运报道较少,结论也不一致[8-9]。同时,对于GLUT2是否参与槲皮素糖苷的肠道吸收,目前尚无报道。为明确阐述GLUT1和GLUT2在槲皮素糖苷吸收过程中的作用,本研究比较了GLUT1和GLUT2的特效抑制剂根皮苷(phloridzin,PHL)和根皮素(phloretin,Pt)对Que和IQue在单层Caco-2细胞模型上跨膜转运的影响,以期在细胞和分子水平上,为进一步揭示槲皮素糖苷在肠道吸收过程中的吸收机制奠定实验基础。
1 材料与方法
1.1 细胞、主要试剂和仪器
Caco-2细胞购自美国模式培养物集存库,传代数为40~50代。槲皮素、Que、IQue、柽柳黄素(tamarixetin)、异鼠李亭(isorhamnetin)、L-谷氨酰胺和胰蛋白酶,美国Sigm a公司;甲醇(色谱纯),美国Fisher公司;DMEM培养基,美国Gibco公司;胎牛血清和非必需氨基酸,美国Hyclone公司;丁螺环酮(buspirone,内标,批号 0803021,纯度 99.9%),北京华素制药股份有限公司提供;其他试剂均为分析纯。Millicell12孔板,美国Millipore公司;高效液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)(Agilent 1100 LC/MS DVL,DE),美国Agilent公司。
1.2 细胞培养
Caco-2细胞用DMEM培养基(含10%胎牛血清,1%非必需氨基酸,1%L-谷氨酰胺和青霉素-链霉素双抗液)培养,孵育条件为37℃,5%CO2。
1.3 跨膜转运实验[11]
1.3.1 腔侧到基底侧的跨膜转运
实验前,将接种有细胞的12孔Millicell板以37℃ PBS(pH 7.2)浸泡15 m in,轻微冲洗Millicell板,除去细胞表面附着物。在腔侧加入含Que或IQue的PBS 600 μL(终浓度9.0和18.0 mg·L-1),基底侧加入PBS(pH7.2)1200 μL,每浓度设3复孔,置37℃,5%CO2条件下孵育,分别于30,60,90,120和150 m in于基底侧取样50μL,并补充等体积PBS。空白对照组腔侧和基底侧均只加PBS,其他操作相同。取出的样品精确加入等体积内标丁螺环酮溶液(流动相配制)后充分混匀,进样20μL,应用LC-MS测定Que或IQue及其代谢产物槲皮素、异鼠李亭和柽柳黄素含量。
1.3.2 基底侧到腔侧的跨膜转运
实验前,将接种有细胞的12孔Millicell板以37℃ PBS(pH 7.2)浸泡15 m in,轻微冲洗M illice ll板,除去细胞表面附着物。将含Que或IQue 9.0和18.0m g·L-1的PBS 1200 μL加入基底侧,腔侧加入PBS 600 μL,每浓度设3复孔,置37℃,5%CO2条件下孵育,分别于30,60,90,120和150 m in于腔侧取样50μL,其他操作同1.3.1。
1.3.3 跨膜转运抑制实验
实验前,将接种有细胞的12孔Millicell板以37℃ PBS(pH7.2)浸泡15 m in,轻微冲洗M illice ll板,除去细胞表面附着物。分别设Que,Que+PHL和Que+Pt组及IQue,IQue+PHL和IQue+Pt组。先于腔侧分别加入含Pt或PHL 2.0 mmol·L-1的PBS 300μL。另设空白对照组,两侧均只加等体积PBS。孵育15 m in后,再于腔侧加入含Que或IQue18.0 mg·L-1的PBS 300 μL,轻微吹打使混合均匀,终浓度为9.0 mg·L-1。每浓度设3复孔,置37℃,5%CO2条件下孵育,分别于30,60,90,120和150 m in于基底侧取样50μL,并补充等体积PBS。取出的样品精确加入等体积内标丁螺环酮溶液后充分混匀,同1.3.1测定。转运抑制率(%)=(Q0-Q1)/Q0×100%,Q0为某一时间点Que或IQue组的透过量,Q1为同一时间点加PHL或Pt抑制剂组的透过量。
1.4 HPLC-MS 检测[12]
液相条件如下:色谱柱为Agient-C18柱,2.1mm×100mm,3.5μm,柱温为室温,流动相A为水(含0.1%甲酸);流动相B为甲醇+乙腈(含0.1%甲酸),A∶B=65∶35(Que)或A∶B=50∶50(IQue)(V/V)。流速:0.2m L·m in-1;进样量:20 μL。
质谱条件:采用电喷雾离子源,雾化气压30 psi,干燥气流速8 L·m in-1,干燥气温度35℃,毛细管压3000 V,四极杆温度保持在99℃,增益为1,峰宽为0.10 m in,选择正离子模式,采用选择离子监测(SIM)测定以提高灵敏度。
应用流动注射方式(FIA)、以全扫描模式优化各化合物的碰撞电压值及分子离子峰的质荷比(m/z)。槲皮素、Que、IQue、异鼠李亭和柽柳黄素的m/z分别为303,449,465,317和317,内标丁螺环酮m/z为386.2。
1.5 统计学分析
实验结果数据用x±s表示。采用重复测量设计资料的方差分析和t检验,统计软件为SPSS21.0。P<0.05为差异具有统计学意义。
2 结果
2.1 槲皮苷和异槲皮苷双向转运过程中透过量的动态变化
图1和图2结果表明,在跨膜转运过程中Que和IQue具有相同的动态特征。①在腔侧→基底侧和基底侧→腔侧跨膜转运中,Que和IQue 9.0和18.0 mg·L-1孵育30~150 m in,均在对侧检测到其原形;②Que和IQue18.0 mg·L-1组,其透过量均高于9.0 mg·L-1组(P<0.01);③ 随孵育时间延长,Que和IQue 9.0和18.0 m g·L-1孵育30~150 m in内,每一时间点与前一时间点比较,其透过量均增加(P<0.01),其透过量与孵育时间呈正相关,150m in内未观察到平台期。
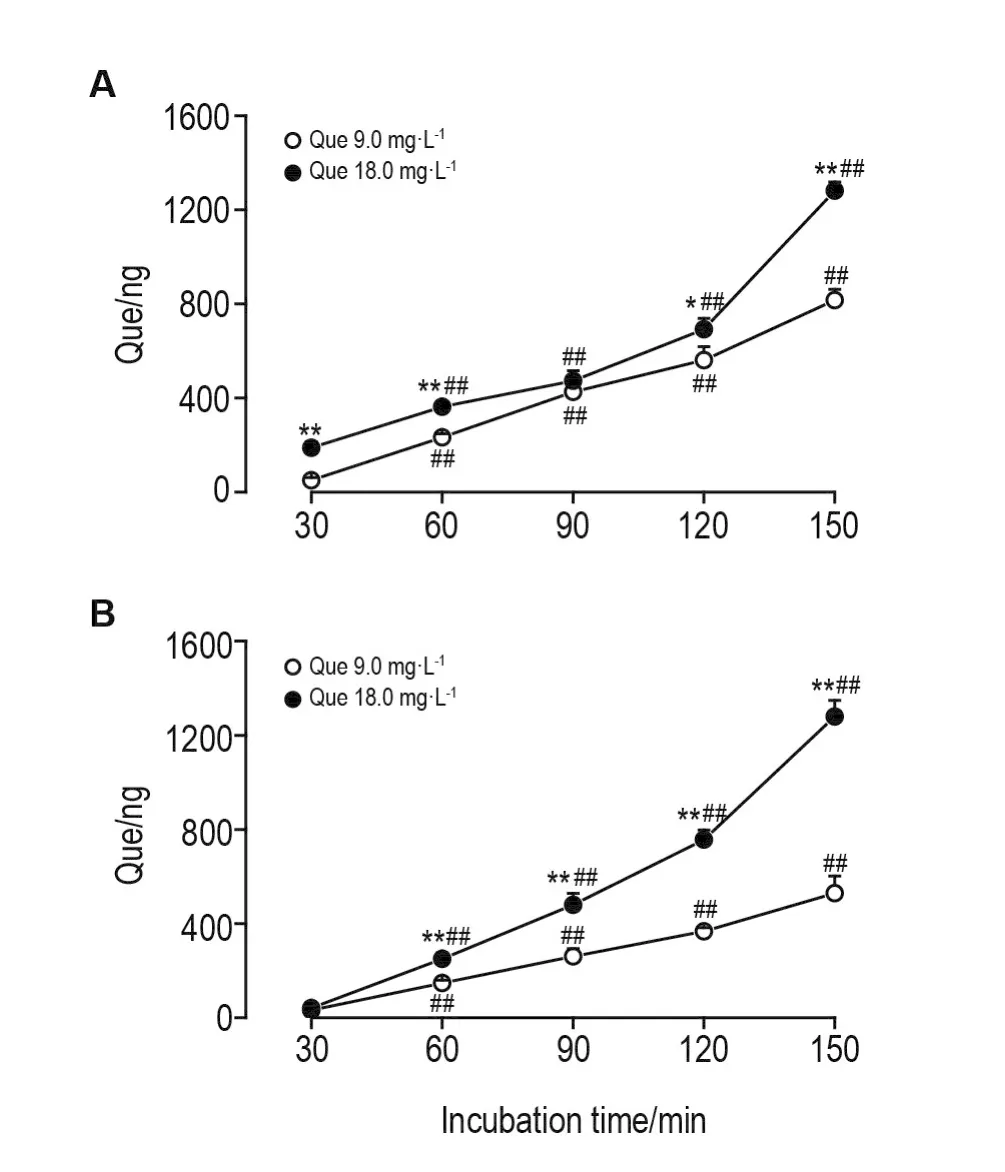
Fig.1 Dynam ic changes of quercitrin(Que)am ounts transported to opposite du ring Que bi-d irec tional transport.A:apica l side →basolateral side,Que was loaded in apical side;B:basolateral side →apical side,Que was loaded in basolateral side.The am ount of Que transported to the oposite was mearsured with LC-MS.,n=3.*P<0.05,**P<0.01,compared with 9.0 m g·L-1 group at the sam e tim e;#P<0.05,##P<0.01,com pared with the previous tim e of the sam e concentration group.
2.2 槲皮苷和异槲皮苷双向转运过程中不同方向之间透过量的比较
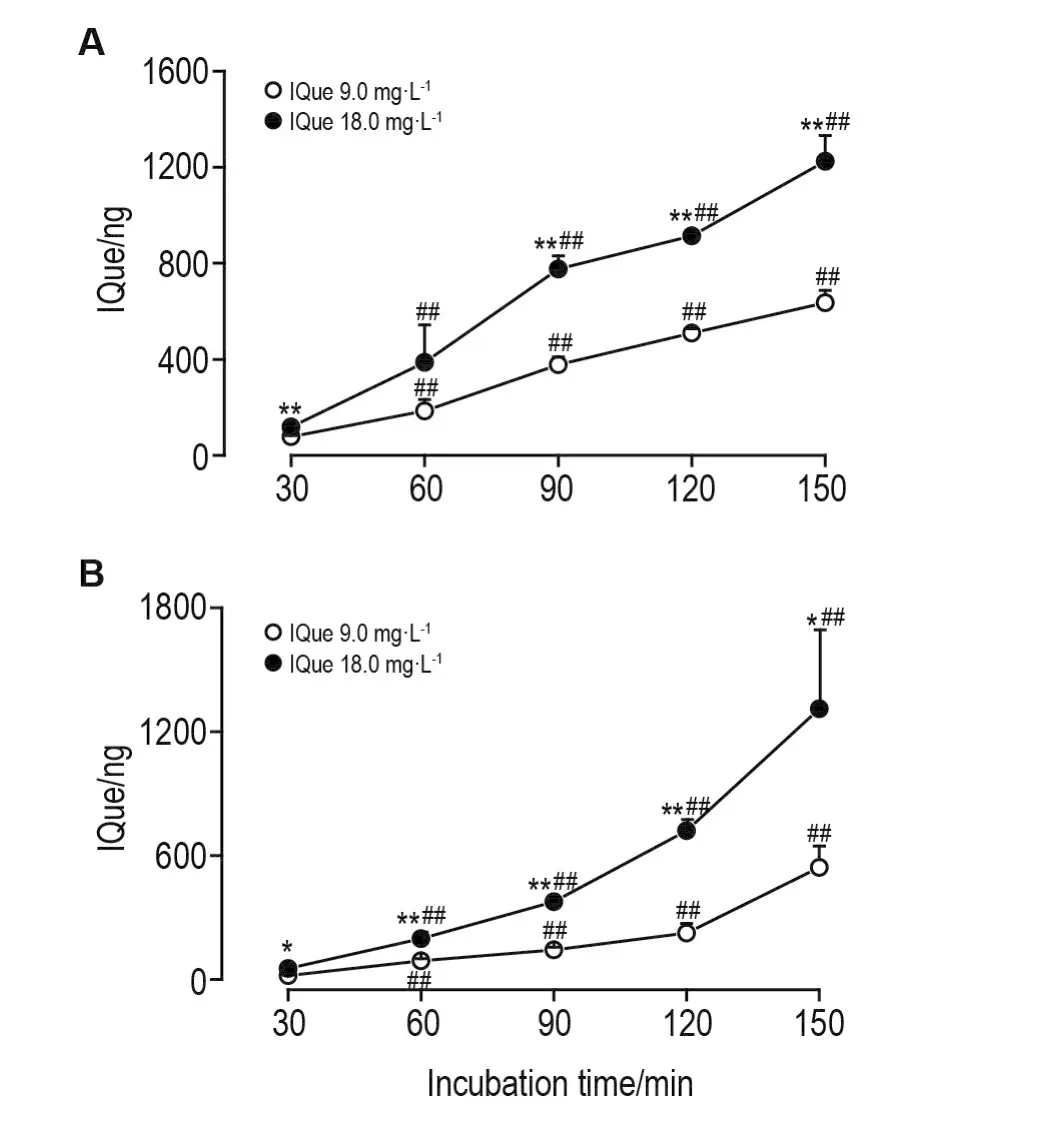
Fig.2 Dynam ic changes of isoquercitrin(lQue)am ounts transpo rted to oposite du ring lQue bi-direc tional transpo rt.See Fig.1 for the treatm ent.A:apica lside→baso lateral side;B:basolateralside →apical side.,n=3.*P<0.05,**P<0.01, com pared with 9.0 mg · L-1 group at the same time;#P<0.05,##P<0.01,compared with the p revious tim e in the sam e concentration group.
由图3所示,双向跨膜转运中不同方向之间比较,Que 9.0和18.0mg·L-1组腔侧→基底侧的透过量均显著高于同一剂量下基底侧→腔侧(P<0.01,P<0.05)。不同方向同一时间点之间比较,Que 9.0mg·L-1组在孵育60~150m in时,腔侧→基底侧的透过量均显著高于基底侧→腔侧,随孵育时间延长,双向之间差异逐渐增强(P<0.01);Que 18.0mg·L-1组在孵育30和60 m in时,腔侧→基底侧的透过量均显著高于基底侧→腔侧(P<0.01,P<0.05),90 m in以后无显著性差异。
由图4所示,在IQue的双向跨膜转运中,不同方向之间比较,在30~150 m in孵育时间内,IQue 9.0和18.0mg·L-1均表现出腔侧→基底侧透过量显著高于基底侧→腔侧(P<0.01)。不同方向同一时间点之间两两比较,IQue 9.0和18.0mg·L-1组在孵育120m in内均表现为腔侧→基底侧透过量显著高于基底侧→腔侧(P<0.01),但在150 m in时,IQue 9和18.0mg·L-1组的双向透过量无显著性差异。
2.3 槲皮苷和异槲皮苷在单层Caco-2细胞模型上双向转运过程中的代谢产物

Fig.3 Com parison of transport am ounts of Que during bi-d irec tional transpo rt.See Fig.1 for the treatment.A:Que 9.0 m g·L-1;B:Que 18.0 m g·L-1.,n=3.*P<0.05,**P<0.01,compared with basolateralside→apicalside at the same time.

Fig.4 Com parison of transport am ounts of lQue during bi-d irec tional transpo rt.See Fig.1 for the treatment.A:IQue 9.0 mg·L-1;B:IQue 18.0 mg·L-1.,n=3.*P<0.05,**P<0.01,compared with basolateralside→apicalside at the same time.
用HPLC-MS法检测了Que和IQue在单层Caco-2细胞模型上双向转运过程中的代谢产物。Que 18.0 mg·L-1从基底侧→腔侧转运过程中,孵育90m in后,在腔侧可检测到微量的甲基代谢产物异鼠李亭和柽柳黄素,但均低于定量的检测限(2μg·L-1)(图5)。Que 9.0mg·L-1组及其他时间点均未检测到异鼠李亭和柽柳黄素。另外,Que 9.0和18.0mg·L-1双向转运,孵育120和150 m in时,均在对侧检测到微量槲皮素,但低于定量检测限(图略)。

Fig.5 Quantitative identification Que and its metabolites by HPLC-MS m ethod in the p rocess of transpo rt across Caco-2 cellm ono layer from apical side to basolateral side.A:HPLC-MS standard chromatograms of quercetin,isorham netin,tamarixetin and Que;B:HPLC-MS chromatograms of solution in baso lateral side during transm em brane transport of Que 18.0mg·L-1 for 150m in from apicalside to basolateralside.
IQue 18.0 mg·L-1从腔侧→基底侧转运过程中,孵育150m in时,在基底侧亦检测到微量异鼠李亭和柽柳黄素(<2 μg·L-1)(图6);在基底侧→腔侧转运过程中,在腔侧同样检测到微量异鼠李亭和柽柳黄素(<2 μg·L-1)。IQue 9.0mg·L-1组及其他时间点均未检测到异鼠李亭和柽柳黄素。另外,IQue 9.0和18.0 mg·L-1双向转运,孵育120和150 m in时,均在对侧检测到微量槲皮素,但低于定量检测限(图略)。该结果与Que检测结果一致。
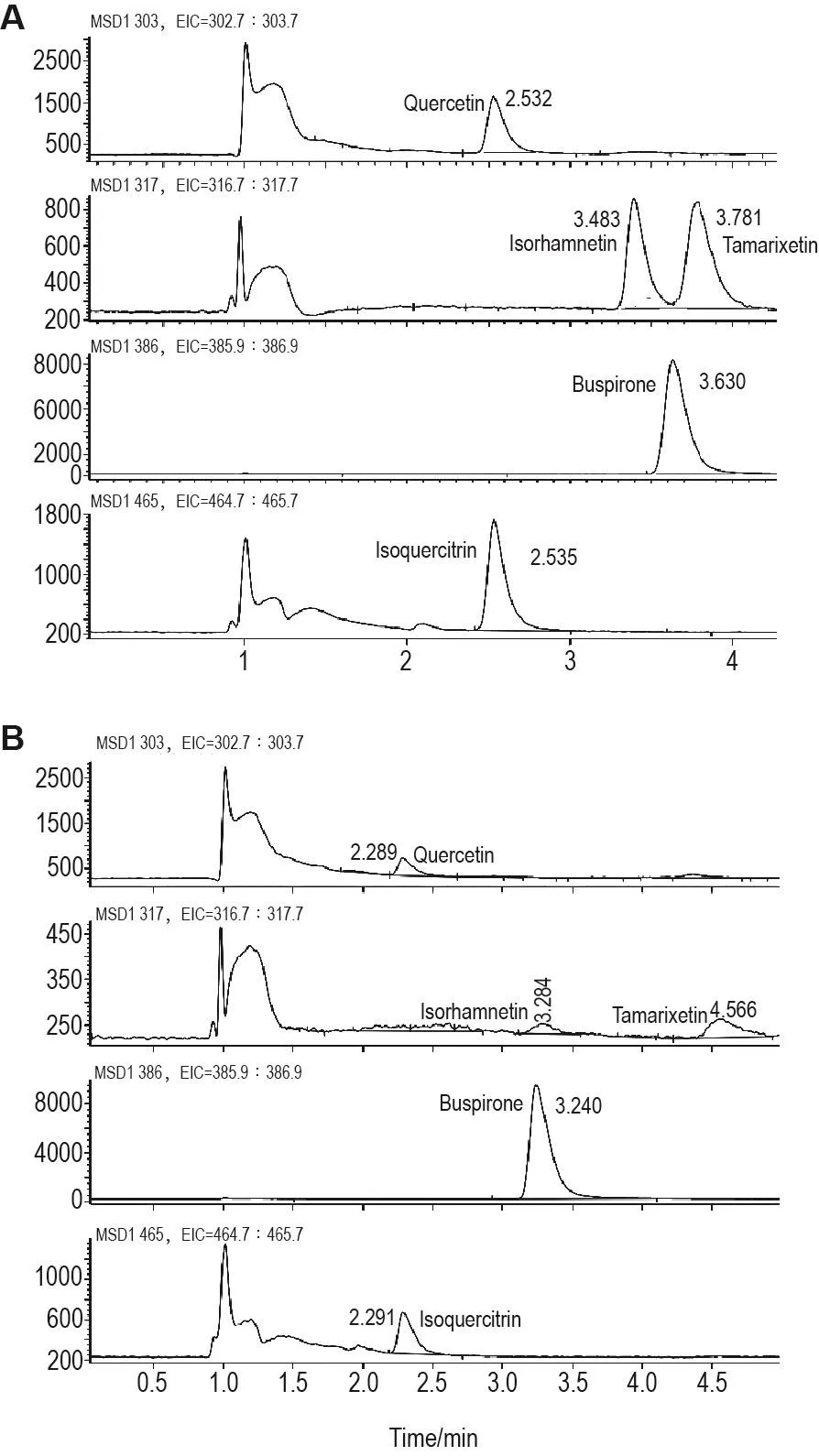
Fig.6 Quantitative iden tification lQue and its m etabolites by HPLC-MSm ethod in the p rocess of transpo rt ac ross Caco-2 cell m ono layer from ap ical side to baso lateral side.A:HPLC-MS standard chrom atogram s of quercetin,isorhamnetin,tamarixetin and IQue;B:HPLC-MS chrom atogram s of so lution in basolateral side during transm embrane transport of IQue 18.0 m g·L-1 for 150 m in from apica lside to basolatera lside.
2.4 根皮苷和根皮素对槲皮苷和异槲皮苷从腔侧到基底侧跨膜转运的抑制作用
由图7A可见,Que 9.0mg·L-1从腔侧→基底侧转运,在30~150 m in内,与Que组比较,Que+PHL和Que+Pt组Que的透过量均显著下降(P<0.01),Que从腔侧→基底侧转运被明显抑制;Que+Pt组Que的透过量与Que+PHL组比较下降更为明显(P<0.01),表明Pt对Que跨膜转运的抑制作用强于PHL。
由图7B可见,IQue 9.0 mg·L-1从腔侧→基底侧转运,在30~90 m in内,与IQue组比较,IQue+PHL和IQue+Pt组IQue的透过量均显著下降(P<0.01),IQue从腔侧→基底侧转运被明显抑制;IQue+PHL组IQue的透过量与IQue+Pt组比较下降更为明显(P<0.01),表明PHL对IQue跨膜转运的抑制作用强于Pt。在120 m in时,IQue,IQue+PHL和IQue+Pt组IQue的透过量无统计学差异;在150 m in时,IQue+PHL组IQue的透过量与IQue组更为相近(P<0.05),Que+Pt组IQue的透过量反而与IQue组比较明显增加(P<0.01)。表明随孵育时间延长,PHL和Pt对IQue转运的抑制作用逐渐减小,在150m in时Pt对IQue跨膜转运反而有一定的促进作用。
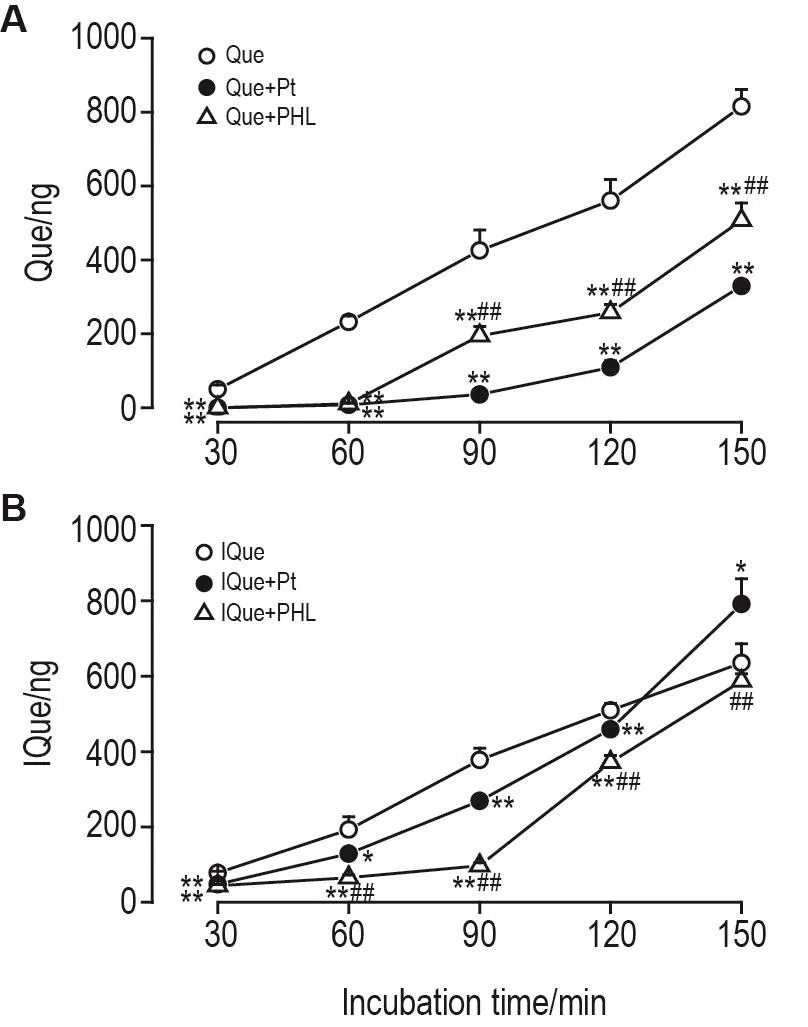
Fig.7 lnhibito ry effec ts of ph lo ridzin(PHL)and ph lo retin(Pt)on transm em b rane transpo rt of Que(A)and lQue(B)from ap ical side to baso lateral side.Three hundred m icroliters of PBS with 2.0 mmol·L-1 Pt or PHL were added to apical side.After 15 m in,300 μL PBS with Que or IQue 18.0 m g·L-1 was added in the inhibitor groups,m eanwhile an equa l vo lum e of PBS without Que or IQue was added used as the blank control,then blown lightly to m ix well and incubated for 30,60,90,120 and 150 m in respectively at 37℃ .The am ount of Que or IQue transported to the opposite side was m earsured with LC-MS.x±s,n=3.*P<0.05,**P<0.01,compared with Que or IQue group at the sam e tim e;#P<0.05,##P<0.01,com pared with Que+Ptor IQue+Ptgroup at the same time.
分别以Que和IQue组为对照,计算PHL和Pt对Que和IQue从腔侧→基底侧转运的抑制率见表1。由表1可见,PHL和Pt对Que转运的抑制率明显高于对IQue的抑制率(P<0.01)。
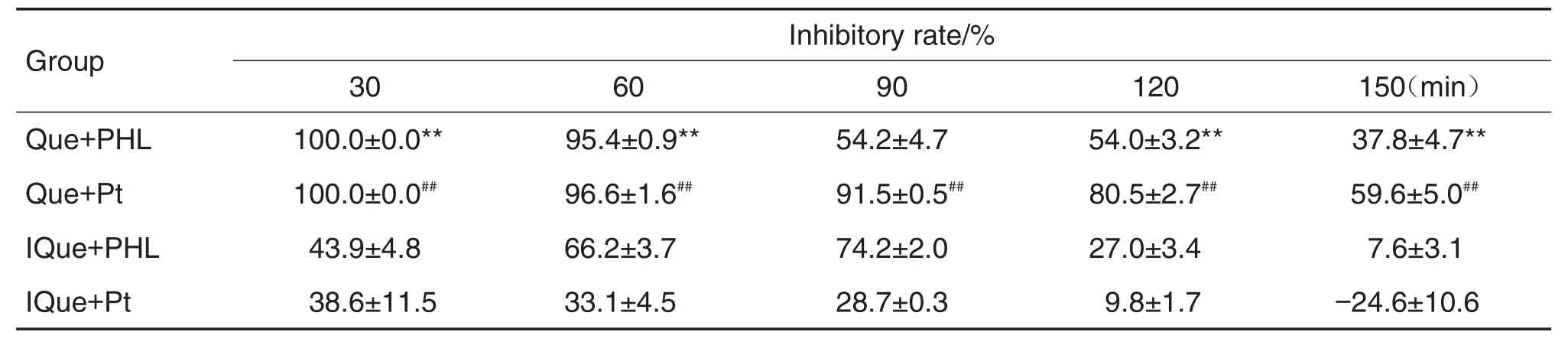
Tab.1lnhibitoryrateofPHLandPtontransmembranetransportofQueandlQuefromapicalsidetobasolateralside
3 讨论
槲皮素糖苷在小肠的吸收一直存在争议[4,10,13-14]。由于槲皮素糖苷的亲水性特点,既往一些研究认为,类黄酮物质进入体内后很少被直接吸收,需经盲肠和结肠微生物酵解后才能吸收利用,吸收速度慢及生物利用率低是其主要特点[2]。
近年来一些研究表明,肠道可以吸收一定量的类黄酮物质[3]。Sesink等[4]研究认为,槲皮素糖苷在肠道的吸收与其结合的配糖体有关,葡萄糖配基有利于槲皮素糖苷的肠道吸收,并认为IQue的吸收首先需要在肠腔侧水解释出槲皮素[4,13-14]。有关Que的肠道吸收报道较少,且大多倾向于认为不存在Que的小肠吸收[15]。作者曾经采用悬浮Caco-2细胞观察Que的胞内摄取。结果表明,Que不仅可以完整的分子形式被Caco-2细胞摄取,并在细胞内发生脱糖基和甲基化代谢反应,且甲基化代谢产物的胞内蓄积呈现随孵育时间先升后降的特征,推测这可能与槲皮素苷元的进一步代谢有关,且相关代谢酶的表达可能受胞内糖苷和(或)代谢产物的调节[14]。
本研究结果表明,Que和IQue在单层Caco-2细胞模型上,不仅可以完整的分子形式被Caco-2细胞摄取,且能够被完整地分泌到基底侧;同时Que和IQue18.0mg·L-1分别于孵育90min后和150min时检测到微量槲皮素甲基化代谢产物异鼠李亭、柽柳黄素和槲皮素,但均未达定量检测限。提示Que和IQue在跨膜转运过程中存在广泛的代谢转化,且代谢转化不仅存在于Caco-2细胞内,在基底侧也存在相似的代谢转化过程[16]。同时表明,不同的槲皮素糖苷在肠道跨膜吸收过程中,可能存在共同的吸收和代谢机制,即脱糖基释放槲皮素苷元及槲皮素苷元的进一步代谢,糖配基的不同不会影响其吸收代谢途径。而双向转运透过量的差异则表明,两者在肠道的跨膜转运过程可能存在主动转运载体的参与[5-7,17],同时不能排除外向型转运蛋白的外排作用[18-19],其具体机制需要进一步研究。
GLUT1和GLUT2是葡萄糖肠道吸收的2个主要转运蛋白[9,20]。GLUT1 是葡萄糖的主动转运蛋白,可以逆浓度梯度将肠腔内的葡萄糖转运入细胞中,需要Na+/K+-ATP酶的参与。而GLUT2则主要介导了葡萄糖的易化扩散过程,正常情况下,主要存在于小肠上皮细胞基底侧,负责将进入肠上皮细胞内的葡萄糖转运入循环中。肠腔内较高的葡萄糖浓度等因素可以诱导基底侧的GLUT2快速转移、短暂性插入小肠上皮细胞腔侧,是肠内葡萄糖浓度升高时的主要转运机制,承担了>75%葡萄糖的转运[9]。
近年来大量研究认为,GLUT1介导了Que和IQue 的入胞过程[5-7,21],而 Morand 等[15]则认为,GLUT1是IQue的转运蛋白,但Que本身通过易化扩散途径进入细胞。但是,对于GLUT2是否也参与了IQue的吸收转运,研究认为,Que及其糖苷均不是GLUT2的底物[8-9,22-23],而对于Que的肠道吸收载体,目前尚无报道。为此,本研究通过观察GLUT1和GLUT2的特异性抑制剂PHL和Pt对Que和IQue在Caco-2细胞单层模型上跨膜转运的影响,进一步探讨了GLUT1和GLUT2在Que和IQue肠道吸收过程中作用。结果表明,①在孵育120min之内,PHL和Pt对Que和IQue的跨膜转运均表现出明显的抑制作用,Pt对Que跨膜转运的抑制作用较PHL更强,而PHL对IQue的跨膜转运较Pt更强;② 在120min之后,PHL和Pt对Que表现出持续明显的抑制作用;对IQue的作用却有所不同,即在150min时Pt明显增加了IQue的透过量;③PHL和Pt对Que的抑制作用强于对IQue的抑制作用。这一研究结果提示,GLUT1和GLUT2可能同时参与了Que和IQue的跨膜转运过程,GLUT2在Que跨膜转运中的作用更大,而GLUT1则在IQue的跨膜转运中占据更重要的地位。同时研究发现,Pt和PHL对Que的抑制率明显高于IQue,提示不同的糖苷配基可能会影响糖苷与转运载体的结合,但并不是糖苷与转运载体结合的决定因素。另外,在孵育早期(30 m in),当PHL和Pt对Que的抑制率分别达到100%时,对IQue的抑制效率分别只有约40%;随后随着Pt的抑制率逐渐减弱,PHL的抑制作用却逐渐增强,90 m in达峰后迅速下降;表明在IQue的跨膜转运过程中也许还存在其他转运机制。同时,PHL和Pt对Que的抑制作用表现出随孵育时间延长而逐渐减弱的特点,这是由于槲皮素糖苷的竞争性转运产生的竞争性抑制作用,还是由于PHL和Pt在胞内产生代谢转化从而导致抑制作用减弱,或转运产物诱导下的外排作用增强所致,仍待进一步研究;而孵育120m in后,Pt对IQue跨膜转运表现出的促进作用,也值得进一步探讨。
综上所述,本研究结果表明,介导葡萄糖肠道吸收的2个主要内向型转运蛋白GLUT1和GLUT2均参与了Que和IQue的跨膜转运过程,且不仅Que和IQue均可以完整的分子形式透过单层Caco-2细胞而被肠道吸收,同时在细胞内和基底侧存在广泛的代谢转化,均会产生槲皮素糖苷的甲基化代谢产物,说明槲皮素糖苷之间可能具有相同的肠道吸收机制,不同的糖苷配基与吸收机制本身可能无关,但可能会对化合物与转运蛋白的结合产生影响。然而,有关GLUT1和GLUT2在介导槲皮素糖苷跨膜转运过程中的相互作用以及不同糖苷配基在糖苷与转运载体结合中所起的作用和作用机制尚不清楚,而相关研究对食物或药食同源食物中类黄酮物质营养学意义的进一步认识和开发利用具有参考价值。
