白芷冰片方对小鼠抑郁样行为的影响
2018-07-26丁振春张亭亭庄笑梅于能江李云峰张有志
丁振春,薛 瑞,张亭亭,尚 超,原 梅,庄笑梅,于能江,李 桦,李云峰,张有志
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
抑郁症是一种危害严重的心境障碍。据世界卫生组织统计,全球约有抑郁症患者3.22亿,2005-2015年间抑郁患者增加了18.4%,预计到2030年,其疾病负担将上升至世界疾病负担首位[1]。药物干预是抑郁症治疗的主要手段,目前抗抑郁化学合成药物存在有效率低、起效时间延迟、不良反应多等诸多不足[2]。抗抑郁天然药物和中药复方已成为抗抑郁药物研发的重要方向之一,如贯叶连翘提取物(路优泰)、巴戟天寡糖和舒肝解郁胶囊等已广泛用于临床,为轻中度抑郁症患者提供新的选择。中药治疗抑郁症具有多途径、多靶点和低毒副作用等优势[3],如对照研究显示,巴戟天寡糖疗效与氟西汀(fluoxetine,Flu)相当,且副反应轻微,安全性高,依从性好[4]。
白芷〔Angelica dahurica(Fisch.ex Hoffm.)Benth.etHook.f.ex Franch.et Sav.〕是伞形科当归属植物,入药始见于《神农本草经》,性味辛温,归肺、胃经,其具有发散风寒、通窍止痛、消肿排脓等功效[5]。白芷主要组分为白芷香豆素类化合物和挥发油成分,二者均有抗炎镇痛作用,且有明显的协同增效作用;同时,有研究认为,白芷香豆素对炎性疼痛的镇痛作用与中枢5-羟色胺(5-hydroxytrypta-m ine,5-HT)系统有着密切关系[6],提示白芷可能有潜在的情绪调节作用。冰片(borneolum)为樟科植物樟的新鲜枝、叶经提取加工制成,性味辛苦微寒,归心、肝、肺经,具有“通诸窍、散郁火”之功效,常作为引经药使用。现代研究发现,冰片能改善血脑屏障通透性,促进其他物质透过血脑屏障进入脑组织,提高配伍药物的血药浓度和生物利用度[7]。临床亦有采用白芷配伍冰片治疗头痛、牙痛和三叉神经痛的报道,二者配伍有开窍醒神、解郁止痛的功效。基于现代药理学、中医理论与临床实践,本研究以白芷配伍冰片组成白芷冰片方(A.dahurica&borneolum,ADB),采用多模型综合评价ADB的抗抑郁效应;并结合单胺和神经营养假说,初步探讨ADB抗抑郁作用机制。
1 材料与方法
1.1 动物
ICR小鼠,雄性,SPF级,体质量18~20 g,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2016-0002。饲养温度 22~26℃,湿度40%~60%,8∶00-20∶00灯光照明,自由摄食饮水。
1.2 药物与试剂
白芷和冰片购于北京同仁堂有限责任公司。度洛西汀(duloxetine,DLX;批号:1304002),上海万代制药有限公司;Flu(批号:20100801),常州第四制药有限公司。5-羟色氨酸(5-hydroxy-L-tryptophan,5-HTP;批号:H9772)、育亨宾(yohim bine,批号:Y3125)和利血平(reserpine)购于美国Sigma公司。微机程序控制的小鼠穿梭箱反应仪,美国Med Associates公司。兔抗脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、B 型酪氨酸激酶受体(tyrosine kinase-linked recepter B,TrkB)、环腺苷酸应答元件结合蛋白(cAMP response element binding protein,CREB)和磷酸化CREB(p-CREB)抗体单抗,美国CellSignaling Technology公司。小鼠抗人β肌动蛋白多抗、辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗、HRP标记山羊抗小鼠IgG二抗,北京中杉金桥科技有限公司。
ADB制备:将白芷粉碎,浸泡于85%乙醇(1∶10,M∶V)24 h,超声提取3次,每次1 h,收集提取液,减压旋蒸,浓缩成浸膏状,提取率10.8%,检测欧前胡素含量9.26mg·g-1,即每公斤白芷生药约含欧前胡素1 g。将冰片研磨成粉末,给药前同白芷浸膏混匀溶于0.5%羧甲纤维素钠(CMC-Na)。根据预实验结果制定最佳配比和剂量选择,冰片与白芷生药质量比为1∶180,设定ADB低〔(白芷3+冰片0.017)g·kg-1〕和高〔(白芷9+冰片0.05)g·kg-1〕2个剂量进行实验。
1.3 小鼠自发活动实验
将小鼠按体质量随机分为正常对照组、DLX(阳性药)组,ADB低和高剂量组,每组10只。各组分别ig给予0.5%CMC-Na、DLX 20mg·kg-1、ADB低或高剂量,给药容积10m L·kg-1。给药后1 h,将小鼠放入自发活动箱(60 cm×60 cm×20 cm),视频分析系统自动记录每只小鼠15m in内的运动总距离。
1.4 小鼠悬尾实验
小鼠分组及给药同1.3。给药1 h后进行悬尾实验,参照Steru等[8]建立的方法,悬尾箱(25 cm×25 cm×35 cm)顶板中心绳连一个小夹子。用胶带黏在小鼠尾部距尾尖2 cm处,用夹子夹住胶带,使小鼠倒悬于黑色悬尾箱中,头部距箱底约5 cm。观察6m in,记录后4m in内累计不动时间。以小鼠停止挣扎、呈静止的垂直悬吊状态即为“不动”。
1.5 小鼠强迫游泳实验
小鼠分组与给药同1.3。给药后1 h,按Porsolt等[9]建立的方法,小鼠轻放于高20 cm,直径12 cm,水深10 cm的圆柱形玻璃游泳缸中,水温24~26℃。观察6 m in,记录后4 m in内累计不动时间。以小鼠在水中停止挣扎、呈漂浮状态、仅有细小的肢体运动以保持头部浮在水面判定为“不动”。
1.6 5-HTP诱导小鼠甩头实验[10]
小鼠分组与给药同1.3。单次ig给药1 h后ip给予5-HTP 120mg·kg-1,立即开始观察,记录20m in内小鼠甩头次数。
1.7 育亨宾毒性增强实验
小鼠分组与给药同1.3。单次ig给药1 h后sc给予育亨宾30mg·kg-1,观察记录24 h内各组动物死亡数。
1.8 利血平耗竭实验[11]
小鼠按体质量随机分为正常对照组、模型组、阳性药组及ADB低、高剂量组,每组10只。正常对照组和模型组小鼠ig给予0.5%CMC-Na,阳性药组、ADB低和高剂量组分别ig给予DLX 20 mg·kg-1、ADB低或高剂量,给药容积10 m L·kg-1。给药后1 h,正常对照组ip给予生理盐水,其余各组均ip给予利血平2.5mg·kg-1。观察测定以下指标。
1.8.1 眼睑下垂
给予利血平后1 h,按小鼠眼睑闭合程度打分:完全睁开0分,1/4闭合1分,1/2闭合2分,3/4闭合3分,全闭合4分。统计各组平均得分。
1.8.2 肛温
分别于各组给药前(T0)和给予利血平2 h后(T1)用电子温度计检测小鼠肛温。统计2次肛温差值△T(△T=T0-T1)。
1.8.3 运动不能
给予利血平1h后,将小鼠置于直径7.5 cm的圆圈中央进行观察,15 s内不能走出圆圈记为“运动不能”。记录各组运动不能小鼠只数。
1.9 小鼠获得性无助(learned help lessness,LH)模型[12]
小鼠遭受无法逃避的电击后,将其置于可逃避电击的环境下,呈现操作行为缺失,如逃避行为障碍等,抗抑郁药可逆转以上行为缺失。实验分训练和测试2个阶段进行。训练阶段,小鼠适应性饲养1周,随机分为正常对照组和不可逃避电击组。实验时,将正常对照组置于电击箱但不施予电击,不可逃避电击组小鼠连续施予无信号且不可避免的电击360次,每次持续2 s,平均间歇8 s,电流强度0.3 m A,连续电击4 d,第5天给予同样电击180次后进行筛选。筛选程序包含10个测试周期,每一测试周期包括条件刺激期(灯光,3 s)、非条件刺激期(灯光加电击,3 s)和间歇期(无任何刺激,25 s),且穿梭箱的中间门持续开放。若小鼠在条件刺激期和非条件刺激期均未穿过中间门逃避电击,即为逃避失败(escape failure,EF),选择EF≥6次的小鼠(LH模型小鼠)均衡分为4组,即LH模型组(0.5%CMC-Na)、Flu(10mg·kg-1,阳性对照药)组、ADB低和高剂量组,每组10只,分组结束立即ig给药1次,此后连续测试3 d,每天测试前1 h ig给药。检测程序包括30个测试周期,每个周期包括条件刺激期(灯光,5 s)、非条件刺激期(灯光加电击,20 s)和间歇期(无任何刺激,25 s)。前5个周期中间门持续开放,后25个周期中间门在电击开始2 s后开启,电击结束后关闭。观察指标为后25个测试周期内EF次数和平均逃避潜伏期(escape latency,EL,即从灯光开启至小鼠穿过中间门逃至对侧的时间,逃避失败时EL记为25 s)。
1.10 Western蛋白印迹法检测BDNF,TrkB和p-CREB蛋白表达水平
在LH行为学检测结束后处死小鼠,断头分离出海马,液氮冻存,加入RIPA裂解液超声破碎,11 200×g 4℃离心30 m in取上清,BCA法蛋白定量,沸水中变性10 m in。经SDS-聚丙烯酰胺凝胶电泳分离目的蛋白,电转印至PVDF膜上。将PVDF膜浸入5%牛血清白蛋白室温封闭2 h,加一抗(1∶1000)4℃孵育过夜,而后加二抗(1∶3000)室温孵育1 h,用Immobilon Western化学发光HRP底物显影目标条带,采用Gelpro32软件检测蛋白条带光密度值。以目的蛋白与内参蛋白光密度值的比值反映目的蛋白表达水平。
1.11 统计学分析
实验结果数据采用GraphPad p rism 6.0软件进行分析,计数资料数据(利血平拮抗实验的运动不能和育亨宾毒性实验的致死率)采用精确Fisher检验;计量资料数据以x±s表示,LH实验结果采用重复测量的单因素方差分析(one-way ANOVA);其他计量资料数据采用单因素方差分析,组间差异检验采用Dunnett t检验。以P<0.05认为差异具有统计学意义。
2 结果
2.1 ADB对小鼠自发活动运动距离的影响
与正常对照组比较,DLX 20 mg·kg-1组及ADB低、高剂量组小鼠运动距离均无显著性差异,提示ADB在受试剂量下无中枢兴奋或抑制作用(表1)。
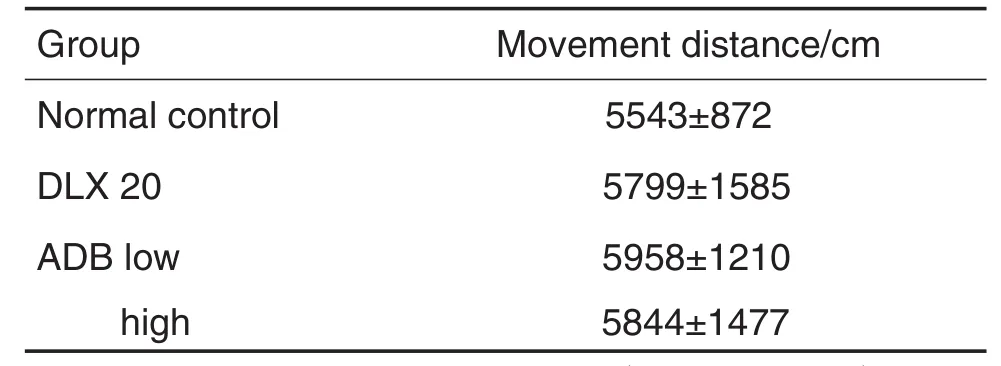
Tab.1 Effect of A.dahurica&borneolum(ADB)on movement distance in locomotor activity test in mice
2.2 ADB对小鼠悬尾不动时间的影响
与正常对照组比较,DLX 20 mg·kg-1与ADB低、高剂量组均可显著缩短小鼠悬尾不动时间(P<0.01)(表2),提示ADB具有抗抑郁作用。

Tab.2 Effect of ADB on immobility time in tail suspension test in mice
2.3 ADB对小鼠强迫游泳不动时间的影响
与正常对照组比较,DLX 20mg·kg-1、ADB低和高剂量组均可显著缩短小鼠强迫游泳不动时间(P<0.05,P<0.01)(表3),提示ADB具有抗抑郁作用。

Tab.3 Effect of ADB on imm obility tim e in forced sw imm ing test in mice
2.4 ADB对5-HTP诱导小鼠甩头行为的影响
与正常对照组相比,ADB高剂量组和DLX 20 mg·kg-1组可显著增加5-HTP诱导的小鼠甩头次数(P<0.01)(表4),提示ADB可增强5-HT能神经系统功能。

Tab.4 Effect of ADB on 5-hyd roxy-L-tryp tophan(5-HTP)induced head-tw itches in mice
2.5 ADB对育亨宾致小鼠毒性的影响
正常对照组小鼠sc育亨宾30mg·kg-1后24 h内死亡率为2/10;与正常对照组比较,DLX 20mg·kg-1组小鼠死亡率显著升高(P<0.01),而ADB对小鼠死亡率无明显影响(表5)。
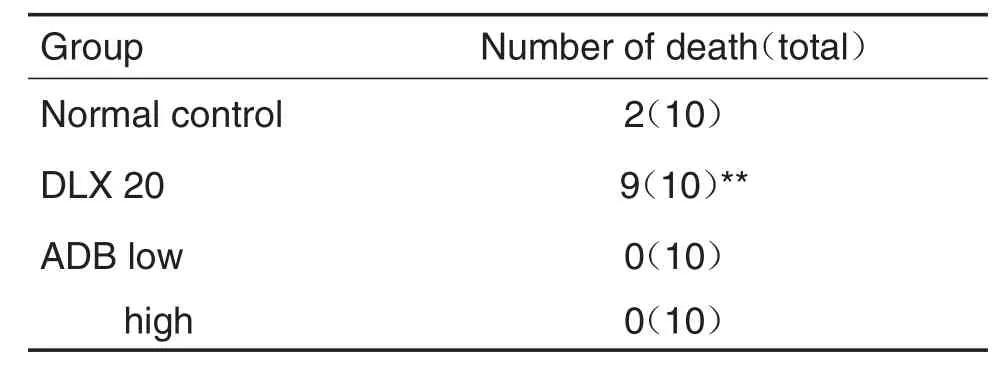
Tab.5 Effect of ADB on yohim bine-induced lethality in mice
2.6 ADB对利血平化小鼠行为的影响
小鼠ip给予利血平1 h后,与正常对照组相比,利血平模型组小鼠行为出现明显改变,即眼睑下垂、体温降低和运动不能(出圈率增加)(P<0.01),提示利血平化模型成功。与模型组相比,DLX组对利血平化引起的上述行为反应除运动不能外,均具有显著逆转作用(P<0.01,P<0.05);ADB高剂量组可显著减少小鼠眼睑下垂得分(P<0.05),但对利血平化引起的体温降低和运动不能无显著影响;ADB低剂量组对以上3指标均无显著影响(表6)。
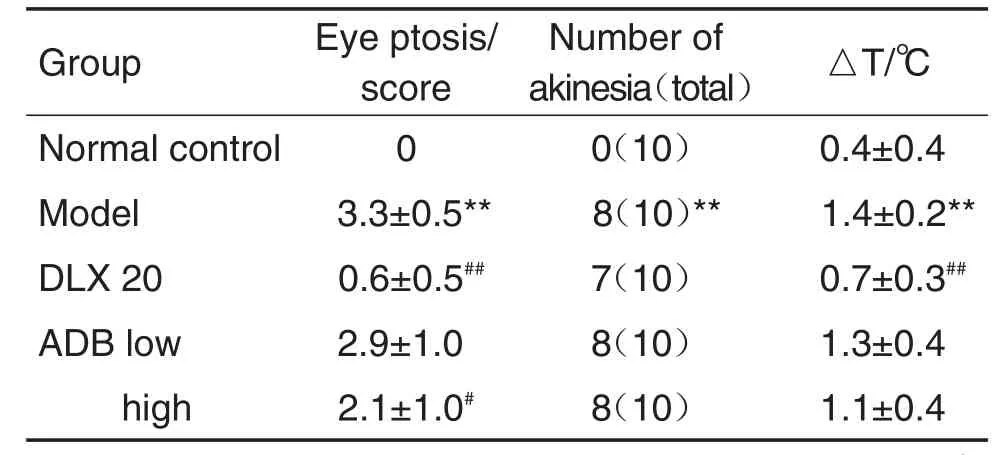
Tab.6 Effect of ADB on reserpine-induced eye ptosis,hypo therm ia and akinesia in mice
2.7 ADB对获得性无助模型小鼠穿梭箱逃避行为的影响
在连续3 d的穿梭箱行为测试中,LH模型组小鼠EF次数和EL较正常对照组均显著增加(P<0.05,P<0.05),提示LH建模成功。与LH模型组比较,Flu 10 m g·kg-1组和ADB高剂量组在测试第1~3天均使小鼠EF次数和EL显著减少(P<0.05,P<0.01),ADB低剂量在测试第2天亦显著减少小鼠EF次数(P<0.05)(图1)。提示ADB具有抗抑郁作用。
2.8 ADB对获得性无助模型小鼠海马BDNF,TrkB和p-CREB表达的影响
与正常对照组相比,LH模型组小鼠海马BDNF(图2A)和TrkB(图2B)表达水平以及CREB磷酸化(图2C)水平均显著降低(P<0.05,P<0.01);与LH模型组相比,Flu组和ADB高剂量组小鼠海马以上3指标均显著增加(P<0.05,P<0.05)(图2),ADB低剂量组BDNF表达水平也显著增加(P<0.05)(图2A)。

Fig.2 Effect of ADB on expression of brain derived neu ro trophic fac to r(BDNF,A),tyrosine kinase recep to r B(TrkB,B)and phosphorylaton of cyc lic AMP response element binding p ro tein(p-CREB,C)in hippocam pus of mice by Western b lo tting.See Fig.1 for the m ouse treatm ent.A2,B2 and C2 was the sem i-quantitative results of A1,B1 and C1,respective ly.x±s,n=8.*P<0.05,**P<0.01,com pared with norma lcontro lgroup;#P<0.05,##P<0.01,com pared withm ode lgroup.
3 讨论
白芷冰片配伍的抗抑郁效应未见报道,本研究证实ADB方在3个应激行为模型中具有显著抗抑郁作用。
应激模型是抗抑郁药物评价应用最广泛的模型,主要包括行为绝望模型、LH模型和慢性不可预知应激模型等。小鼠悬尾实验和大小鼠强迫游泳实验属行为绝望模型,是利用动物在恶劣环境下,当逃脱无望时出现“行为绝望”的原理对药物潜在的抗抑郁作用进行评筛,多数抗抑郁药都可减少小鼠悬尾和(或)强迫游泳时的不动时间,而对自发活动不产生影响。本研究结果显示,急性给药情况下ADB可显著减少小鼠悬尾和强迫游泳不动时间,并对自发活动无影响,提示ADB具有抗抑郁作用。LH模型在抑郁症病理生理学机制研究和抗抑郁新药研发领域已得到广泛应用。其原理是多次给予小鼠不可逃避的足底电击以后,即使将其放在可逃避环境下,模型小鼠会出现逃避行为障碍,表现为EF次数增加和EL延长。本研究结果表明,ADB可显著减少LH模型小鼠的EF次数和EL,显示抗抑郁作用。综上,行为药理学实验结果证实ADB具有显著抗抑郁作用。
单胺假说认为抑郁症的发生与脑内单胺递质5-HT和(或)去甲肾上腺素的缺乏有关,在过去的几十年,这个假说得到了越来越多的实验和临床验证,现有的绝大多数抗抑郁剂都是在单胺策略基础上研发产生[13]。Wang等[14]研究表明,单用冰片无抗抑郁作用,而冰片可能显著增强5-HTP的抗抑郁作用。白芷香豆素可显著升高炎性疼痛模型小鼠脑组织5-HT和5-羟吲哚乙酸含量[15],提示ADB的抗抑郁作用有可能与脑内单胺递质关系密切。药物相互作用模型包括5-HTP诱导甩头实验、育亨宾毒性增强实验和利血平耗竭实验等,是基于单胺假说建立,可用于初步评价药物对单胺能神经系统的影响。本研究发现,ADB可显著增加5-HTP诱导的甩头行为,对育亨宾致死作用无明显影响;此外,ADB可逆转利血平引起的眼睑下垂,对体温降低和活动能力减低无影响;上述结果表明,ADB发挥抗抑郁作用主要通过增强5-HT能神经功能实现,对去甲肾上腺素和多巴胺系统无显著影响。
抑郁症的发生不仅与脑内神经递质有关,还涉及信号传导系统及基因转录过程,从而引起特定脑区神经营养障碍,神经可塑性下降。神经营养因子及其相关信号传导通路均与抑郁症的发病密切相关。BDNF是神经营养因子家族重要成员,广泛分布于中枢神经系统,尤以海马和大脑皮质含量最高,在维持神经元功能、突触可塑性、神经元损伤保护及神经元再生过程中发挥重要作用。BDNF可作为信号转导通路的配体与其受体TrkB高亲和力结合,激活细胞内信号转导通路,促进CREB的磷酸化,CREB是重要的核内转录因子,参与调控BDNF的表达[16]。抑郁症患者海马BDNF及其细胞表面受体TrkB较正常人降低,长期给予抗抑郁药可增加海马BDNF和TrkB的表达,增强CREB的表达水平或磷酸化水平,进一步介导BDNF功能[17]。本研究发现,LH模型组小鼠BDNF,p-CREB和TrkB的表达显著降低,ABD可显著上调海马BDNF,p-CREB和TrkB的表达水平,与阳性药Flu具有同样的作用,提示ADB的抗抑郁作用与上调海马BDNF/TrkB/p-CREB神经营养通路有关。
本研究发现,ADB在多个动物模型上具有显著的抗抑郁作用,其机制与增强中枢5-HT能神经系统功能,上调BDNF/TrkB/p-CREB神经营养通路有关。
