柴胡三参胶囊对p38MAPK通路介导BMSCs向心肌细胞分化的干预研究*
2018-07-26刘建和赵吉锐雷娄芳杨成龙
刘建和 赵吉锐 雷娄芳 杨成龙 曾 英 王 敏
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南省重点实验室中西医结合心脑疾病防治实验室,湖南 长沙 410007;3.湖南中医药大学,湖南 长沙 410208)
近年来,心血管疾病已成为我国人群的主要死亡原因之一[1],其中急性缺血性心律失常是心血管病极度普遍的临床表现类型[2],临床风险重大,可加重基础心脏疾病,并能导致心源性猝死。目前,药物治疗仍是缺血性心律失常的主要治疗手段,但抗心律失常药的诸多不良反应始终限制其临床运用[3],随着认识水平的提高,心律失常的治疗逐渐以控制原发病,调控心脏基本状况为重点,如保证充足血供、稳定血流动力学状况等比医治心律失常自身更为紧要。且药物研究逐渐由组织器官水平向细胞水平发展,干细胞移植治疗心肌缺血及由此诱发的心律失常得到了越来越多的关注与研究。骨髓间充质干细胞(BMSCs)是从骨髓中筛选的已提交心肌谱系的多能成体干细胞,在某些诱导剂作用下可分化成心肌细胞,延缓心脏重构,保证细胞的正常功能,促进损伤心肌的修复[4],这无疑在心律失常的治疗中拥有重要的运用前景。柴胡三参胶囊抗心律失常效果明显[5-8],且在前期研究中发现,其能明显减少缺血性心律失常大鼠心肌中PKA、PKC的表达及血清CRP水平,表明其对心肌急性损伤具有保护作用[9],此外,柴胡三参胶囊还能明显减少大鼠心肌细胞HERG K+通道蛋白的失活,减少快速型室性心律失常的出现[10]。本研究旨在通过对柴胡三参胶囊促进BMSCs分化为心肌细胞后p38MAPK、MEF2C及CTnT表达程度影响的研究,佐证柴胡三参胶囊能够通过促进诱导剂与受体结合激活p38MAPK信号通路促进BMSCs向心肌细胞的分化从而起到抗心律失常的作用,并为更为深入探讨柴胡三参胶囊抗心律失常的信号机制拓宽思路。
1 材料与方法
1.1 细胞株
P1代骨髓间充质干细胞株,购自赢润生物科技有限公司。
1.2 实验动物
健康清洁级 SD 大鼠 20只,体质量(200±20)g,雌雄各半,普通饲料喂养,定期更换垫料,自由摄食,购自天勤动物公司,许可证号:SYXK(湘)2014-0011。
1.3 试药与仪器
柴胡三参胶囊(由柴胡、法半夏、黄连、党参、丹参、苦参、青蒿、甘草组成,剂量比例 15∶10∶6∶15∶10∶10∶10∶6,每粒胶囊质量为0.4 g)。特级胎牛血清(美国hyclone公司),青、链霉素(武汉贝茵莱生物科技有限公司),培养基(美国hyclone公司),水合氯醛(普盛药业有限公司),PBS粉(赢润生物有限公司),DMSO溶解剂(赢润生物有限公司),MTT试剂盒(福州飞净生物科技有限公司),逆转录试剂盒(上海生工生物工程技术服务有限公司),DNA marker I(上海生工生物工程技术服务有限公司),BMP-2 粉末包(2 μg)(上海生工生物工程技术服务有限公司),0.25%胰酶+0.02%EDTA (美国Sigma公司),Trizol试剂(上海生工生物工程技术服务有限公司),细胞蛋白裂解液(赢润生物有限公司),抗体p38MAPK(北京博奥森生物技术有限公司),抗体MEF2C(北京中杉金桥生物技术有限公司),抗体CTnT(北京中杉金桥生物技术有限公司),超净工作台(SWOJ-1F苏净集团安泰公司),离心机(BiofugeStratos德国Thermo公司),恒温水浴箱(SW2-261-79上海医用恒温设备厂),紫外分析仪(BOT-III北京中仪博腾科技有限公司),电泳仪 (DYY-8C北京六一仪器厂),VDS凝胶成像系统 (GIAS-4400北京炳洋科技有限公司),显微镜(IX71日本 Olympus公司)。
1.4 实验方法
1.4.1 含药血清制备 将大鼠随机分为柴胡三参胶囊组和空白对照组,每天于8:00和16:00分别灌服柴胡三参胶囊灌胃液及等量生理盐水,采用连续7 d予3倍量给药,依照体表面积3倍量进行计算[11](按成人70 kg、大鼠200 g体表面积换算:成人等效剂量4.8 g/d,折算为2.4 g/d,2次/d),于末次灌药1 h后,注射水合氯醛使大鼠处于麻醉状态,对大鼠下腹主动脉取血,取血时随即注入真空采血管,常温下静置2 h,待上清液析出,以3000 r/min离心10 min,再用移液枪小心析出上清,即为柴胡三参胶囊含药血清,再将每组血清调匀后,放入56℃的水浴箱中灭活30 min,以0.22 μm的微孔滤膜过滤细菌,放于-20℃冰箱中保存以待取用,空白组同上操作分离出不含药的空白血清。
1.4.2 常规细胞复苏、换液、传代、冻存 取出冷冻管,投入37℃水浴中,摇动冻存管,使其融化;5 min内用培养液稀释至原体积至少10倍;1000 r/min离心5 min;去上清,加新鲜培养液培养刚复苏的细胞;常规细胞培养2~3 d后,去旧培养液,用无钙、镁的D-Hanks洗涤2次,添入培养液,在细胞培养箱中培养;开启培养房及工作台,紫外消毒20 min,吸弃培养基,PBS洗涤两次,加入2 mL消化液,覆盖整个细胞界面后吸弃,观察培养瓶底端出现一层云雾状,轻敲底部有块状物脱落,镜下可见细胞间隙变大,细胞回缩变圆,少量漂浮后加入10 mL含血清培养基终止消化,吹打管吹打数次将细胞悬液吸至离心管,1000 r/min离心5 min吸弃上清,加入PBS吹打混匀,1000 r/min再次离心5 min,丢弃上清,加入新鲜培养基,吹打混匀,按比例接种到细胞培养瓶。当细胞融合约80%~90%时,吸除培养基,用无菌D-Hanks液清洗2次,用含有0.02%EDTA的0.25%胰酶消化细胞,消化后吸除胰酶,加入约2 mL培养基吹打混匀细胞,转入到15 mL离心管中,1000 r/min离心5 min,去除上清收集细胞,用冻存液(10%DMSO、90%FBS)重悬细胞,将细胞悬液分装至冻存管中,每管1 mL,标记细胞种类、冻存日期、细胞传代数,采用梯度降温方法进行细胞冻存:用脱脂棉包裹冻存管,4℃放置 15~30 min,-20 ℃约 1~2 h,-80 ℃保存12 h,最后存入液氮罐中备用。
1.5 检测指标
1.5.1 MTT法检测BMSCs增殖 按柴胡三参胶囊含药血清占培养液的比例分为0%、5%、10%、20%、40%5个浓度组,每组建立6个复孔,应时添加一定MTT溶液及DMSO溶解液,490 nm波长下获取OD值,确定最佳浓度后,分6、12、24、48 h 4个时段进行观察,得到最佳时间。
1.5.2 Western blotting法检测各组细胞内p38MAPK mRNA表达 分为空白组、BMP-2+柴胡三参组、BMP-2组、柴胡三参组。以6孔板收集细胞,胰酶消化,按比例加入RIPA和PMSF,冰冻且分裂细胞30 min后,离心5 min,将上清在-20℃条件下分装冻存。选取0、1、2、4、8、12、16、20 μL 8 个容量将标准液注入 96 孔板的前面8个标准孔中,再在其他的板孔中铺入10 μL待测样品,陆续加入PBS,常温下静置30 min。测定蛋白浓度至A560,得出蛋白浓度。按照前期比例调配浓缩胶,使其高度融合。算出体积,根据buffer=4∶1的标准均匀混入上样buffer,逐步加入Marker和待分析样品,分别以80 V及100 V恒压进行电泳,量出目的蛋白的长与宽,过滤10 s,置入有10%甲醇的器皿,注入去离子水及电转液。以恒流20 mA转膜,PBS液清洗后置于摇床,完成后于静置90 min。用相应抗体加入一抗稀释液,室温下摇床孵育90 min,以PBS洗涤3次,每次10 min,同上行二抗孵育。标准化将ECL工作液铺满膜层表面,安放1~2 min后在凝胶成像系统中查看以及摄像。
1.5.3 RT-PCR法检测各组细胞内MEF2C、CTnT蛋白表达 用胰酶液消化6孔板的细胞收集于EP管中,后以匀浆器匀浆,室温放置5min并常规离心15 min。将离心后的均匀液体分层,上层液移至洁净的试管中,接着注入无杂质水连续吹打后存放于-80℃环境下。取少量RNA溶液用TE稀释后,读取标准的吸收值,A260下读值为1表示RNA为40 μg/mL。轻弹管底将溶液混合,短暂离心。以70℃干浴3 min,取出静置待其冷却,再注入逆转录酶液0.5 μL,分别以35℃水浴60 min及90℃干浴3 min,用移液枪吸除cDNA(逆转录终溶液)溶液,存放于-80℃以备用。把样品中待检测基因予以即时定量PCR,将全数cDNA样品调配即时定量PCR反应体系。轻弹管底将溶液混合,6000 r/min短暂离心。把已调配的PCR反应液体置于RT-PCR仪上启动PCR扩增反应。反应条件为:在93℃条件下预变性2 min,再以93℃ 1 min,60℃ 1 min,共40个循环。将目的基因条带p38MAPK mRNA、MEF2C、CTnT的蛋白与内参照的平均吸光度值依次行半定量分析。
1.6 统计学处理
以SPSS19.0统计软件处理数据和单因素方差分析。以P<0.01为显著性差异的标准,分析各组产物相对量的情况。
2 结 果
2.1 MTT法检测BMSCs生存率
见表1。经柴胡三参胶囊含药血清干预后,含药血清浓度在培养液中所占比例为5%、10%、20%、40%时下各时间点OD值均较0%比例浓度下高 (P<0.01),在20%浓度时达到最大值;以20%浓度在24 h时间节点下OD值均比其余各组高(P<0.01),故考虑以20%干预24 h为最佳梯度。
表1 柴三胶囊对干细胞增殖的影响(±s)

表1 柴三胶囊对干细胞增殖的影响(±s)
与本浓度不同时间比较,*P<0.05;与不同浓度同时间比较,△P<0.05
?
2.2 含药血清诱导后BMSCs增殖情况
见图1、2。镜下可见大量密集的BMSCs悬浮或沉积于培养皿底,PBS缓冲液反复冲洗后可见少量散在分布的贴壁细胞,呈多角短梭形,胞核浆分界清晰,胞核位于胞体膨大部的中央,单核仁居多,胞体可有不规则突起可见多边形,无异常突起突出;干预48 h后,反见细胞数量较24 h干预时减少,细胞密度降低,呈现不同程度的凋亡趋势。

图1 24hBMSCs增殖情况(40倍)

图2 48hBMSCs增殖情况(40倍)
2.3 各组干预后BMSCs中p38MAPK mRNA表达
见表2,图3。诱导后BMP-2组、BMP-2+柴胡三参组、柴胡三参组p38MAPK表达程度均高于空白组,差异有统计学意义 (P<0.01);BMP-2+柴胡三参组表达水平高于 BMP-2 组、柴胡三参组(P<0.05);BMP-2组与柴胡三参组对比,差异无统计学意义(P>0.05)。诱导后30 min,BMP-2+柴胡三参组内的p38MAPK明显可见,BMP-2组、柴胡三参组及空白组表达相对较弱。
表2 各组干细胞p38MAPK mRNA表达的影响(±s)
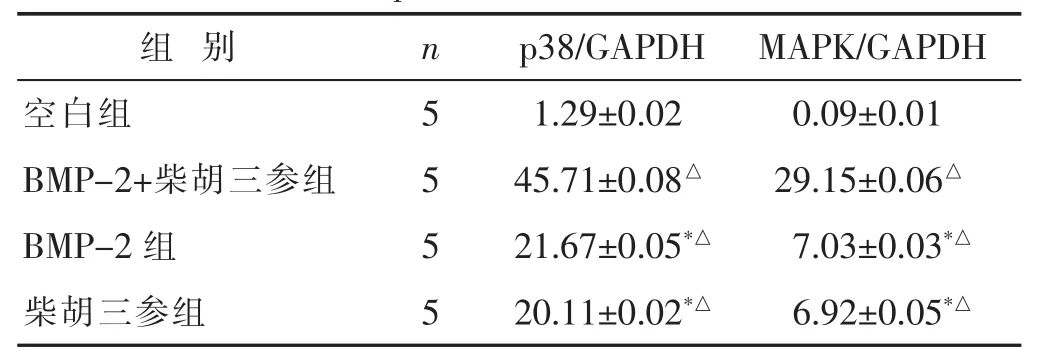
表2 各组干细胞p38MAPK mRNA表达的影响(±s)
与 BMP-2+柴胡三参组比较,*P<0.05;与空白组比较,△P<0.01。下同
?

图3 各组p38MAPK电泳条带
2.4 各组干预后心肌基因指标MEF2C、CTnT蛋白的表达
见表3。诱导后BMP-2组、BMP-2+柴胡三参组、柴胡三参组MEF2C表达水平均高于空白组,差异有统计学意义 (P<0.01);BMP-2+柴胡三参组表达水平高于 BMP-2 组、柴胡三参组(P<0.05);BMP-2组与柴胡三参组比较,差异无统计学意义(P>0.05)。
表3 各组诱导后MEF2C、CTnT蛋白表达水平(±s)

表3 各组诱导后MEF2C、CTnT蛋白表达水平(±s)
?
3 讨 论
在BMSCs向心肌细胞分化过程中,有诸多的信号通路发挥作用,其中之一便是p38MAPK通路。它参与多类生物细胞过程的调控,尤其在干细胞的增生繁殖与分化的调控过程中具有举足轻重的作用[12]。p38MAPK信号通路在由BMP-2介导的心肌细胞发育或分化的过程中具有关键作用,活化的p38MAPK能够上调ATF2、MEF2C等多种转录因子的表达,而这两种转录因子可以结合到许多基因启动子区AP-1位点,增加其转录活性,影响细胞的增殖、分化,以激活下游基因或蛋白如CTnT、MEF2C等的表达,达到向心肌细胞分化的目的[13]。
缺血性心律失常是由于心肌缺血引起心肌细胞坏死抑或凋亡,无法达到心肌修复要求进而出现数量减少,导致电活动形成及传导均反常。缺血引发心脏中拥有正常舒缩效应的心肌细胞数目下降,心功能减退。以往的观念表明心脏不具有再生以及自我修复的功能,也无法进行自我更新,只能依靠纤维瘢痕组织修复或未受损心肌细胞肥大来进行代偿[14]。目前,干细胞移植治疗缺血性心律失常已成为研究的热点。而BMSCs容易取材,对人体损害甚微,而且可以进行定向分化,并且方便着床,缺血条件对其无明显影响,自身细胞移植也未见明显排异现象等。以上特性使BMSCs移植具有天然优势,成为干细胞移植主要的种子细胞[15-16]。本研究显示,柴胡三参胶囊含药血清作用后,BMSCs大量增殖且在24 h达到最大值,与诱导剂合用后细胞内的p38MAPK、MEF2C及CTnT表达明显升高,可见柴胡三参胶囊能够促进诱导剂与其受体相结合,促进BMSCs向心肌细胞的分化。因此,在干细胞移植治疗前以柴胡三参胶囊对诱导因素进行预处理,能够明显增强BMSCs的分化能力,提高心肌修复效率。更加细致的研究P38MAPK信号通路在BMSCs分化中的作用,对于揭示BMSCs分化的机制及为临床采用干细胞移植治疗缺血性心律失常寻找更加高效的方法具有重要价值。
