响应面法优化稀酸水解处理麸皮的条件
2018-07-24江冰心张建国
冯 豪,江冰心,张建国
(上海理工大学 医疗器械与食品学院 食品科学与工程研究所,上海 200093)
麸皮为小麦磨取面粉后筛下的种皮,约占小麦加工量的20%。我国是小麦生产大国,年产量已超过1.15亿t,每年加工出的小麦麸皮可达2000万t以上[1]。麸皮含有丰富的淀粉、纤维素、蛋白质及维生素等营养元素[2],其中,淀粉、纤维素和半纤维的总比例超过50%。由于麸皮的食感差,人们不习惯食用,所以每年产生大量的麸皮待被利用。目前绝大部分麸皮以简单的处理后用做了饲料[3]。所以,寻找出更加合理的麸皮利用方式是十分有必要的。麸皮是一种典型的既含有五碳多聚糖又含有六碳多聚糖的生物质资源。比其他生物质(如,秸秆等),麸皮更易处理,可提升的利用空间更大。将麸皮处理后作为培养基质进行微生物发酵是一种非常可行的方式。麸皮经过处理后可以培养微生物产生有用的代谢物,比如乳酸[4]和乙醇[5]。但是,麸皮中碳源大都以聚合物形式存在。因此,对麸皮进行预处理是非常有必要的。目前的生物质预处理技术中爆破类(蒸汽爆破、氨纤维爆破、CO2爆破)需要特殊的设备,且操作较危险。碱法预处理的腐蚀性比稀酸预处理强。所以稀酸法是目前生物质预处理的主要方法[6-7]。稀酸法预处理有水解效率高[8-9],操作方式简单,利用酸量少[10]等优点。稀酸水解的方法采用的低酸浓度还具有腐蚀性低优点[11]。郭娜等[12]采用正交法优化了酸水解麸皮的稀酸浓度、温度、时间和麸皮浓度,酸水解后还原糖质量浓度达到38.14 g/L,水解率为51.49%。酸处理不仅水解糖链产生单糖,而且使木糖、果糖和葡萄糖等单糖发生脱水反应,产生糠醛和5-羟甲基糠醛两种主要的抑制剂[13]。所以优化酸处理麸皮的条件提高麸皮释放糖量,降低抑制剂产生量[14],有利于麸皮的利用。
本研究选择低浓度酸对麸皮预处理,首先进行单因素实验分析硫酸浓度、处理温度、处理时间以及麸皮浓度对产糖率的影响。然后,对处理温度、处理时间和麸皮浓度进行响应面优化实验,并分析预处理条件和有毒物质产生之间的关系,以期得到最合适水解产糖条件,为麸皮的高效利用展奠定基础。
1 材料与方法
1.1 材料
小麦麸皮(山东省荷泽市牡丹区);糠醛(99%,色谱纯)、5-羟甲基糠醛(98%,色谱纯),Sigma公司;乙腈(色谱纯),德国CNW公司;乙酸(99%,分析纯)、甲酸(99%,色谱纯)、浓H2SO4(98%),国药集团化学试剂有限公司。
Waters 1525型高效液相Athena C18色谱柱(Waters公司);ML104/02型梅特勒分析天平,(精确度+0.000 1),梅特勒-托利多公司;Hirayama HVE-50 型高压灭菌锅,华粤企业集团有限公司;TDL-5-A型离心机,上海安亭仪器厂;LMR-340型酶标仪,Labexim公司。
1.2 方法
1.2.1 酸浓度对水解麸皮的糖释放量的影响
分别量取质量浓度为6、8、10、12、14、16、18、20和22 g/L的100 mL稀硫酸溶液,加入10 g麸皮(定义为麸皮质量浓度100 g/L),120 ℃预处理1 h。降温到室温后,以4 500 r/min离心10 min。测定所得上清液的体积和糖质量浓度,计算产糖率。具体计算见式(1)~(2)。

(1)
m2=ρ1V1
(2)
式中:m1为底物量(g);m2为糖的释放量(g);w1为水分含量(%);w2为蛋白质含量(%);w2=氮含量×0.625;ρ1为水解液中总糖质量浓度(g/L);V1预处理液体积(mL)。
1.2.2 处理温度对酸水解麸皮的糖释放量的影响
将100 mL的10 g/L硫酸和10 g麸皮混合后,放入灭菌锅中,在温度分别为95、100、105、110、115、120、125和130 ℃下,处理1 h;其他操作步骤同1.2.1节。
1.2.3 处理时间对酸水解麸皮的糖释放量的影响
将100 mL的10 g/L硫酸和10 g麸皮混合后,以120 ℃分别处理25、30、35、40、45、50、55、60、65和70 min;其他操作步骤同1.2.1节。
1.2.4 麸皮浓度对水解麸皮的糖释放量的影响
将100 mL的10 g/L硫酸分别和6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0 g麸皮混合,然后经120 ℃预处理1 h;其他操作步骤同1.2.1节。
1.2.5 以响应面方法优化酸水解麸皮释放糖
根据单因素实验结果,应用Minitab 15软件设计Box-Behnken响应面优化实验。选取处理温度、处理时间和麸皮浓度3个因素,设定3因素3水平的实验。具体因素与水平设计见表1。预处理后测定水解液体积和糖含量、糠醛、5-羟甲基糠醛的含量。

表1 响应面试验因素水平表
1.2.6 麸皮的元素分析
将麸皮粉碎后,过0.9 mm筛后,干燥(80 ℃、24 h)后利用元素分析仪(Vario EL III,德国Elementar公司)分析。
1.2.7 水解液糖浓度测定
总糖测定方法按照GB/T 9695.31—2008进行,吸取稀释适当倍数麸皮水解液1 mL,加入20 mL比色管中,加入苯酚溶液(50 g/L)1 mL充分混合,加入浓硫酸5 mL立即摇匀,室温放置20 min,在470 nm波长处,以0号管为参比,测定吸光度值。
1.2.8 麸皮酸水解液中糖组分含量的测定
糖组分含量的测定采用1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化-高效液相色谱(HPLC)法,并根据文献[15-16]的研究方法进行修正。具体步骤如下。
分别准确称量0.1000 g葡萄糖、0.100 0 g木糖、0.100 0 g阿拉伯糖和0.100 0 g甘露糖,溶于0.3 mol/L NaOH溶液,定容50 mL。分别取100 μL的单糖标准液与100 μL PMP的甲醇溶液(0.5 mol/L)混合后在70 ℃水浴反应33 min。冷却至室温后加入100 μL 0.3 mol/L盐酸,混匀后用1 mL氯仿萃取,8 000 r/min离心,取上层水相经过0.22 μm滤膜后进行HPLC分析。
对于麸皮水解液,取100 μL麸皮水解液与50 μL PMP甲醇溶(1.0 mol/L)、50 μL 0.6 mol/L NaOH溶液混匀,70 ℃水浴反应33 min。冷却至室温后加入100 μL 0.3 mol/L的盐酸,混匀后用1 mL氯仿萃取,8 000 r/min离心,取上层水相经过0.22 μm滤膜后进行HPLC分析。根据糖含量和HPLC峰面积的关系计算麸皮水解液中糖组分的含量。色谱条件为Athena C18(4.6 mm×250 mm,5 μm)色谱柱,流动相:A相为乙腈,B相为0.1 mol/L乙酸铵缓冲液(pH 6.8);A相与B相的体积比为17∶ 83。检测波长254 nm,进样量20 μL,流速为1 mL/min。
1.2.9 糠醛和5-羟甲基糠醛含量的测定
糠醛和5-羟甲基糠醛含量采用高效液相色谱方法测定。具体方法根据文献[17-18]而修正。具体步骤:将样品稀释,经过0.22 μm针孔过滤器过滤后按照设定好的色谱条件进行测定。色谱柱为Athena C18(4.6 mm×250 mm,5 μm),柱温为25 ℃;检测波长为280 nm;流速为0.5 mL/min;进样量为20 μL;流动相为0.2%乙酸-乙腈(体积比为43∶ 7)。麸皮水解液中糠醛和5-羟甲基糠醛的含量根据糠醛和5-羟甲基糠醛标准品与色谱上的峰面积关系的外标法计算而得。
1.2.10 甲酸乙酸含量的测定
甲酸和乙酸含量采用高效液相色谱内标法测定。具体根据文献[19]修正。具体步骤为样品经过0.22 μm针孔过滤器过滤后按照色谱条件进行测定。色谱柱为Athena C18(4.6 mm×250 mm,5 μm),柱温为25 ℃,检测波长为215 nm,流速为0.5 mL/min,进样量为5 μL,流动相为甲醇-水溶液(体积比为5∶ 45)。麸皮水解液中甲酸和乙酸含量根据甲酸和乙酸标准品与色谱上的峰面积关系的外标法计算而得。
1.2.11 猛烈度的计算
猛烈度(LogR0)表示将处理时间和与处理温度整合为一个实验因素,像麸皮浓度一样[20],具体计算见式(3)。
(3)
式中:t代表处理时间,T代表处理温度。
1.2.12 数据统计分析
本研究中采用3个平行试验操作,并应用Minitab 15软件和Origin Pro 8.5软件分析实验数据。
2 结果与讨论
2.1 酸水解麸皮中的几个单因素对产糖率的影响
考察酸水解麸皮过程中受到酸浓度、处理温度、处理时间和麸皮浓度的影响,结果见图1。由图1(a)可知:酸用量对麸皮的产糖率呈现波动性起伏,为了减少酸的使用量,所以10 g/L的酸浓度较合适。
由图1(b)可知:从 95 ℃开始,随着处理温度升高,产糖率逐渐升高;到110 ℃时,产糖率达到最高值94.47%。然后,当大于110 ℃时随着处理温度的升高而降低。
由图1(c)可知:处理时间对麸皮产糖率的影响总体上成钟形曲线。产糖率在处理时间为50 min时达到最高值83.33%。
由图1(d)可知:麸皮质量浓度低于100 g/L时水解效率随着麸皮浓度的增加而升高;麸皮质量浓度大于100 g/L,随着麸皮浓度的增加而逐渐降低。
由此可以看出酸浓度对产糖率的现象不够显著。因此,选择处理温度、处理时间和麸皮浓度作为下面响应面优化的主效应因素。
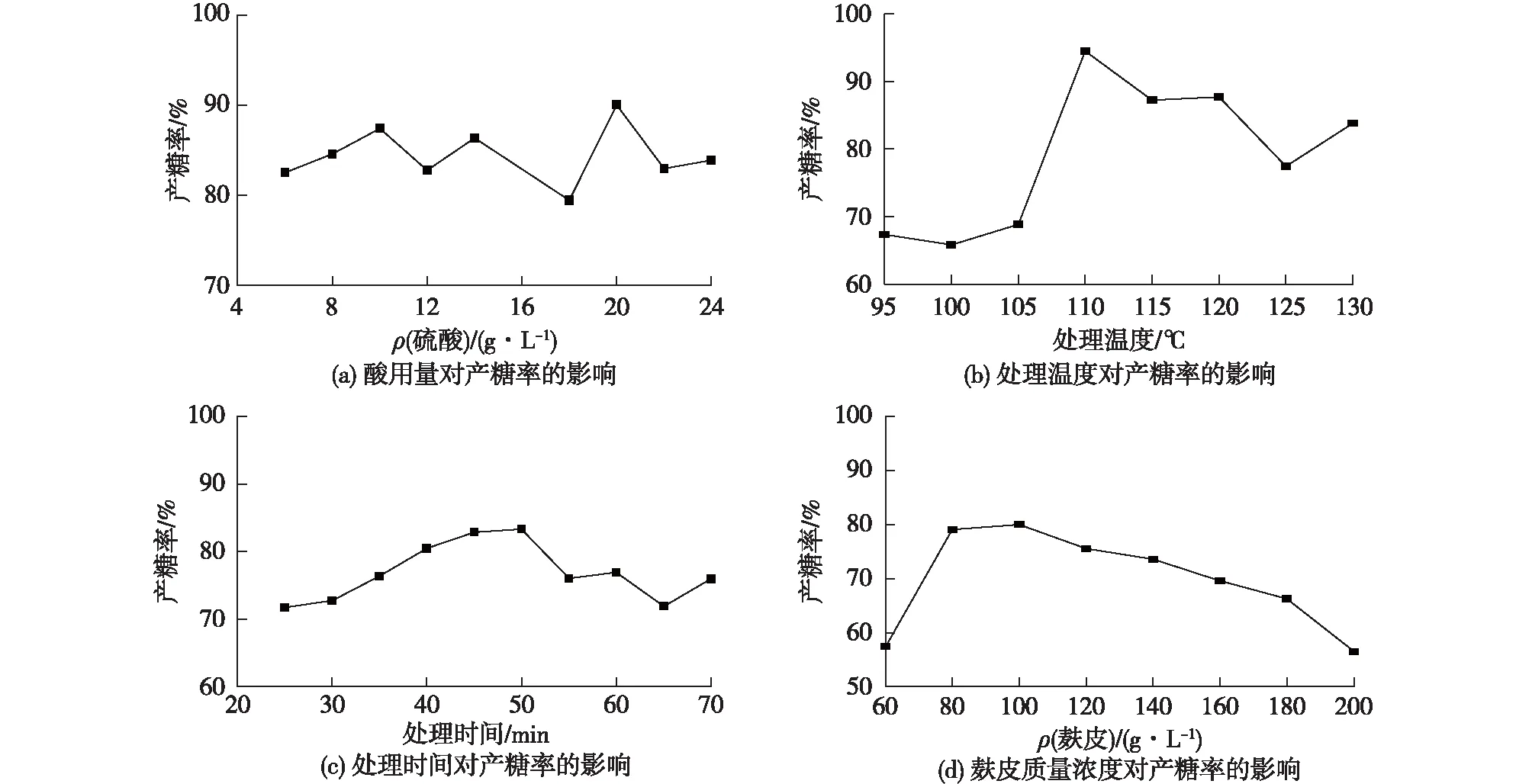
图1 酸用量、处理温度、处理时间和麸皮质量浓度对产糖率的影响Fig.1 Effects of acid dose,temperature,time and wheat bran mass content on sugar yield
2.2 响应面方法优化酸水解麸皮
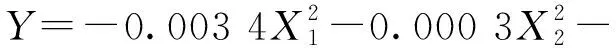
可用该回归方程代替实验真实点对实验进行分析。响应面回归模型方差分析见表4。模型回归项的P为0.001,表明该多元二次方程模型是有效的。一次项和二次项的P值分别为小于0.001和等于0.001,所以都非常显著,交互作用项也显著(P=0.016)。失拟项的P值为0.655,P值大于显著水平0.05,所以接受原假设。该回归方程并没有因为漏掉高阶交互作用项而产生失拟现象,模型不存在失拟现象。
多元二次响应面回归模型的建立与分析见表3和表4。

表2 响应面试验结果

表3 响应面实验的回归系数分析表
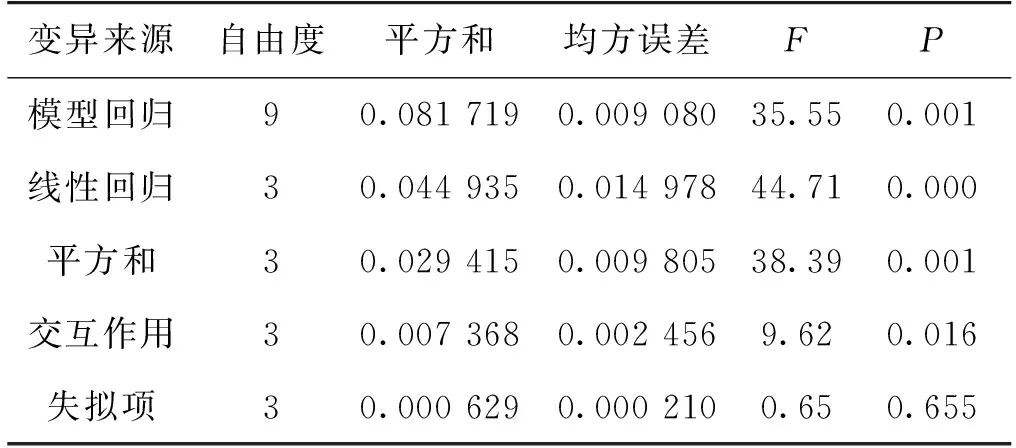
表4 二次响应面回归模型方差分析表
响应面结果模型的响应面图见图2。响应面图能直观反应产糖率随因素变化升降起伏情况。图2(a)的曲面图上呈现沿温度轴方向坡度陡峭,也说明处理温度在105~110 ℃内的模型斜率较大,产糖率升高或降低快。图2(b)为处理时间为50 min时的响应面。图2(b)显示产糖率沿处理温度的升高方向和麸皮浓度降低方向上升。另外,表3中处理温度和麸皮浓度的交互作用显著值(P=0.009)。这表明两因素交互作用显著。图2(c)为处理温度为110 ℃时的响应面图。图2(c)可以看出产糖率沿麸皮浓度轴坡度陡峭。而且,表3中两因素交互作用显著值(P=0.028)。这说明麸皮浓度和时间的交互作用显著。
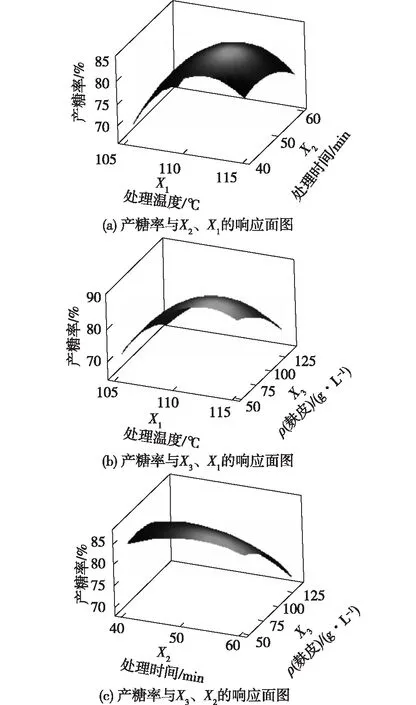
图2 响应面优化模型的响应面图Fig.2 Surface plots of RSM model
根据二次响应面回归方程的偏导数方程组求解,得到最高的预处理参数:处理温度112.37 ℃,处理时间50.30 min,麸皮质量浓度60 g/L,产糖最高为88.74%。另外,用Mintab 15特有的响应器做优化处理,结果见图3。寻优结果与回归方程求解结果一致。
2.4 麸皮酸水解液中单糖组分的含量
麸皮中碳水化合物的质量分数约为70.7%[4]。本研究中麸皮的元素组成为碳(39.28%±0.19%)、氮(2.47%±0.08%)。麸皮酸水解液中糖种类和含量见表5。麸皮酸水解液中总糖含量为78.51 g/L。经HPLC测定后含有5.10 g/L葡萄糖、4.65 g/L木糖、4.10 g/L阿拉伯糖、0.58 g/L甘露糖。低聚木糖的含量约为64.08 g/L。这与报道中麸皮中低聚木糖的含量一致[21]。
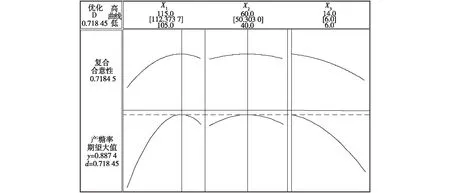
图3 相应优化器寻优结果Fig.3 Results of response optimizer

糖种类葡萄糖木糖阿拉伯糖甘露糖低聚木糖总糖ρ/(g·L-1)5.104.654.100.5864.0878.51
2.5 酸水解过程中糠醛、5-羟甲基糠醛、甲酸、乙酸含量的分析
糠醛和5-羟甲基糠醛是酸水解中产生的抑制剂。本研究中猛烈度为1.74~2.22。图4为酸处理麸皮过程中猛烈度与产生的糠醛和5-羟甲基糠醛浓度的关系。由图4可知:糠醛和5-羟甲基糠醛的浓度随着猛烈度的增加呈指数性升高。这是由于高温和长时间预处理使水解液中的部分单糖反应生成糠醛和5-羟甲基糠醛。这可能是导致产糖率下降的原因之一[22-23]。糠醛和5-羟甲基糠醛都是有毒物质,浓度过高会抑制微生物在水解液中生长。例如,当糠醛质量浓度大于244.22 mg/L时会明显抑制富油微生物深黄被孢霉的生长[24]。本研究结果表明在最优条件下(温度112.37 ℃,预处理时间50 min)的糠醛和5-羟甲基糠醛的质量浓度分别为14.4 mg/L和73.59 mg/L,远低于244.22 mg/L的水平。
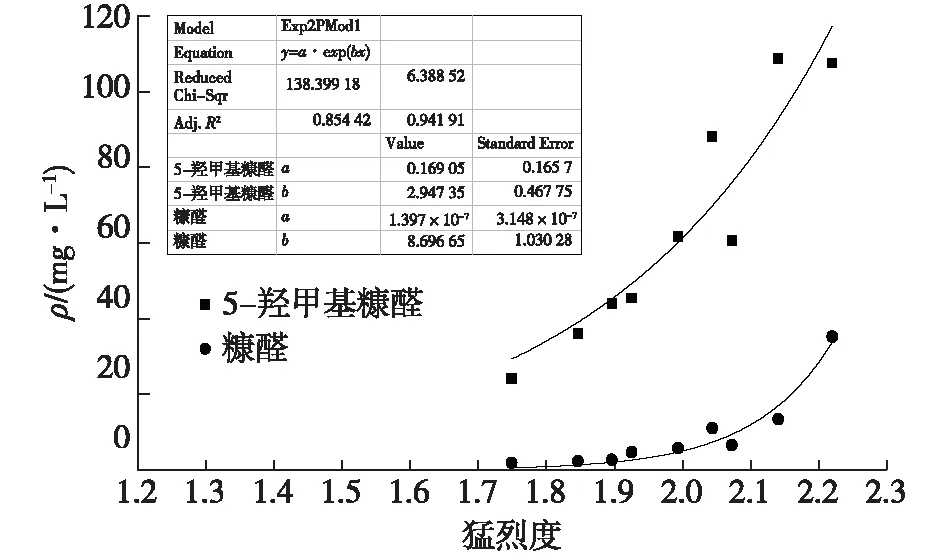
图4 猛烈度对水解液中糠醛和5-羟甲基糠醛生成影响Fig.4 Effects of severity on furfural and 5-hydroxymethyl furfural production in acid-pretreatment of wheat bran
稀酸水解液中产生的有机酸主要包括甲酸和乙酸,来源于糠醛和羟甲基糠醛的进一步裂解产生[25]。表6列出了酸水解液中甲酸和乙酸的含量。由表6可知,在最佳条件下,甲酸和乙酸的质量浓度分别为1.0 g/L和0.38 g/L。

表6 麸皮水解液中甲酸和乙酸含量
3 结论
通过单因素实验确定酸处理麸皮过程中处理温度、预处理时间和麸皮浓度是影响产糖率的主效应因素。进而通过响应面方法优化了酸处理麸皮的条件,建立了模型。通过参数的显著性水平分析了模型的有效性。该模型的产糖率最高时的条件:处理温度112.37 ℃、处理时间50 min、麸皮质量浓度60 g/L,在此条件下,产糖率最高可达到88.74%。但是麸皮水解液中单糖的组分相对较低(5.10 g/L葡萄糖、4.65 g/L木糖、4.10 g/L阿拉伯糖、0.58 g/L甘露糖),大部分为低聚木糖(64.08 g/L)。以猛烈度代表酸处理过程中的处理温度和处理时间。糠醛和5-羟甲基糠醛的产生与猛烈度之间存在指数性的关系。在最优酸水解条件下,糠醛和5-羟甲基糠醛的质量浓度分别为14.40 mg/L和73.59 mg/L。
