琼胶酶酶解2种紫菜及酶解成分分析
2018-07-24沈照鹏孙书娟朱常亮江晓路2
沈照鹏,孙书娟,崔 欣,朱常亮,孟 蕾,江晓路2,,
(1.中国海洋大学 医药学院,山东 青岛 266003;2.青岛海洋生物医药研究院,山东 青岛 266071;3.青岛市妇女儿童医院,山东 青岛 266034;4.中国海洋大学 食品科学与工程学院,山东 青岛 266003;5.青岛明月集团有限公司 海藻活性物质国家重点实验室,山东 青岛 266400)
紫菜属红藻类,在我国有10多个品种,多产于我国江苏、福建和辽宁沿海,在已知的70多种可供人类食用的海藻中,紫菜具有很高的营养价值[1]。紫菜也具有很好的药用功效,其性味甘、咸、寒,具有化痰软坚、清热利尿、补肾养心和健脾降压的作用,用于防治甲状腺肿大、慢性气管炎,预防动脉硬化及降低血压[2-3]。我国浙江以北和福建以南地区以条斑紫菜为主,浙江和福建一带以坛紫菜为主。紫菜的品种差异往往影响其营养成分含量。
琼胶是紫菜细胞壁多糖的主要成分之一,由于其黏度高、水溶性低,不易被吸收,因此在功能性应用方面受到很大限制。琼胶寡糖是琼胶多糖水解后得到的聚合度为2~10 的低聚糖,又称琼胶低聚糖,水溶性好、利于人体吸收,是一种新型的海洋功能性低聚糖。琼胶寡糖不仅具有功能性低聚糖的一般特性,还具有许多普通寡糖无法替代的生理功能特性,如对微生物的抑菌、增殖肠道益生菌、抗病毒、抗肿瘤和免疫增强、抗炎、抗氧化、吸湿保湿性以及美白作用等方面的生物活性[4-5]。目前,紫菜加工方法主要是简单的盐渍和蒸煮。这些方法都是对紫菜进行直接加工,技术含量及附加值低,所得产品的营养也不利于人体吸收。
基于以上紫菜及琼胶寡糖的营养价值和目前紫菜的加工工艺,笔者利用琼胶酶降解坛紫菜和条斑紫菜,拟确定出一种最优的酶解工艺,并通过对2种紫菜酶解前后总糖、还原糖、蛋白质、氨基酸态氮、氨基酸、固形物以及灰分等成分的测定与比较,为紫菜的进一步高值化加工和生产提供理论依据。
1 材料与方法
1.1 材料与试剂
条斑紫菜和坛紫菜购于福建申石兰食品有限公司;琼胶降解酶由中国海洋大学食品科学与工程学院应用微生物实验室提供,购自Sigma公司,货号A6306,用pH 6.0磷酸缓冲液稀释至5 U/mL,于4 ℃保存,备用;其他试剂均为分析纯。
1.2 仪器与设备
HH·B11420型电热恒温培养箱,山东潍坊医疗器械厂;HR-8801M型微波炉,青岛海尔微波制品有限公司;DHG-9070A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;HL-26型海菱多功能食品粉碎机,上海海菱电器有限公司;S-433D型全自动氨基酸分析仪,德国Sykam公司。
1.3 实验方法
1.3.1 设计紫菜酶解液制备的正交试验
根据酶解紫菜原液的现有工艺参数与前人实验结果以及紫菜酶解的特性[6],确定因子和水平如表1所示。

表1 紫菜酶解因子水平
按表1配制不同浓度的紫菜匀浆液,浸泡30 min,煮沸后冷却至相应温度,保温30 min,加酶液,进行酶解反应。分别在2、2.5和3 h后煮沸,终止酶解反应。冷却后离心,取上清液,测其还原糖吸光值。
1.3.2 紫菜酶解液还原糖的测定
根据二硝基水杨酸(DNS)法测定还原糖吸光值,绘制葡萄糖标准曲线[7-9]。在具塞比色管中加入0.5 mL样品液,再加入1 mL DNS,沸水浴5 min,迅速冷却后,用蒸馏水定容到25 mL,于520 nm下测定吸光值。
1.3.3 紫菜原液和酶解液营养成分的测定
根据1.3.1节结果得紫菜的最优酶解条件并制备2种紫菜酶解液,同时用蒸馏水代替酶配制2种紫菜原液,对各营养成分含量进行测定并作比较。
总糖测定采用苯酚-硫酸法,根据文献[10-11]绘制总糖标准曲线。将紫菜原液或酶解液稀释100倍后,取1 mL稀释液于试管中,加0.3 mL质量分数为6%的苯酚、1.5 mL浓硫酸,静置20 min,在波长490 nm下测吸光值。空白用1 mL蒸馏水代替。
还原糖测定采用DNS法,蛋白质测定采用凯氏定氮法[12],氨基酸态氮测定采用甲醛值法[13],氨基酸测定采用氨基酸自动分析仪,可溶性固形物测定参照文献[14]进行,灰分测定参照文献[15]进行。
1.3.4 紫菜寡糖寡糖分子量分布的测定
用3倍的乙醇将海藻汁中的寡糖沉淀,离心去除上清液,用蒸馏水溶解,离心去沉淀,上清液用电喷雾电离质谱仪(TSQ LC/MS/MS,Finnegan公司)来测定每种寡糖的分子量。电喷雾电离质谱(ESI-MS)采用阴离子模式。样品于甲醇-H2O(体积比为1∶ 1)(10 pmol/mL) 溶液中溶解,用注射泵以5 μL/min的速度注入。扫描范围100~1 100,毛细管温度250 ℃。
2 结果与讨论
2.1 紫菜酶解液制备的正交试验
紫菜酶解正交试验结果如表2所示。由表2可知,四因素的影响水平从大到小的顺序为C、A、B、D,即酶与底物配比和反应时间对紫菜酶解效果的影响最大,其次是温度和料液比。因此,最佳酶解工艺组合为A3B3C3D1,即酶解3 h、38 ℃、酶与底物配比为4.0∶ 2(mL/g)、料液比为1∶ 30。

表2 紫菜酶解正交试验结果
2.2 紫菜原液和酶解液营养成分的测定
2.2.1 总糖含量
2种紫菜酶解前后总糖质量分数变化如表3所示。由表3可知:坛紫菜、条斑紫菜酶解液总糖含量均有所增加,尤以坛紫菜更显著,每克紫菜粉增加43.68 mg总糖,表明琼胶酶的加入可以有效提高总糖含量。可能因为:一方面,紫菜的组织结构经煮沸破坏后,再经过充分的酶解作用,包含各种糖类的营养物质更好地溶出[16];另一方面,作为紫菜细胞壁主要成分,较难溶的琼胶在琼胶酶的作用下降解为易溶的、具有还原性的单糖或双糖等琼胶寡糖。通过比较可知,酶解前后的总糖含量均是坛紫菜大于条斑紫菜。

表3 2种紫菜酶解前后总糖含量(x±s,n≥3)
注:以紫菜粉计算。
2.2.2 还原糖含量
2种紫菜酶解前后还原糖含量变化如表4所示。由表4可知:酶解前紫菜细胞中的糖类物质主要以多糖的形式(主要是琼胶)存在,故还原糖含量很少(只有0.383 mg/g),经琼胶酶降解后,还原糖含量显著增加,每克坛紫菜和条斑紫菜的还原糖增加量分别为14.871和13.561 mg。这可能是因为紫菜细胞中的琼胶被酶降解为单糖或双糖等具有还原性的寡糖。琼胶寡糖的特殊生物活性及生理功能[5]大大提高了紫菜酶解液的营养价值。2种紫菜在酶解前的还原糖含量差别不大,酶解后坛紫菜稍大于条斑紫菜。

表4 2种紫菜酶解前后还原糖含量(x±s,n≥3)
注:以紫菜粉计算。
2.2.3 蛋白质含量
2种紫菜酶解前后蛋白质含量变化如表5所示。由表5可知,紫菜酶解前后蛋白质含量基本不变。这是因为酶具有专一性,琼胶酶只能降解琼胶,对蛋白质不起作用。紫菜的细胞结构经酶解破坏,胞内蛋白质等营养物质的溶出可能会造成蛋白质含量的增加,这从条斑紫菜酶解前后蛋白质的含量测定结果可以看出。比较2种紫菜可知,条斑紫菜酶解前后蛋白质含量均比坛紫菜稍大。
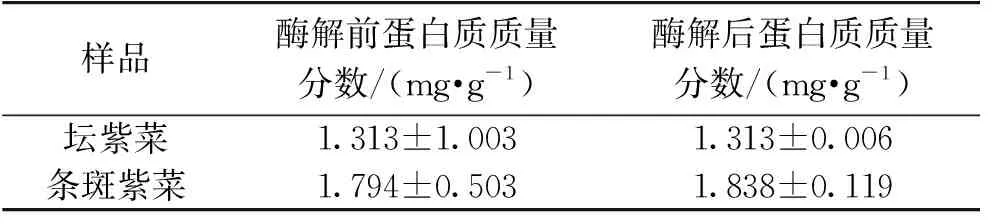
表5 2种紫菜酶解前后蛋白质含量(x±s,n≥3)
注:以紫菜粉计算。
2.2.4 氨基酸态氮含量
酶解作用能够破坏紫菜的细胞结构,使细胞内的营养物质溶出。2种紫菜酶解前后氨基酸态氨含量如表6所示。由表6可知,经琼胶酶降解后,2种紫菜氨基酸态氮的含量均明显提高,尤以条斑紫菜更显著,每克紫菜粉增加2.176 mg氨基酸态氨。细胞内氨基酸的溶出,使得紫菜汁呈味物质增加,大大提高了其鲜味和营养价值。条斑紫菜氨基态氮含量的增加量约是坛紫菜的3倍。

表6 2种紫菜酶解前后氨基酸态氮含量(x±s,n≥3)
注:以紫菜粉计算。
2.2.5 氨基酸含量
紫菜富含游离氨基酸,食用时极易扩散,可与口腔内多种味觉受体作用,故能让人感到食物的美味。研究认为,紫菜中氨基酸含量越高,包含的呈味氨基酸越多,味道就越浓厚;且紫菜等级与所含呈味氨基酸的含量多少呈平行关系[17-18]。表7为2种紫菜酶解前后氨基酸组成和含量的变化。由表7可知:坛紫菜与条斑紫菜在蛋白质的氨基酸组成和含量上均有明显的差异。条斑紫菜液含17种氨基酸较坛紫菜(14种)丰富,且独有必需氨基酸甲硫氨酸和色氨酸。虽然条斑紫菜原液和酶解液中所含氨基酸总量(862、1 005 mg/L)约为坛紫菜(441、439 mg/L)的2倍,但必需氨基酸在其总氨基酸中相对比例比坛紫菜中的低。酶解后,条斑紫菜液中氨基酸含量比原液高出16.6%,其原因可能为酶解作用游离出与糖结合的部分氨基酸,使其氨基酸总量有所增加。呈味氨基酸为2种紫菜总氨基酸的主要成分,分别占总氨基酸含量的66.9%和77.6%,其中鲜味氨基酸(Glu和Asp)占28.8%和22.3%;甜味氨基酸(Ser、Gly、Ala和Pro)占38.1%和55.3%;条斑紫菜呈味氨基酸含量明显高于坛紫菜,尤其甜味氨基酸所占比例较高,而坛紫菜中鲜味氨基酸略高于条斑紫菜。酶解后,坛紫菜中氨基酸总量变化不大,条斑紫菜液中氨基酸含量比原液高出16.6%,其原因可能为酶解作用游离出与糖结合的部分氨基酸,使其氨基酸总量有所增加。酶解后,坛紫菜中甜味氨基酸含量增高了24.36%,对提高紫菜液的风味性具有增强作用。而坛紫菜酶解液中氨基酸总量略微减少,可能因为酶解不够充分。
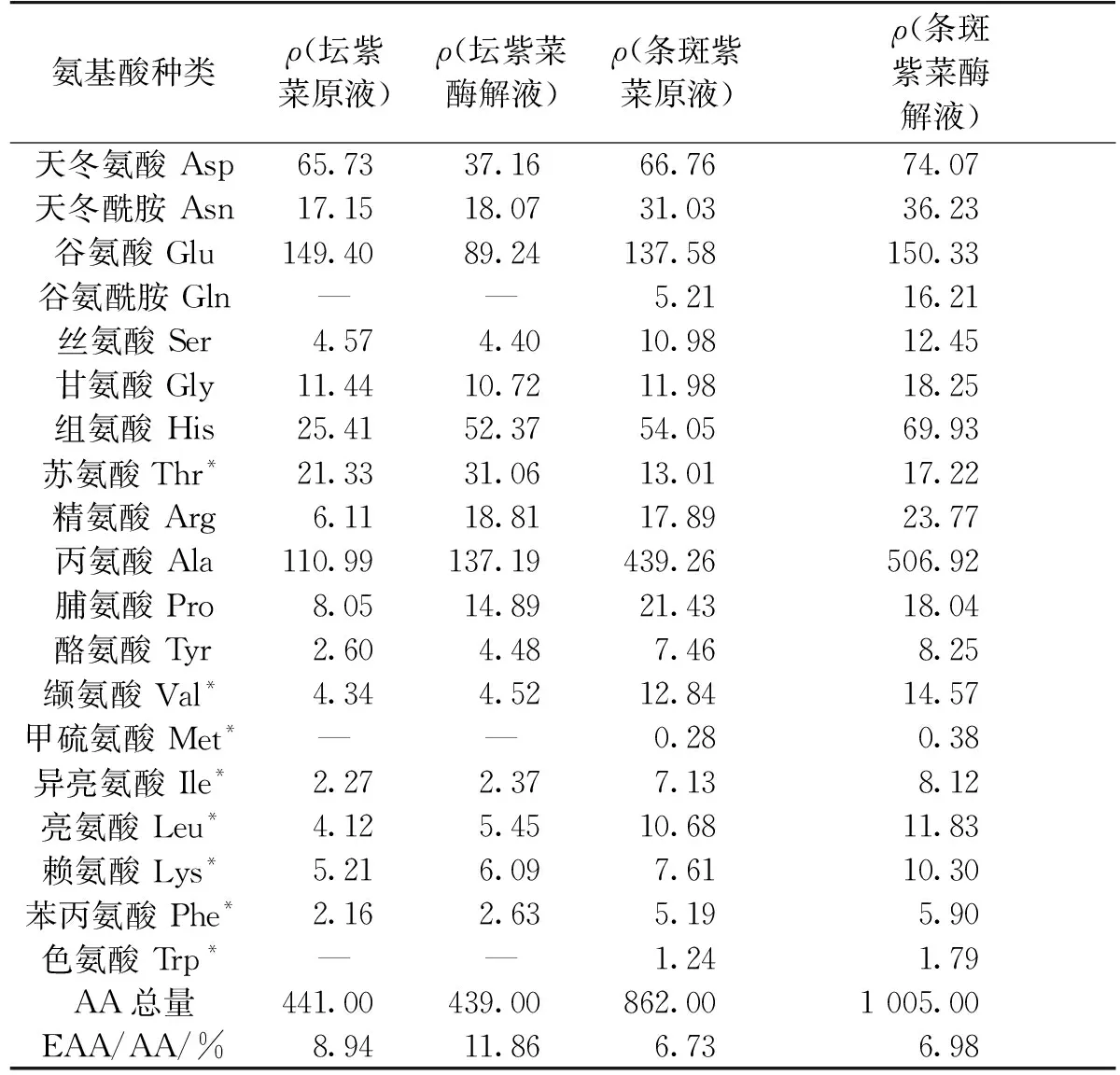
表7 2种紫菜酶解前后氨基酸组成和含量
注:*所标为人体必需的氨基酸。
2.2.6 可溶性固形物含量
2种紫菜酶解前后可溶性固形物含量变化如表8所示。由表8可知:2种紫菜酶解前后可溶性固形物的含量均显著增加,均约增至酶解前的1.5倍。由总糖、还原糖含量测定结果可知,酶解液中两者含量的增加可能提高了可溶性固形物的含量。此外,酶解作用使营养物质更好地溶出也是其含量增加的重要原因。坛紫菜酶解前后可溶性固形物的含量均比条斑紫菜稍大。

表8 2种紫菜酶解前后可溶性固形物含量(x±s,n≥3)
注:以紫菜粉计算。

图1 2种紫菜寡糖分子量分布Fig.1 Molecular weight distribution of two kinds of Porphyra
2.2.7 灰分含量
2种紫菜酶解前后灰分含量如表9所示。
表92种紫菜酶解前后灰分含量(x±s,n≥3)
Table9ResultsofashcontentaroundtwoPorphyrahydrolysis(x±s,n≥3)

样品酶解前灰分质量分数/(mg·g-1)酶解后灰分质量分数/(mg·g-1)坛紫菜5.28±0.375.28±0.01条斑紫菜3.04±0.063.04±0.71
注:以紫菜粉计算。
由表9可知:酶解前后紫菜液中的灰分含量几乎不变,这是因为琼胶降解酶只降解琼胶,且降解不产生无机成分。比较2种紫菜可知:酶解前后坛紫菜灰分含量分别为条斑紫菜的1.8倍、1.7倍,可能是因为2种紫菜品种和产地不一致,导致其细胞结构、营养成分不同。
2.3 紫菜寡糖分子量分布
紫菜寡糖分子量分布如图1所示。由图1可知,在琼胶裂解酶的作用下,紫菜中富含的大分子琼胶充分裂解生成了分子大小不一的众多褐藻寡糖。经阴离子电喷雾电离质谱测得酶解所得的紫菜寡糖的分子量分布均为500~1 000,聚合度为3~5,以三糖为主。紫菜多糖通过琼胶酶降解后获得的寡糖产物组成上以半乳糖为主,含硫酸基,不同聚合度寡糖组分间单糖组成相差不大[19]。现有研究表明,紫菜寡糖具有抗氧化、免疫调节和抗肿瘤等活性,这些活性与寡糖聚合度之间存在密切关系,聚合度在2~6时活性较高[20-22]。据此可知,通过本文所述工艺酶解后所得的紫菜寡糖处于高生理活性寡糖聚合度范围,具有良好的生理活性,增添了紫菜酶解汁的功能性。
综上,琼胶酶只专一作用于琼胶,且产物为具有还原性的琼胶寡糖。虽然酶解作用可使紫菜细胞内的营养物质溶出,其他物质含量可能有所增加(氨基酸态氮、氨基酸和可溶性固形),但是紫菜酶解前后总糖及还原糖的含量变化才是评价琼胶酶作用效果的主要指标。同时,琼胶寡糖具有其他普通低聚糖所没有的特性,如不被消化酶分解、不会被肠内细菌分解且无热量产生等,故可用作高甜度甜味剂的充填剂及分散剂,用于饮料、面包、调味品及面条等低热量食品的生产[23-25]。本研究得到了含有琼胶寡糖混合物的酶解液,但对琼胶寡糖的具体组成及性质还有待进一步研究。
此外,酶解作用不仅能够大大降低紫菜汁的黏度、提高其营养价值,而且使得紫菜汁具有甘鲜味浓的良好口感[16],使其既可作为高营养的即食食品饮用,也可应用于紫菜制品,如紫菜酱油、紫菜调味品等的生产。如此,不仅拓宽了紫菜产品的开发利用空间,也必定会得到较高的收益。
3 结论
通过正交试验确定了紫菜酶解的最佳工艺:料液比为1∶ 30 (V/V),酶液与底物量比为4.0∶ 2(mL/g),温度38 ℃,反应时间3 h。相比较盐渍和蒸煮,该工艺可行,重复性较好。对坛紫菜和条斑紫菜酶解液、原液的成分进行测定与比较,结果表明,琼胶酶可有效降解坛紫菜和条斑紫菜,并能显著提高总糖、还原糖、氨基酸态氮、氨基酸及可溶性固形物的含量,其中总糖和还原糖的增加量最为突出,每克紫菜粉分别增加43.68 mg总糖和14.871 mg还原糖;蛋白质、灰分在酶解前后含量变化不大。综合比较可知,坛紫菜被琼胶酶的降解效果优于条斑紫菜,更适宜进一步高值化利用。
