铁氰化铜/Na fi on/g-C3N4复合修饰电极的制备及电催化检测水合肼
2018-07-24汪万强崔莉娟刘素芹
汪万强,崔莉娟,牛 顿,冉 茜,刘素芹*
(湖北文理学院食品科学技术学院·化学工程学院,低维光电材料与器件湖北省重点实验室,湖北 襄阳 441053)
水合肼,又称水合联氨,具有强碱性和吸湿性。它常作精细化工原料,用于药物、食品、农药等的生产。同时,作为神经毒素,它对人的身体健康有一定的危害性[1-2]。因此,建立一种高效、快速、灵敏的水合肼残留量检测方法势在必行。目前,检测水合肼的方法主要有分光光度法[3-5]、荧光探针[6-8]色谱法[9-11]和电化学法[12-16]。
普鲁士蓝的过渡金属类似物是一种无机电活性材料,被广泛应用于电催化、化学修饰电极、生物传感器、分子识别等领域[17-18]。铁氰化铜(copper hexacyanoferrate,CuHCF)作为代表物,在各个领域尤其是电化学传感及电催化领域得到了广泛应用[19-21]。据文献报道,NiHCF/CCE[22]、AuS/CuHCF[23]、NBHCFCPE[24]、NiHCF/AuNPs[25]、ITO/G-M/CuHCF-M[26]等化学修饰电极都被用于检测水合肼,并且取得了较好结果。类石墨相氮化碳(g-C3N4)具有二维堆积层状结构,具有硬度高、密度低、化学稳定性高、耐磨性强、生物兼容性好等优点。在膜材料、催化剂及催化剂载体等领域具有非常广泛的应用前景[27-29]。因此,本实验利用CuHCF和g-C3N4的优异催化性能,制备了CuHCF/Nafion/g-C3N4纳米复合修饰电极,并用于电催化氧化检测水合肼。与文献报道的基于铁氰化物、其他纳米材料复合铁氰化物等传感器相比,此修饰电极检测水合肼的结果大致相当,具有检测限低、线性范围较宽等特点。另外,该修饰电极可用于生活饮用水及其水源中的水合肼浓度的定量检测,与标准方法对照,结果令人满意。
1 材料与方法
1.1 材料与试剂
三聚氰胺、硝酸铜、铁氰化钾、硝酸、水合肼上海凌峰化学试剂公司。Nafion(5%) 美国Sigma-Aldrich公司。实验用试剂均为分析纯,用水为二次去离子水。
1.2 仪器与设备
RST5000电化学工作站 苏州瑞思特仪器有限公司;三电极体系:修饰电极作为工作电极(玻碳电极),饱和甘汞电极作为参比电极,铂电极作为辅助电极;D8 ADVANCE X射线衍射仪 德国Bruker公司;FESEM S-4800场发射扫描电子显微镜 日本Hitachi公司;ASAP2020比表面积检测仪 美国Micromeritics公司。
1.3 方法
1.3.1 g-C3N4的制备
根据文献[30]制备g-C3N4。称取大约5.00 g三聚氰胺于坩埚中,然后放入马弗炉中,以3 ℃/min的升温速率升至550 ℃,保温2 h,然后冷却至室温。将得到的黄色块状固体置于玛瑙研钵中研磨,得到的黄色粉末为g-C3N4。称取0.1 g上述制得的粉末g-C3N4于烧杯中,加入200 mL水,置于超声波清洗机中超声12 h。将得到的悬浊液离心分离,然后于80 ℃干燥10 h,即得g-C3N4。
1.3.2 CuHCF的制备
称取1.00 g铁氰化钾溶于90 mL去离子水中,称取0.50 g硝酸铜溶于10 mL去离子水中。在磁力搅拌器上,向CuHCF溶液中缓慢滴加硝酸铜溶液,溶液由黄色变为黄绿色悬浊液,充分搅拌,调节pH 6.5~7.5之间。将悬浊液放置超声仪中0.5 h,然后静置陈化8 h,离心,洗涤,干燥得CuHCF样品。
1.3.3 CuHCF/Naf i on/g-C3N4修饰玻碳电极的制备
用粒径为0.3 μm和0.05 μm的Al2O3乳液将裸玻碳电极(直径2 mm)抛光至镜面,每次抛光后用去离子水超声清洗3 次,每次5 min。
称取10 mg CuHCF粉末和0.2 mg g-C3N4粉末加入980 μL乙醇中,再加入20 μL Nafion的乙醇溶液,超声分散,待分散完全后,用滴涂法滴涂到处理好的电极上,风干备用,记为CuHCF/Nafion/g-C3N4/GCE。作为对照,按照相同的方法分别制备了CuHCF/GCE、Nafion/GCE、g-C3N4/GCE、CuHCF/g-C3N4/GCE。
2 结果与分析
2.1 扫描电子显微镜表征
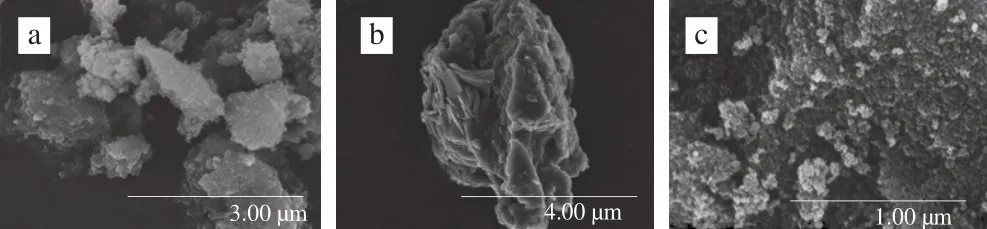
图1 CuHCF(a)、g-C3N4(b)和CuHCF/g-C3N4/Na fi on复合物(c)的扫描电子显微镜图Fig.1 SEM images of CuHCF (a), g-C3N4 (b) and CuHCF/Na fi on/g-C3N4 nanocomposites (c)
从图1a可以看出,CuHCF晶体的颗粒较小,但发生了一定程度的聚集。图1b中合成的g-C3N4为较小尺寸的纳米片的聚集结构。每个薄片的厚度小于50 nm,宽度约为几百纳米。由图1c可以看出,当两者与Naf i on复合后,复合物的颗粒较小,平均颗粒直径小于100 nm,颗粒分散均匀。
从图2a可看出,所合成的CuHCF结晶度高,具有普鲁士蓝面心立方结构(ICDD PDF card no. 01-086-0513)。图2b中在衍射角2θ为27.4°处的特征峰对应于g-C3N4(PDF no.87-1526)卡片中的(002)晶面。
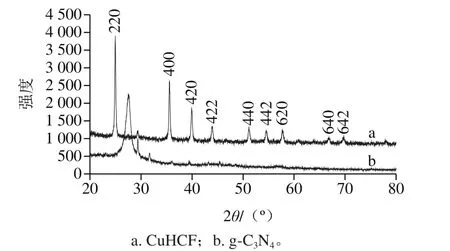
图2 CuHCF和g-C3N4的XRD谱图Fig.2 XRD patterns of CuHCF and g-C3N4
2.2 电极的电化学行为
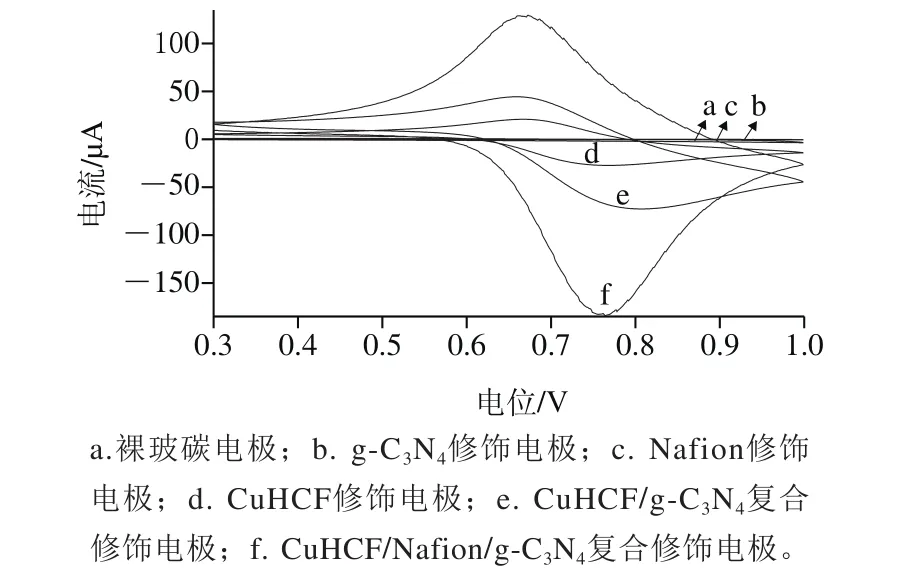
图3 不同修饰电极的循环伏安图Fig.3 Cyclic voltammograms of modi fi ed glassy carbon electrode in 0.5 mol/L KCl with a scan rate of 50 mV/s
利用循环伏安法在扫描速率50 mV/s、0.3~1.0 V的电位范围下扫描0.5 mol/L KCl溶液,如图3所示,裸玻碳电极、Nafion修饰电极和g-C3N4修饰电极几乎没有氧化还原峰,而CuHCF修饰电极、CuHCF/g-C3N4复合修饰电极、CuHCF/Naf i on/g-C3N4复合修饰电极有明显的氧化还原峰。其中明显可以看到CuHCF/Naf i on/g-C3N4复合修饰电极的氧化还原峰电流最大,电极响应是最好的。
2.3 实验条件的优化
如图4A所示,用循环伏安法,在0.3~1.0 V的电位范围内研究了0.1 mol/L不同支持电解质的影响,在KCl溶液中的峰电流最大,峰形最好。进一步考察支持电解质阴阳离子的选择。从图4B可以看出,在KCl溶液中的峰电流最大,峰形最好;从图4C可以看出,考察0.1 mol/L不同氯盐的影响,也得到了同样的结果。综上所述,KCl溶液是支持电解质的最好选择。
支持电解质的浓度大小也是一个重要的影响因素,CuHCF/Nafion/g-C3N4/GCE修饰电极在不同浓度(0.05、0.1、0.2、0.5、1.0 mol/L)的KCl溶液中的循环伏安图见图4D。随着KCl溶液浓度逐渐增加,峰形逐渐变好,峰电流逐渐增加,当KCl溶液浓度为0.5 mol/L时,峰电流达到最大,继续增加其浓度,峰电流反而减小。因此,选择0.5 mol/L KCl溶液为支持电解质。
如图4E所示,随着扫描速率的增大,该修饰电极的氧化还原峰电流不断增大。线性方程分别为:Ipa/μA=-169.5-1.03 6v,R=0.997 5;Ipc/μA=120.4+0.7947 v,R=0.992 8。说明该修饰电极的氧化还原过程受表面吸附控制。
考察CuHCF/Nafion/g-C3N4/GCE修饰电极在pH值为4.0~11.0(以0.5 mol/L KCl溶液为基础溶液,分别加入HCl和KOH溶液调节至所需pH值)之间的电化学行为,由图4F可以看出,pH 7.0~10.0之间峰电流和峰电位几乎不变,当pH值低于7.0和pH值高于10.0时,峰电流减小,峰电位发生偏移,且峰形变差,当pH 4.0时峰电流几乎消失,说明峰电流是会随着pH值的改变而改变的。从图4F可以看出该电极在中性和弱碱性环境中较稳定,在pH 7.0的时候最稳定,氧化峰和还原峰最为对称,所以实验应该选择pH 7.0的环境中进行。
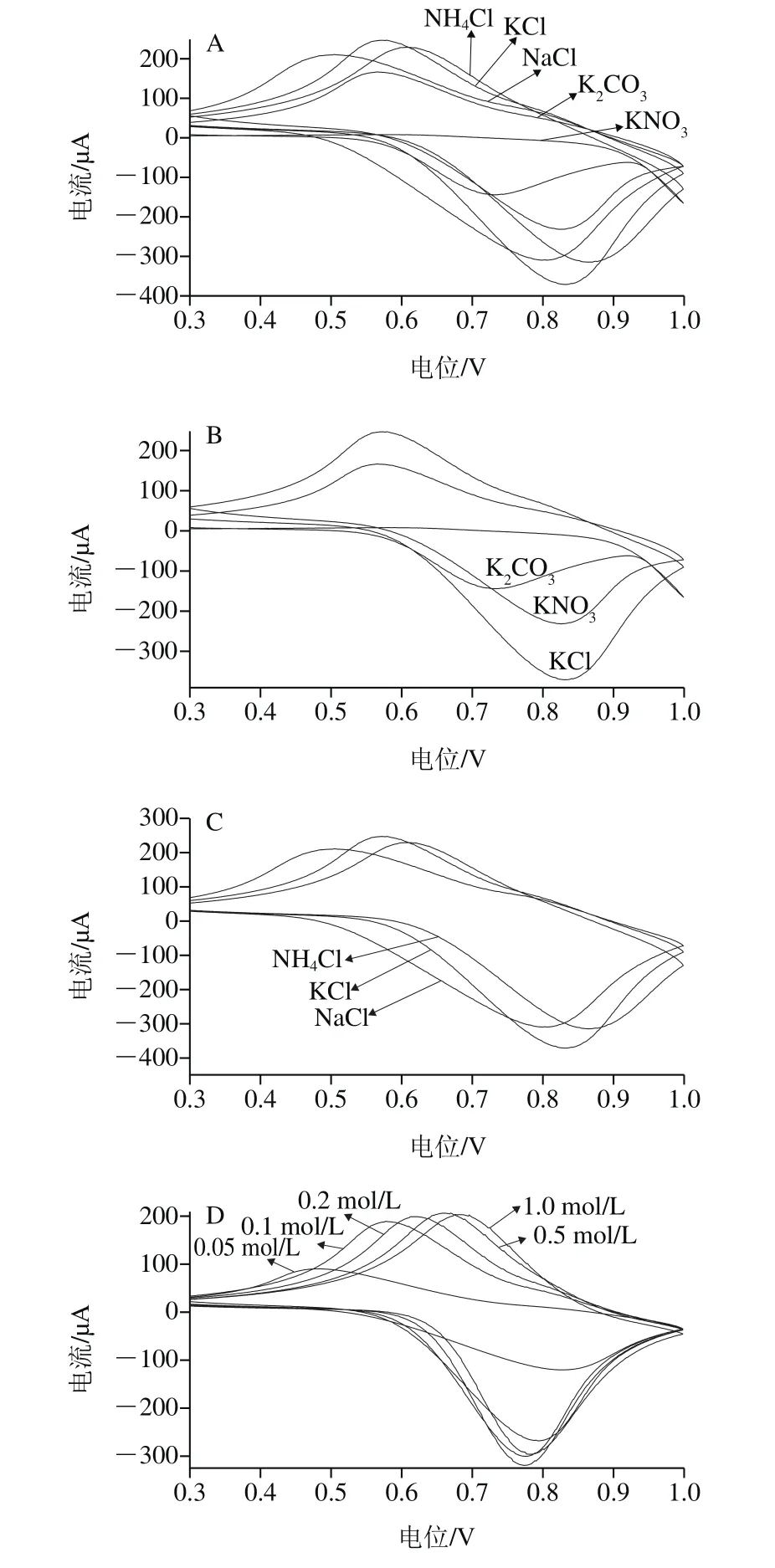
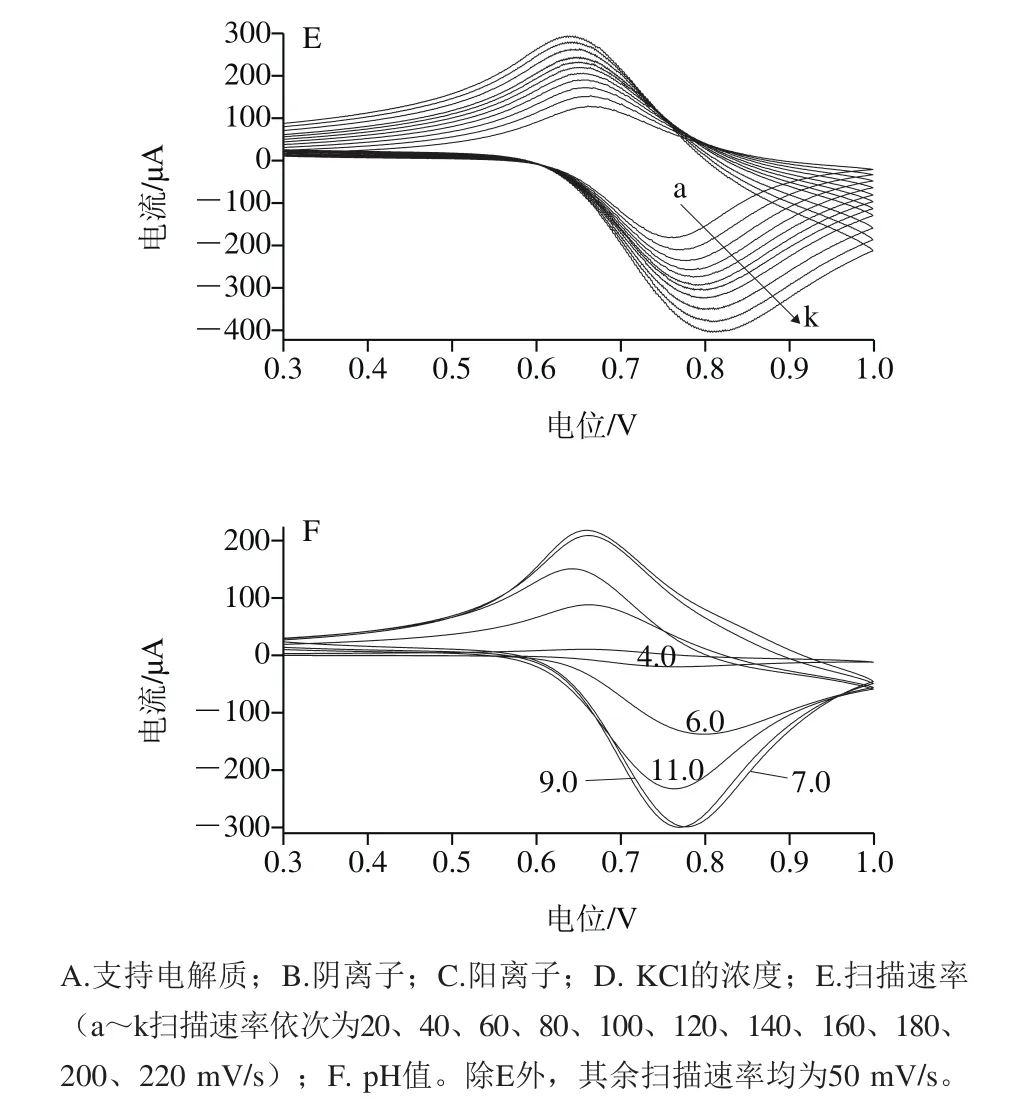
图4 实验条件的优化Fig.4 Optimization of experimental conditions
2.4 电催化检测水合肼
2.4.1 水合肼在不同电极上的电化学响应
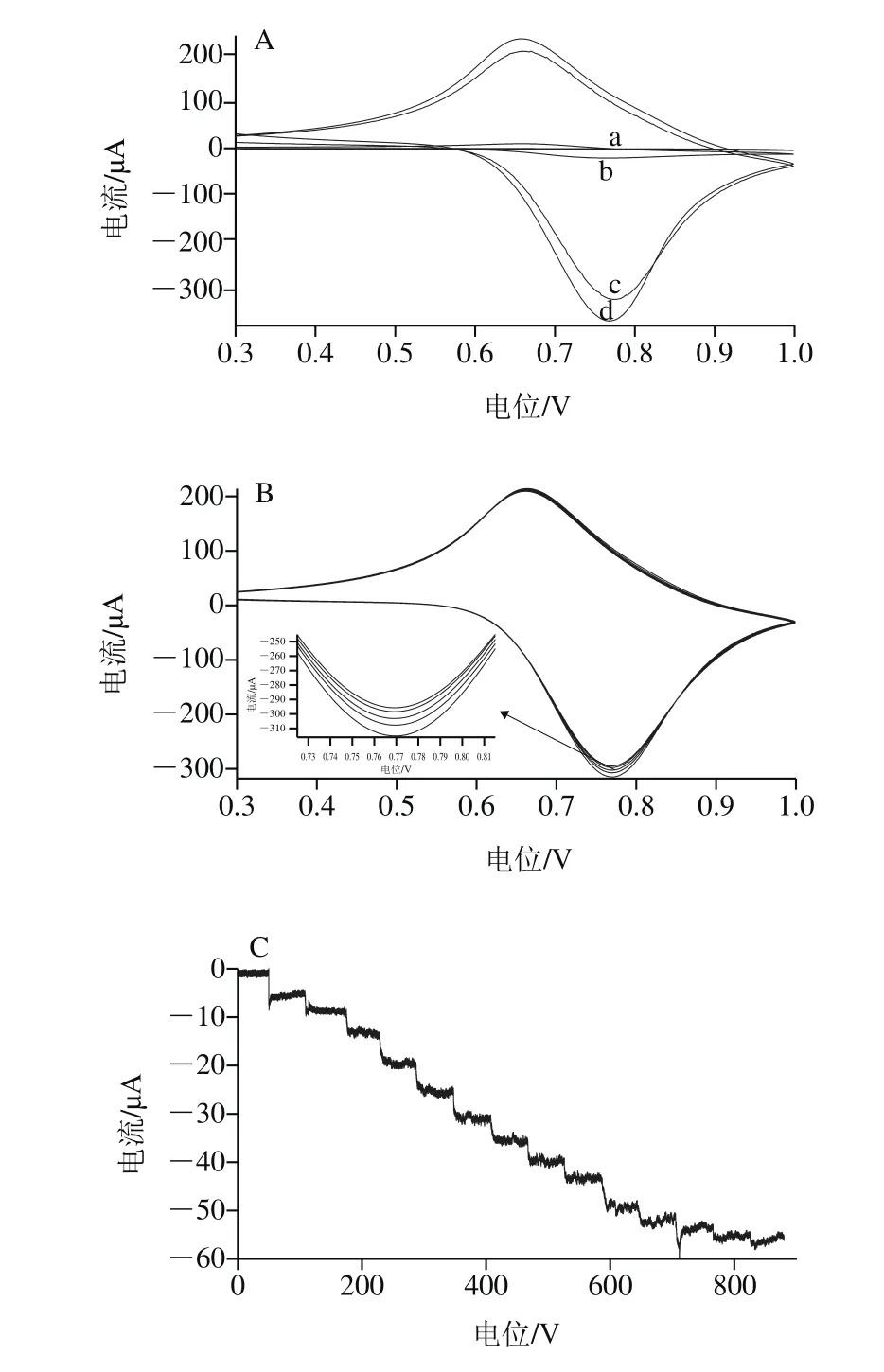
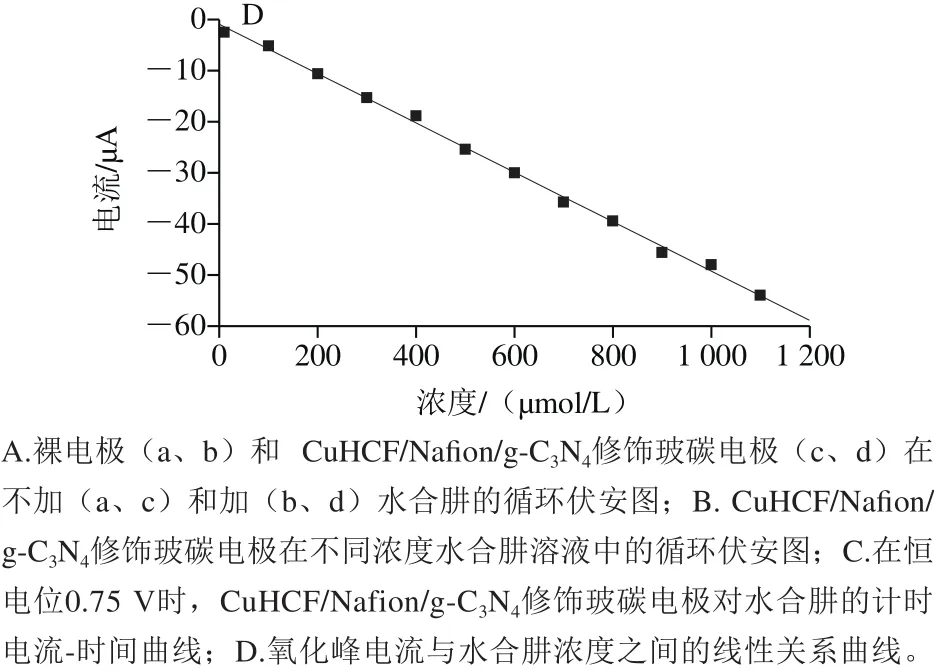
图5 电催化检测水合肼Fig.5 Electrocatalytic detection of hydrazine hydrate
如图5A所示,a、b曲线为裸玻碳电极在0.5 mol/L KCl溶液中加入50 μmol/L水合肼前后的循环伏安图。加入水合肼后,修饰电极的还原峰电流和氧化峰电流均明显增加。c、d曲线为CuHCF/Nafion/g-C3N4复合修饰玻碳电极在0.5 mol/L KCl溶液中加入50 μmol/L水合肼前后的循环伏安图。其催化活性比裸玻碳电极要高得多,氧化-还原电流得到数十倍的放大,说明g-C3N4和Nafion的掺入提高了CuHCF对水合肼的电催化活性。根据BET(Brunauer-Emmett-Teller)实验,其中CuHCF的比表面积为9.36 m2/g,而CuHCF/Naf i on/g-C3N4为16.02 m2/g,近两倍于前者,因此g-C3N4和Nafion的掺入增大了CuHCF的比表面积,从而增加了活性位点,增强了电子迁移的速率。
2.4.2 线性范围与检测限测定结果
用循环伏安法研究CuHCF/Nafion/g-C3N4复合修饰电极对水合肼的电催化效果,扫描速率为50 mV/s,结果见图5B。随着水合肼浓度的增加,氧化峰和还原峰电流同时增加,还原峰电流的增加比氧化峰电流的增加更加明显,且阴极峰电流与阳极峰电流之比约为1.5∶1。说明复合电极对水合肼的催化效果明显。
CuHCF/Nafion/g-C3N4复合修饰电极在加入不同量水合肼时的动力学计时安培图,测定电位控制为0.75 V。由图5可见,随着水合肼的加入,电流以阶梯状逐渐增加,符合稳态电流的特征,响应时间小于5 s。在优化条件下,电流与水合肼浓度在10~1 100 μmol/L范围内时,其氧化峰电流与浓度具有良好的线性关系,其线性方程为:Ipa/μA=-1.055-0.048 14 C,相关系数R为0.998 8,检测限为1 μmol/L。与文献报道的基于铁氰化物、其他纳米材料复合铁氰化物等传感器相比(表1),此修饰电极检测水合肼的结果大致相当,具有检测限低,线性范围较宽等特点。注:*.NiHCF/CCE指铁氰化镍纳米颗粒修饰碳陶瓷电极;AuS/CuHCF 指自组装3-巯基吡咯和铁氰化铜修饰金电极;NBHCF-CPE指尼罗蓝-铁氰化物修饰碳糊电极;CPE/NiHCF/AuNP指铁氰化镍/金纳米复合物修饰碳糊电极;ITO/G-M/CuHCF-M石墨烯/Au纳米颗粒掺杂的铁氰化铜多层膜修饰铟锡氧化物电极。
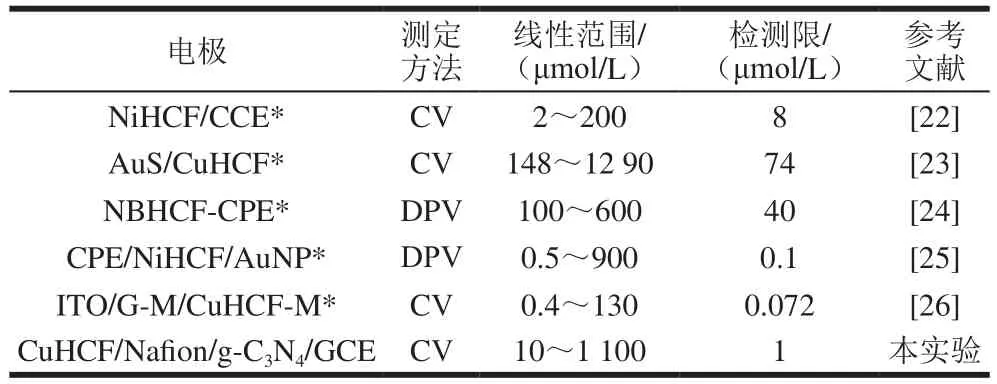
表1 不同修饰电极测定水合肼时的分析性能比较Table1 Comparison of electroanalytical data of various chemically modif i ed electrodes towards hydrazine detection
2.5 选择性、重复性和稳定性实验
100 倍浓度的各物质干扰结果见图6,这些干扰物质对测定均无明显影响,说明本方法具有较好的选择性。
在优化条件下,用CuHCF/Nafion/g-C3N4复合修饰电极对50 μmol/L的水合肼平行测定10 次,相对标准偏差(relative standard deviation,RSD)为2.2%。对上述溶液连续扫描20 圈,峰电流的RSD为2.5%。用同样的方法分别制备5 支CuHCF/Nafion/g-C3N4复合修饰电极,测定同一浓度的水合肼,RSD为4.5%。这说明该修饰电极具有较好的重复性。将CuHCF/Nafion/g-C3N4复合修饰电极保存在干燥的空气中,用该电极每天测定浓度为50 μmol/L的水合肼1 次,然后在空白缓冲溶液中经循环伏安扫描将峰扫平,再放入空气中,10 d后水合肼的峰电流仅下降3.3%,这说明该修饰电极使用寿命较长。
实验还采取了自来水、汉江水和隆中地下水3 种样品各3 份,分别加入水合肼,使其浓度分别为0.05、0.1、0.5 mol/L。移取5 μL不同浓度的水合肼溶液于5 mL 0.5 mol/L KCl溶液中,用CuHCF/Nafion/g-C3N4复合修饰电极检测,进行回收实验,每个样品测5 次取平均值,其回收率介于97.2%~104.7%之间,说明本方法能满足常规分析要求,可用于实际样品的检测。并与对二甲基苯甲醛直接分光光度法测定生活饮用水及其水源中的水合肼标准方法作对照,结果见表2。
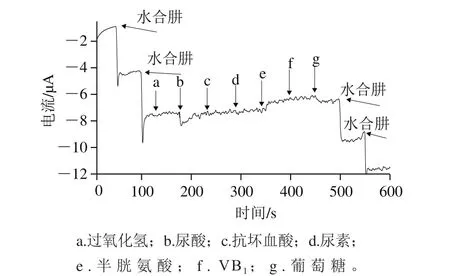
图6 CuHCF/Na fi on/g-C3N4修饰玻碳电极检测水合肼时对干扰物质的响应Fig.6 Dynamic amperometric responses of different interfering substances at CuHCF/Na fi on/g-C3N4/GCE
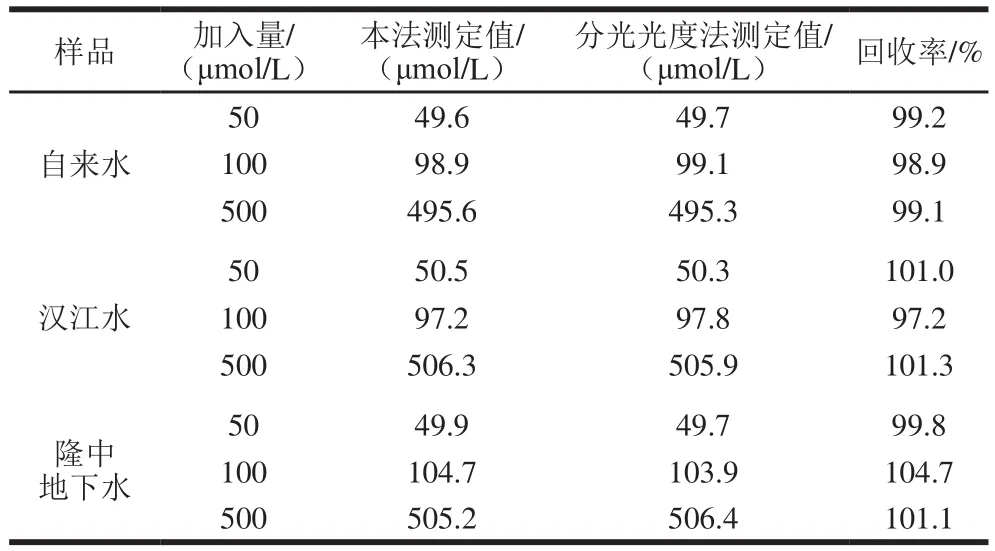
表2 饮用水中水合肼的测定(n=5)Table2 Determination of hydrazine hydrate in real water samples (n= 5)
3 结 论
本实验将CuHCF、g-C3N4和Naf i on的分散物修饰到玻碳电极表面构建了CuHCF/Nafion/g-C3N4/GCE修饰电极,并用于水合肼的电化学定量分析。该法线性范围宽、灵敏度高、仪器设备简单及操作简便,可成功用于生活饮用水及其水源中的水合肼浓度的定量检测,其结果与标准方法相当吻合。另外,该电极的选择性、稳定性良好,结果令人满意。
