啤酒高浓酿造中氨基酸对酵母发酵性能和啤酒色值的影响
2018-07-24王莹钰蔡天娇雷宏杰
任 璐,王莹钰,杨 沫,蔡天娇,雷宏杰*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
啤酒高浓酿造技术主要应用于低浓度啤酒和高辅料啤酒的生产,现已成为一项成熟的工艺并被广泛应用于淡爽型啤酒酿造中[1]。国内外知名啤酒酿造企业如青岛啤酒、百威啤酒等都已成功运用了啤酒高浓酿造技术,并充分发挥了该技术所带来的优势:在投资和运行成本较低的情况下,增加产量50%~100%[2-3]。然而,麦汁浓度过高会带来很多生产上的问题,如发酵时间的延长、麦汁发酵度和酵母絮凝性的降低[4-5]、啤酒风味和泡沫稳定性变差等[6-7],主要原因是高浓麦汁导致酵母细胞需要承受更大的环境胁迫,如高渗透压和高乙醇毒性,均对酵母细胞产生一定的毒害作用[8]。而且,发酵后期营养物质匮乏,尤其是溶氧水平和可同化氮源的降低,致使环境胁迫作用更加严重[9-10]。
氮源作为酵母细胞生长和代谢所必需的元素之一,在酵母生长、繁殖过程中扮演着非常重要的角色。维持较高水平的游离氨基氮(free amino nitrogen,FAN)可改善酵母细胞的生长率和发酵度[11],而麦汁浓度的升高可导致细胞对氨基酸的吸收速率下降[12-13]。氨基酸作为重要的可同化氮源不仅参与细胞内各物质的代谢[13],并能提高啤酒非生物稳定性,而且部分氨基酸还可调控啤酒酵母细胞适应高渗透压和高乙醇毒性,从而提高酵母的发酵性能。对于能够改善啤酒酵母发酵性能的关键氨基酸的确定还存在较大争论,相关研究也甚少。Lekkas等[14]认为Lys和Met是啤酒酿造过程中的关键氨基酸,可提高酵母的发酵性能,而Mas等[15]的研究结果表明Met抑制了酵母细胞的生长;Lei Hongjie等[16]发现Lys和His能够促进酵母细胞生长、提高麦汁发酵度和乙醇产量。这些矛盾的研究结果可能是由发酵条件的差异和酵母菌种特异性引起的。
本研究的前期工作表明:在不同的环境胁迫条件下(高渗透压和高乙醇毒性),酵母对8种氨基酸(Met、Phe、Trp、Arg、His、Ile、Leu、Lys)的同化与发酵性能(麦汁发酵度和乙醇产量)之间呈现显著正相关性(P<0.05),表明这8 种氨基酸可能有助于啤酒酵母适应高浓酿造过程中的环境胁迫。因此,本研究目的是验证这8 种氨基酸在啤酒高浓酿造中对酵母发酵性能的改善作用,为啤酒高浓酿造中优质氮源的选择提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与原料
Lager啤酒酵母Saccharomyces pastorianus,由西北农林科技大学食品工程实验室提供。该菌种经紫外照射和甲基磺酸乙酯复合诱变后在含有高浓度麦芽糖和乙醇的培养基上进行驯化培养获得。
澳麦芽 厦门市老啤匠贸易有限公司;酒花颗粒西安雪花啤酒有限公司。
1.1.2 试剂
果糖 厚朴生物科技(苏州)有限公司;亚甲基蓝 南京化学试剂股份有限公司;无水乙醇、氯化钠、KH2PO4、Na2HPO4·12H2O 国药集团化学试剂有限公司。
1.2 仪器与设备
DYJX型-80 ℃冰箱 鼎耀机械有限公司;UV1780紫外-可见分光光度计 日本岛津公司;TS-1102C小型立式恒温振荡箱 上海天呈实验仪器制有限公司;XP6电子天平 瑞士梅特勒-托利多仪器有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;860型粉碎机 南京威利朗是食品机械有限公司;E100LED MV生物显微镜 日本尼康公司;BSD-150摇床培养箱 上海博讯实业有限公司;ATAGO糖度计厦门森态仪器仪表有限公司;YX-280高压灭菌锅江阴滨江医疗设备厂;CM-5色差计 科电贸易(上海)有限公司。
1.3 方法
1.3.1 麦汁制备
称取一定量的澳麦芽,经粉碎机粉碎后装入糖化锅内,按照麦芽与水的质量比为1∶4加入45 ℃酿造水,搅拌均匀,用乳酸调至pH 5.5。设置升温程序依次为:45 ℃,30 min;63 ℃,60 min;72 ℃,10 min;78 ℃,10 min。以1 ℃/min的速率升温,开始糖化,糖化结束后迅速冷却至45 ℃进行滤布过滤,再将滤液煮沸90 min,煮沸过程中分3 次添加酒花颗粒,添加量为麦芽质量的0.2%。煮沸结束后再次用纱布过滤,得到澄清麦汁。将澄清的麦汁用酿造水定型至12 °P,然后添加麦芽糖浆提高麦汁浓度至24 °P。发酵前进行121 ℃、15 min高压蒸汽灭菌。
1.3.2 酵母种子扩培和啤酒发酵
在无菌条件下,用接种环从试管斜面上刮取一环酵母,接种于10 mL 12 °P全麦芽麦汁种子培养液中,25 ℃、180 r/min摇床培养24 h,之后转入200 mL 12 °P全麦芽麦汁种子液中,20 ℃、120 r/min摇床培养48 h,最后转入1 L种子液中,15 ℃静置培养72 h。8 000×g、4 ℃离心10 min取酵母泥,接种量5×106个细胞/mL。
采用2 L锥形瓶进行啤酒发酵,装液量为1.0 L的24 °P无菌麦汁,接种酵母之前在发酵锥形瓶中添加8 种氨基酸混和物(Met、Phe、Trp、Arg、His、Ile、Leu、Lys),氨基酸的比例按照常浓12 °P麦汁中的相应氨基酸比例计算(Met 79 mg/L、Phe 300 mg/L、Trp 148 mg/L、Arg 381 mg/L、His 209 mg/L、Ile 183 mg/L、Leu 412 mg/L、Lys 192 mg/L),对照组中未添加氨基酸,在其他实验组中氨基酸混合物的添加量分别是原麦汁这8 种氨基酸混合物(12 °P全麦芽麦汁)的0.5、1、2 倍。发酵温度为15 ℃。每天定时取样,发酵液和酵母菌体经8 000×g、4 ℃离心15 min,将上清液置于-20 ℃冰箱保存。
1.3.3 酵母细胞计数和活细胞率测定
采用血球计数板计数法测定悬浮酵母细胞数量和活细胞率(亚甲基蓝染色)。将从锥形瓶中取出的样液稀释10 倍后测定其悬浮细胞数和活细胞率。在0.1 mL细胞悬浮液中加入0.9 mL磷酸盐亚甲基蓝溶液(pH 4.6),振荡混匀,10 min后在电子显微镜下通过血球计数板对活细胞和死细胞(死亡的细胞被染成了蓝色)进行计数。
1.3.4 麦汁浓度和乙醇体积分数测定
将发酵后的麦汁8 000×g、4 ℃离心15 min,取上清液30 mL,倒入25 mL的附温比重瓶中,将附温比重瓶置于20 ℃水浴中,待温度升到20 ℃,快速取出,称其质量,测定其在20 ℃条件下的浸出物含量。麦汁浓度用°P表示,即100 mL麦汁中含有浸出物的固形物质量(g)。
将发酵后的麦汁离心取上清液50 mL,倒入500 mL蒸馏瓶中,再加入50 mL去离子水,加热蒸馏。用50 mL的容量瓶收集馏出液,当馏出液体积接近50 mL时,停止蒸馏,用蒸馏水定容至50 mL。用附温比重瓶测定其在20 ℃条件下的乙醇体积分数。
1.3.5 麦汁FAN测定
对麦汁中的FAN水平测定采用茚三酮显色法[17]。制备Gly标准溶液(0、80、100、120、140、160 µmol/L),绘制标准曲线。麦汁样品稀释100 倍,首先在具塞玻璃试管中加入2.0 mL的稀释样品,然后加入1.0 mL的显色剂(0.5 g茚三酮、10.0 g Na2HPO4·12H2O、6.0 g KH2PO4和0.3 g果糖溶于100 mL去离子水,pH 6.7);再将试管放进100 ℃沸水浴中,使其精确反应16 min,然后20 ℃恒温水浴下冷却20 min,待冷却完成后加入5.0 mL的稀释剂(2.0 g KIO3溶于1 L的40%乙醇溶液),用旋涡振荡器混匀,静置15 min;最后在波长570 nm条件下检测样品吸光度。计算公式如式(1)所示:

1.3.6 啤酒色值测定
首先制备待测样品,将发酵后的啤酒样品稀释至青岛纯生啤酒的乙醇体积分数,再将色差仪经黑板和蒸馏水矫正后,置待测样品于透明比色皿中进行检测,获得L*、a*、b*值,经式(2)计算得到与成品啤酒的色差ΔE。
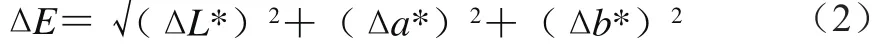
1.3.7 麦汁发酵度的计算
麦汁发酵度是啤酒发酵过程中麦汁固形物被酵母消耗的百分数。计算如式(3)所示:

1.4 数据分析
每个数据均为3 次测定的平均值,采用Minitab 16进行数据分析,结果以 ±s表示,多重比较采用Tukey法,显著水平P值小于0.05。
2 结果与分析
2.1 不同氨基酸添加倍数对啤酒高浓酿造过程中酵母生长的影响
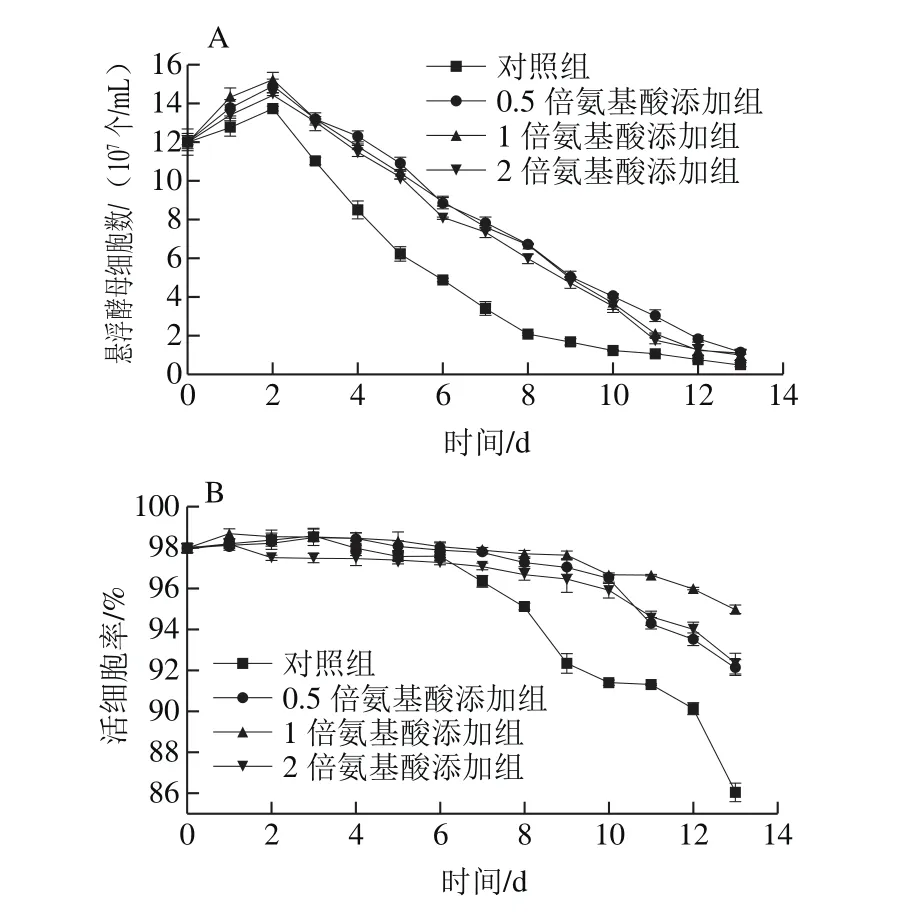
图1 24 °P高浓条件下对照组麦汁与添加氨基酸麦汁发酵过程中的悬浮酵母细胞数(A)和活细胞率(B)Fig.1 Number of suspended yeast cells (A) and cell viability (B) in the control group and malt wort with addition of amino acids during 24 °P high gravity fermentation
由图1A可知,在发酵前2 d,悬浮酵母数快速增多,与对照组相比,添加氨基酸的高浓麦汁中悬浮酵母细胞数增加显著。在发酵的第2天悬浮细胞数达到最多,对照组与添加0.5、1、2 倍氨基酸实验组中的悬浮酵母净生长量分别是1.73×107、2.90×107、3.23×107、2.40×107个/mL,结果表明,氨基酸的添加显著提高了酵母的净生长量,削弱了发酵初期高渗透压对酵母生长的抑制作用。这是因为氨基酸可调控酵母细胞适应高渗透压环境,并刺激了细胞的繁殖。而且在发酵初期阶段(前3 d),添加1 倍氨基酸的高浓麦汁中悬浮酵母细胞数保持最多,可见氮源浓度过低和过高都不利于酵母细胞的生长繁殖,这是因为低氮源水平会降低酵母生长速率并影响细胞繁殖[18],而高浓度氮源则激活了酵母胞内的氮分解代谢物阻遏效应,不利于酵母对氮源的同化[19-21],从而影响酵母的生长繁殖。酵母絮凝性是啤酒酵母的一个重要特性,在生产过程中絮凝性的强弱不仅可控制啤酒的发酵周期、过滤性能等,而且会对啤酒的风味产生影响[22]。主发酵温度一定时,原麦汁浓度对酵母絮凝性影响较大,原麦汁浓度越高,酵母絮凝性越低[4]。氮源水平对发酵后期酵母的絮凝性能影响也较大,与对照组相比,氨基酸的添加可引起细胞絮凝性有所降低。氨基酸的添加对发酵末期酵母活细胞率也产生了显著的影响(图1B),在发酵第6天后,对照组高浓麦汁中活细胞率快速降低,而添加氨基酸的高浓麦汁中活细胞率下降较为平缓。在发酵结束时,对照组的活细胞率较低(≤86%),而添加氨基酸的实验组活细胞率仍保持较高(≥91%)。可见,8 种氨基酸可调控酵母细胞适应高渗透压和高乙醇毒性环境,保证了酵母细胞在高浓酿造过程中具有较高的细胞活力。
2.2 不同氨基酸添加倍数对麦汁发酵度的影响
在氮缺乏的情况下,细胞中的蛋白质及ATP含量较低,对酿酒酵母的发酵能力产生抑制作用,而氮源的添加可显著加快发酵速率,改善酵母发酵能力,增加CO2释放量[19]。如图2所示,与对照组的发酵度相比(80%),添加0.5、1、2 倍氨基酸均可显著提高麦汁发酵度,分别为84%、85%和82%(P<0.05)。导致对照组麦汁发酵度较低的原因为低氮源水平抑制了酵母细胞生长及发酵性能[23];添加0.5 倍和1 倍氨基酸的麦汁发酵度之间没有显著性差异(P>0.05),而添加2 倍氨基酸的麦汁发酵度显著降低(P<0.05),这是因为高浓度氮源导致了酵母细胞内氮代谢物阻遏效应的发生,影响了细胞对氮源的吸收和利用[24-27],从而降低了酵母的发酵性能。

图2 24 °P高浓条件下对照组麦汁与添加氨基酸组麦汁的发酵度Fig.2 Fermentability of the control group and malt wort with addition of amino acids under 24 °P high gravity
2.3 不同氨基酸添加倍数对乙醇产量的影响
乙醇产量是描述发酵程度的一个重要指标,在相同浓度麦汁的发酵体系中,FAN水平的提高可提高麦汁发酵度,发酵度与乙醇产量成正比[28]。如图3所示,高浓麦汁中氨基酸的补充可显著增加乙醇产量(P<0.05),且添加1 倍氨基酸的麦汁发酵得到乙醇产量最多,为13.56%;与对照组相比,添加0.5、1、2 倍氨基酸的麦汁发酵最终乙醇产量分别提高了13%、17%、12%,表明氨基酸的补充可有效改善酵母的代谢,提高细胞的乙醇耐受性。啤酒高浓酿造中,高氮源水平导致乙醇产量下降的原因可能是氮源过高会造成酵母菌生长过于旺盛,过多的糖被用于细胞的增殖,反而不利于乙醇的积累[26],另一方面高浓度氮源会影响氮代谢途径,反而削弱了酵母对氮的吸收,降低了乙醇产量[19-21]。
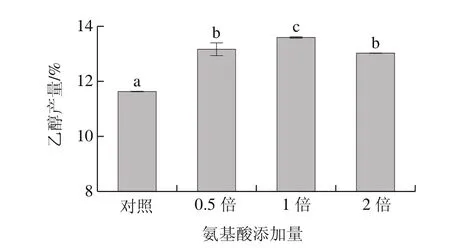
图3 24 °P高浓条件下对照组麦汁与添加氨基酸麦汁的乙醇产量Fig.3 Ethanol production of the control group and malt wort with addition of amino acids under 24 °P high gravity
2.4 不同氨基酸添加倍数对FAN消耗的影响
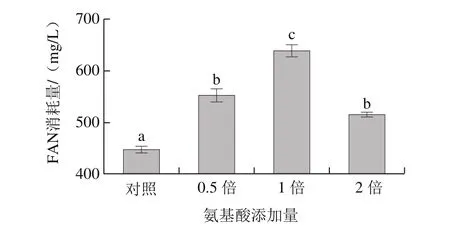
图4 24 °P高浓条件下对照组麦汁与添加氨基酸麦汁中的FAN消耗Fig.4 Free amino nitrogen (FAN) consumption of the control group and malt wort with addition of amino acids under 24 °P high gravity
由图4可知,麦汁中添加氨基酸显著增加了酵母对FAN的消耗,可见麦汁中氮源的缺乏是造成高浓酿造发酵度降低的主要原因。对照组和添加0.5、1、2 倍氨基酸组麦汁发酵中总的FAN消耗量分别为448、551、637、514 mg/L,具有显著差异(P<0.05)。其与细胞生长速率和麦汁发酵度之间有显著的正相关性[29]。添加1 倍氨基酸的麦汁发酵过程中酵母对FAN的消耗量最多,从而显著提高了麦汁发酵度和乙醇产量。
2.5 不同氨基酸添加倍数对啤酒色值的影响
一般常用European Brewery Convention(EBC)比色计法表示啤酒的色度,此方法必须通过肉眼观察色片与啤酒的颜色,这对操作者对颜色的观察能力和敏感程度有较高的要求,由于操作人员之间对颜色的敏感程度不同,结果必然存在差异[30]。本实验通过色差仪测定样品的L*、a*、b*值,不仅可准确定位到一个三维立体点上的色值,不受人感官的局限,还可通过色差ΔE进行对照样品与被测样品之间的比较。

表1 稀释至正常饮用啤酒乙醇体积分数后的啤酒色值Table1 Beer color values after dilution to normal alcohol for consumption
在本实验中,高浓酿造啤酒经酿造水稀释至市售啤酒乙醇体积分数后,与商品啤酒中较畅销的青岛纯生啤酒相比较(表1),添加氨基酸高浓酿造稀释后的啤酒色泽依然鲜亮,与青岛纯生啤酒相比,L*值无显著性差异(P>0.05),a*值差异显著(P<0.05);而未添加氨基酸高浓酿造稀释后的啤酒与青岛纯生啤酒相比,L*、a*、b*分别差异显著(P<0.05)。这可能与多酚类物质氧化、酵母对氨基酸代谢等有关[31]。添加1 倍氨基酸酿造而成的啤酒经稀释后ΔE最小,说明其与对照组青岛纯生啤酒的色泽差异最小。
3 结 论
啤酒高浓酿造中8 种氨基酸的补充可显著提高麦汁发酵度和乙醇产量,促进酵母生长并维持酵母活细胞率,且8 种氨基酸混合物的最适添加量为1 倍。与对照组相比,添加1 倍氨基酸混合物的高浓麦汁发酵中,发酵度提高了6%,乙醇产量提高了17%。添加氨基酸混合物的高浓麦汁发酵而成的啤酒稀释至乙醇体积分数与青岛纯生啤酒一致时,啤酒的色泽依然鲜亮,其中添加1 倍氨基酸高浓酿造而成的啤酒经稀释后ΔE最小,色泽最接近青岛纯生啤酒。本研究为啤酒高浓酿造工业化生产中优质氮源的选择提供理论依据和方法指导。8 种氨基酸分别对啤酒酵母发酵性能的影响,以及8 种氨基酸之间的相互作用将成为下一步的重点研究内容。
