柴油机固态SCR系统铵盐热分解特性与结晶规律的研究∗
2018-07-24范鲁艳汪安东曲大为马军彦
范鲁艳,汪安东,曲大为,李 君,马军彦
(吉林大学,汽车仿真与控制国家重点实验室,长春 130022)
前言
氮氧化合物(NOx)是柴油发动机主要有害排放物之一,随着排放法规的日益严格,对NOx排放控制提出了越来越高的要求。目前选择性催化还原(SCR)技术是降低柴油机的NOx排放的主流技术,采用32.5%的尿素水溶液(添蓝)为还原剂的SCR技术已经较为成熟并广泛应用,但是添蓝SCR技术的应用存在着一些尚未解决的问题,使其较难应对更高排放法规的要求[1-3]:柴油发动机在低速空载或低负荷时的排温只有150℃或者更低,但尿素水溶液热解产生氨气的最低温度为200℃,低于该温度无法提供足量的还原剂来去除NOx[4-8];添蓝 SCR系统随着工作时间的增长,会在排气管和催化器内生成三聚氰酸为主的沉积物,它们堵塞管路,遮挡载体涂覆物,最终降低NOx转化效率。由于传统添蓝SCR系统存在的以上问题,使用固态还原剂(铵盐)加热来产生氨气的方法被提出,部分高校、科研机构、企业已经开展相关研究,研究结果表明采用固态选择性催化还原技术(SSCR)时,氨气直接由还原剂加热产生,不受发动机排气温度的限制,可有效提高低排温条件下的NOx转换率,且无沉积物生成[9-10]。碳酸氢铵、碳酸铵和氨基甲酸铵3种铵盐是应用广泛的工业原料,受热分解时都产生氨气,被普遍认为是SSCR系统的备选还原剂前驱体。其中碳酸氢铵,由于在业内开展以其为还原剂的SSCR系统性能试验中,表明其性能比传统的尿素SCR并无明显改善,NOx转换率也较低,单位质量铵盐的氨气释放量和分解的温度特性都不理想,故在实际应用中已被摒弃。因此在本文中,仅对行业认可的碳酸铵和氨基甲酸铵的相关特性进行了研究。通过热重试验、平衡压试验和逆结晶试验,测定了铵盐的分解温度和分解速率等热解特性以及平衡压和结晶特性,以评定它们的诸多性质在多大程度上满足作为SCR系统还原剂的要求。利用等温法和积分法计算了氨基甲酸铵和碳酸铵的分解动力学参数,为氨气生成量和生成率的精确控制提供理论基础和数据支撑,为氨气生成等系统的设计提供依据。
1 试验装置与方法
1.1 铵盐热解特性分析的试验装置与方法
热重分析在热重仪上进行,主要由3部分组成:温度控制系统、检测系统和记录系统。试验过程中采用 Q500型热重分析仪,适用温度范围为室温~1 000℃,测试精度为0.000 1mg。通过热重试验,本文中研究了碳酸铵和氨基甲酸铵两种铵盐的分解特性。
采用自制的平衡压力试验装置,测量了碳酸铵和氨基甲酸铵的分解平衡压,测量装置如图1所示,主要包括水浴加热装置、铵盐反应容器、温度和压力传感器等。水浴加热装置内温度误差为±0.5℃。铵盐反应容器外壳为不锈钢,容器上盖连接压力传感器,智能压力显示仪显示当前压力。当水浴加热装置内的温度达到设定温度后,需要稳定5min使得铵盐反应容器内温度与水浴加热装置中一致。当压力传感器示数基本稳定时,认为反应容器中铵盐的正逆反应达到平衡,水浴加热装置能达到的最高温度为100℃。

图1 铵盐平衡压力试验装置图
1.2 铵盐结晶试验装置与方法
碳酸铵和氨基甲酸铵两种铵盐分解反应都是可逆过程,对应化学反应方程式如下:
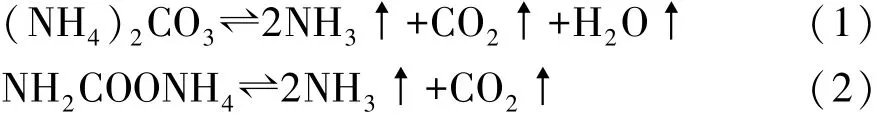
为了测量铵盐的热解逆反应特性,搭建了光学铵盐结晶试验装置,如图2所示,来测量结晶发生时对应的压力和温度。
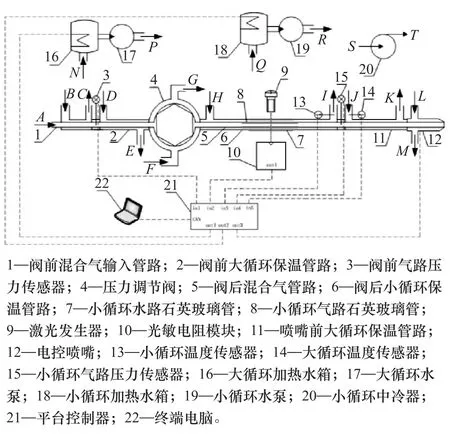
图2 结晶测试系统原理示意图
2 结果分析
2.1 两种铵盐氨含量理论分析
碳酸铵热分解方程式:
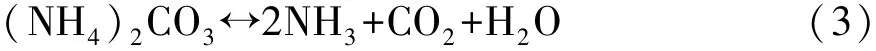
氨基甲酸铵热分解方程式:
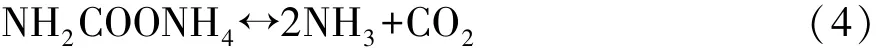
尿素水溶液热分解方程式:

图3对比了1g碳酸铵、氨基甲酸铵和标准车用尿素水溶液3种物质的氨含量。由此,1g标准车用尿素水溶液完全分解只能得0.184 2g氨气,在上述3种物质中的氨含量最小。1g氨基甲酸铵完全分解可得 0.435 9g氨气,1g碳酸铵完全分解可得0.354 2g氨气。氨基甲酸铵和碳酸铵的氨含量对比标准车用尿素水溶液有较大优势,同质量的氨基甲酸铵和碳酸铵完全分解能得到的氨气分别为标准车用尿素水溶液的2.37和1.92倍。因此,采用固态铵SCR系统可降低添加还原剂的频率。

图3 单位质量铵源的氨含量
2.2 热重试验结果分析
2.2.1 变温热重分析
图4为4种不同升温速率下,两种铵盐的TG分解过程对比。以5℃/min的升温速率加热铵盐,当温度升高到120℃时,碳酸铵和氨基甲酸铵经过24min左右基本分解完成,二者的平均分解速率相差不大;以 10℃/min的升温速率加热时,经过14min,当温度升高到140℃时,氨基甲酸铵分解完成,碳酸铵15min分解完成;以15℃/min的升温速率加热时,碳酸铵和氨基甲酸铵都需要经过大约10min,温度升高到155℃左右,分解过程结束;20℃/min的升温速率加热时,当温度升高到163℃时,氨基甲酸铵分解完成,相对应的碳酸铵的温度为167℃。

图4 不同升温速率下的TG曲线
4种升温速率加热铵盐分解过程中,碳酸铵和氨基甲酸铵分解曲线比较接近。它们在室温下即可缓慢分解;随着升温速率的增加,两种铵盐的分解速率均有不同程度的增加。
2.2.2 恒温热重分析
图5为碳酸铵和氨基甲酸铵在3种不同温度下,恒温加热30min的分解过程。在50℃恒温加热过程中,碳酸铵分解了47.96%,氨基甲酸铵分解了65.18%;在 70℃恒温过程中,碳酸铵分解了97.09%,接近完全分解,氨基甲酸铵完全分解,用时大约27min;90℃恒温过程中,碳酸铵和氨基甲酸铵都能完全分解,所用时间相近,大约8min。温度越高,两种铵盐的分解速率越快,两者分解速率的差异也越小。因此,碳酸铵和氨基甲酸铵的分解能力都较高,在发动机冷却水和润滑油工作温度范围内即可快速、大量地分解,是比较合适的固态SCR系统氨源。

图5 两种铵盐在不同温度下的分解
2.2.3 分解平衡压试验结果分析
分解平衡压力试验的目的是探究两种铵盐的分解生成氨气过程中的压力变化规律。文献[11]中提供了氨基甲酸铵分解平衡压力(单位为Pa)的经验公式:

两种铵盐分解平衡压力随温度而变化的试验曲线与按经验公式计算结果的对比如图6所示。由图可见,在密闭容器中,两种铵盐的分解平衡压力呈指数形式增大。在温度低于85℃时,两种铵盐的分解平衡压值基本相同;温度高于90℃后,才开始出现差别,碳酸铵的分解平衡压略高于氨基甲酸铵,温度为100℃时碳酸铵和氨基甲酸铵的分解平衡压分别达到0.95和0.78MPa。由图还可看出,按经验公式算得的曲线与试验曲线很接近,且在高温段两种铵盐呈现差异时介乎两者之间,说明原属氨基甲酸铵的经验公式,同样适用于碳酸铵。试验结果表明,在柴油机冷却液和机油的正常工作温度范围内,两种铵盐都能为喷射系统提供较高的喷射压力。
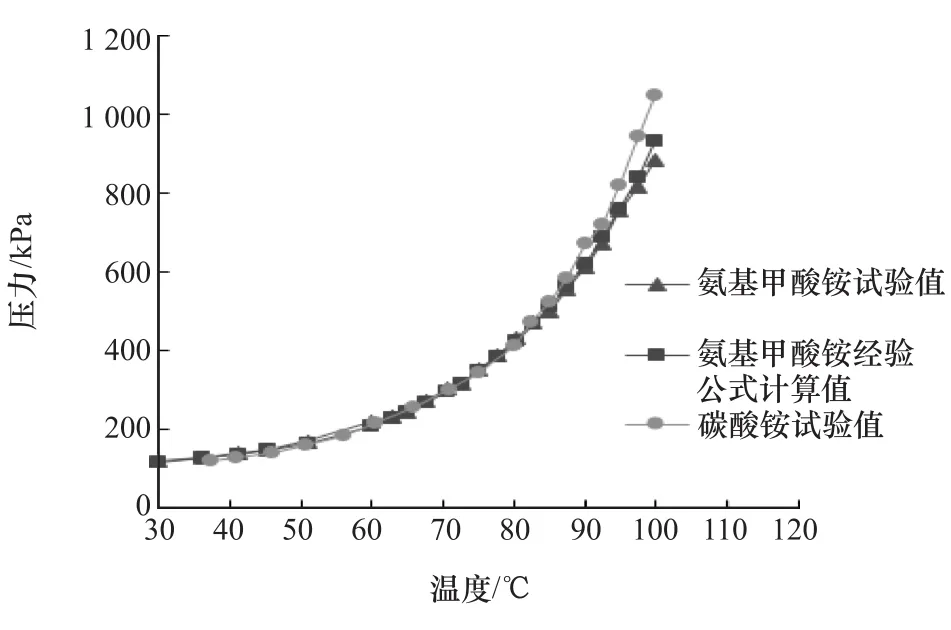
图6 两种铵盐分解平衡压试验值与经验公式对比
2.2.4 铵盐逆结晶试验结果与分析
铵盐的受热分解为可逆反应,产生的气体在一定温度和压力下会逆反应生成固态结晶物,如果固态结晶物在氨气调压阀、还原剂喷嘴处、管道壁面等处生成并聚集,氨气供给的精确控制会受到不利影响,更严重时会造成供给系统的失灵和损坏。针对这个问题,本文中建立了铵盐结晶光学试验平台,试验得到铵盐的结晶规律。图7为碳酸铵产生的气体在玻璃管内壁重新聚合产生的结晶粉末。图8为测试碳酸铵热解产生的气体结晶过程,喷射压力为40kPa。受限于调压阀的调节能力,喷射压力很难维持在40kPa恒定,但波动不超过3kPa。降温速率约为1.5℃/min。由图8可见,随着温度的下降,在前一段时间内光敏电阻模块的输出电压曲线基本接近水平,近似为0.35V,随着温度的降低,某一时刻起,160~250s之间的某一点,光敏电阻输出电压开始急剧变化,从0.35升到了0.66V,判定有逆反应结晶粉末在玻璃管内壁产生,光线通过该段玻璃管传播受阻,导致光敏电阻接收到的光线强度迅速降低,输出电压急剧变化。对图8中光敏电阻模块的输出电压曲线求微分,求得输出电压的斜率变化曲线,如图9所示。在前160s,光敏电阻模块电压输出曲线的斜率变化基本在0上下浮动,时间为175s左右,微分曲线出现明显变化,对应微分值从-0.000 1降低到-0.001 3,光敏电阻输出电压微分曲线先有微小幅度的降低,随后迅速上升,近似认为此刻是结晶开始生产的临界点,此刻对应的温度可认为是该喷射压力对应的结晶温度。图9中对应的压力为41.6kPa,温度为 55.6℃。

图7 碳酸铵在玻璃管内壁结晶

图8 光敏电阻模块输出电压及其微分
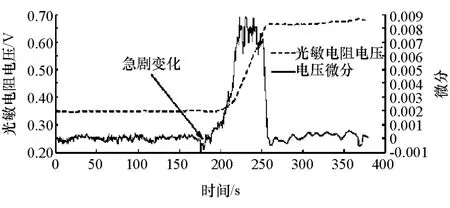
图9 两种铵盐重结晶压力 温度关系
采用上述方法进行了其他几个工况点的试验。试验得出碳酸铵和氨基甲酸铵热解产生气体的结晶温度与结晶压力对应关系,分别如表1和表2所示。

表1 碳酸铵结晶温度与结晶压力
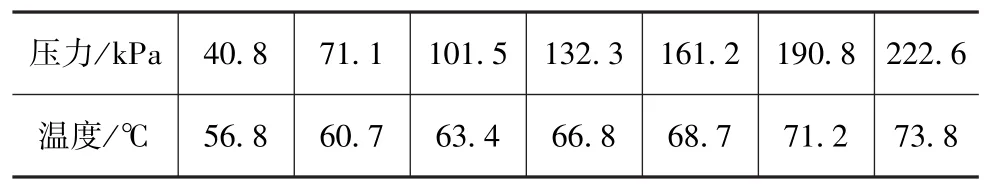
表2 氨基甲酸铵结晶温度与结晶压力
将表1和表2的数据绘成曲线,如图10所示。由图可见,当喷射压力相同时,两种铵盐的重结晶温度相差不大,但氨基甲酸铵稍高。
试验结果表明,两种铵盐在正常工作温度下,都不会发生再结晶。
3 铵盐热分解动力学参数的求解
(1)动力学参数的求解方法
虽然铵盐热分解动力学参数,与其作为SCR系统氨源应具备的特性,没有很直接的关系,但通过热分析试验,求其分解速率、反应级数、活化能和指前因子,对在理论上对其分解做出解释和预测,和指导SCR氨气生成装置的设计具有重要意义。
Arrhenius方程是常用的动力学方程[12-14],其表达式为

式中:k为速率常数;A为指前因子;E为反应活化能,kJ/mol;R 为摩尔气体常数,8.314J/(mol·K);T为反应温度,K。
在恒温下测量碳酸铵和氨基甲酸铵的受热分解剩余质量分数c与受热时间的关系,设其动力学微分方程为[15-17]

式中k和n分别为速率常数和反应级数。对式(9)积分可得

式中c0为t=0时碳酸铵和氨基甲酸铵的质量分数,此时 c0=1。求取反应级数时,微分法通过计算使用式(9)的线性形式;积分法使用式(10)或
式(11)的线性形式。式(10)和式(11)可变换为

式(12)和式(13)是关于k和n的非线性方程,通过热重分析曲线中两个反应时间下的质量分数即可求解。通常测定的试验数据为j(>2)组。使用最小二乘法求解式(12)或式(13),对参数k和n赋初值,t=ti,代入式(12)或式(13)可求出对应的质量分数,偏差的平方和P:

式中:ci为试验值;为计算值。若P=0,则式(12)或式(13)的解即为k和n。通常无法使P=0,而是通过数学迭代求得P的极小值,即P≪1时,认为参数迭代计算是合理的。
在50,70和90℃ 3个恒温热重分析试验的基础上,增加了60,80和100℃来求取反应级数n和速率常数k。
(2)碳酸铵的反应级数及速率常数
求得的反应级数n、速率常数k和偏差的平方和P如表3所示。
由表3可知随加热温度升高,碳酸铵分解反应速率常数逐渐增大,反应级数的平均值为0.658 5,取整约等于2/3级,可知碳酸铵受热分解不是1级反应。以n=2/3再次求取碳酸铵在各个温度下的速率常数,各个温度下的计算结果如表4所示,对比与n≠1时计算所得速率常数的相对误差,上下不超过3%,可以忽略不计,偏差平方和满足≪1。

表4 碳酸铵n=2/3的反应参数
通过以上计算,可知在本文试验温度范围内,碳酸铵受热分解的反应级数为2/3级是合理的。
(3)碳酸铵的表观活化能与表观指前因子
对式(8)两边取对数:

碳酸铵分解温度与lnk的对应关系如表5所示。迭代计算的结果如表6所示。
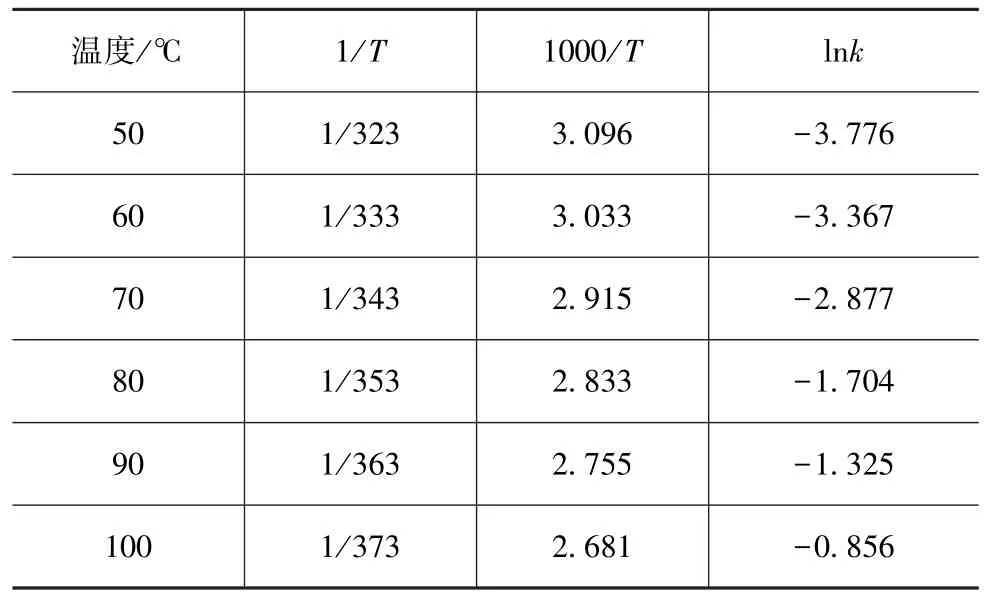
表5 碳酸铵分解温度与lnk的对应关系

表6 碳酸铵热分解活化能和指前因子
可得碳酸铵剩余质量分数随加热温度、时间的变化关系为

由式(16)即可求得碳酸铵在受热分解过程中质量分数随时间和温度的变化。
(4)氨基甲酸铵的反应级数及速率常数
采用前述碳酸铵相同的方法,得出氨基甲酸铵各反应温度下的反应级数n、速率常数k和偏差的平方和P如表7所示。

表7 氨基甲酸铵的反应级数和速率常数
以n=1/2再次求取氨基甲酸铵在各个温度下的速率常数,计算结果如表8所示,对比与n≠1时计算所得速率常数的相对误差可以忽略不计,偏差平方和仍然满足≪1。
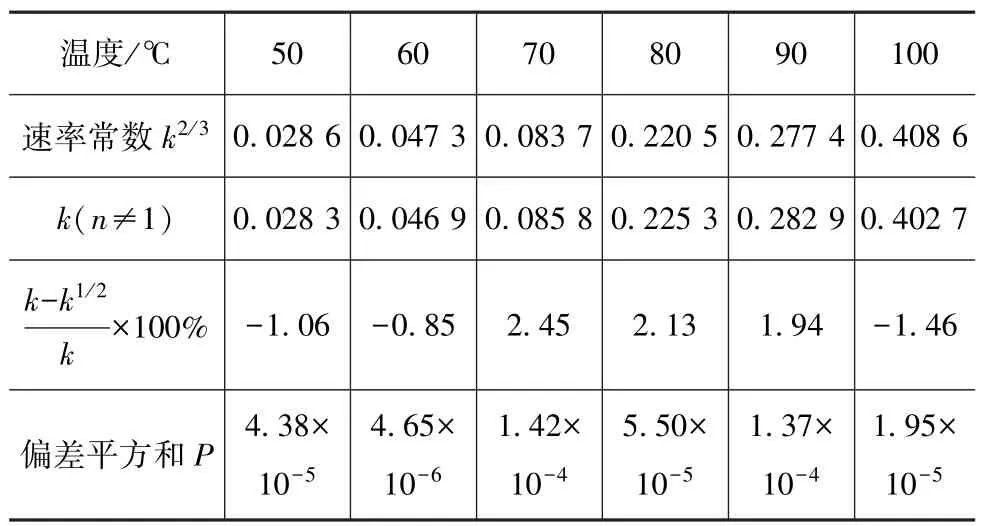
表8 氨基甲酸铵n=1/2反应参数
以n=1/2拟合的氨基甲酸铵在各个温度下热分解质量分数随加热时间的变化值与试验值对比可知以n=1/2级拟合的结果与试验值非常接近,拟合结果较理想。
可知在试验温度范围内,氨基甲酸铵的反应级数取n=1/2级是合理的,能够较好拟合氨基甲酸铵分解过程质量分数的变化。
(5)氨基甲酸铵的表观活化能与表观指前因子
对氨基甲酸铵分解过程应用式(15),可得分解温度与lnk对应关系,如表9所示。
求活化能E和指前因子A,如表10所示。
可得氨基甲酸铵剩余质量分数随加热温度、时间的变化关系。

由式(17)即可求得碳酸铵的受热分解过程中质量分数随时间和温度的变化。
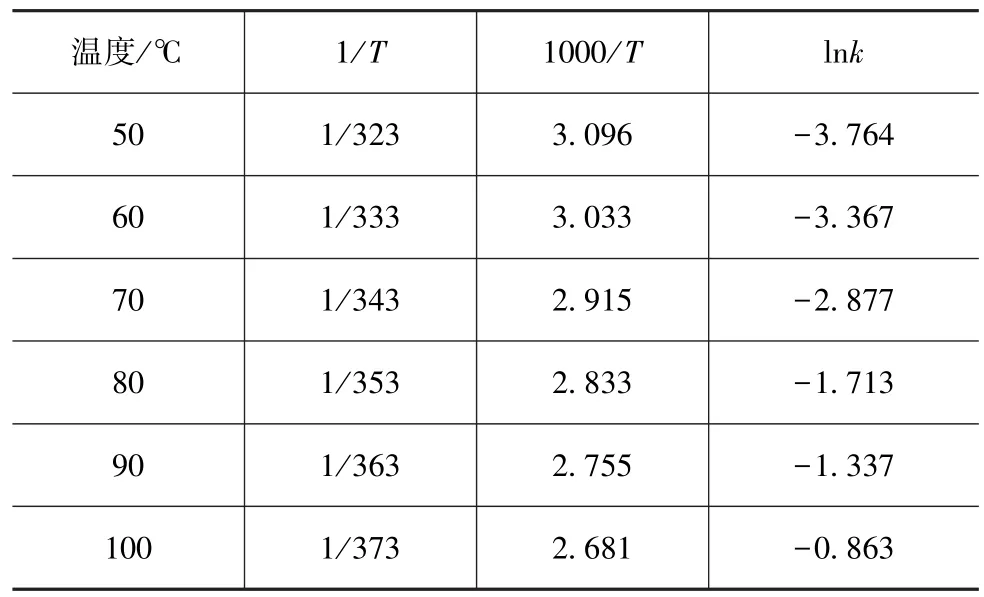
表9 氨基甲酸铵分解温度与lnk对应关系

表10 氨基甲酸铵热分解活化能和指前因子
通过热分析动力学求得在试验温度范围内碳酸铵分解反应级数为2/3级,活化能为62 614J/mol,指前因子为4.33×106s-1。氨基甲酸铵分解级数为1/2级、活化能为56 382J/mol,指前因子为 6.07×105s-1。
4 结论
(1)单位质量碳酸铵和氨基甲酸铵分解获得的氨气分别为尿素水溶液的1.92和2.37倍。温度为90℃时,氨基甲酸铵和碳酸铵都能在8min内完全分解。
(2)碳酸铵和氨基甲酸铵的分解平衡压力随温度呈指数方式增加,在发动机冷却液、机油工作温度范围内,两种铵盐都能提供较高的气体压力。
(3)在实际喷射系统中,碳酸铵和氨基甲酸铵的重结晶温度要高于平衡压力所对应的温度,尤其在130kPa及以下,再结晶温度比平衡压力温度高得多。压力越低,再结晶温度与平衡压力温度相差越大,高于160kPa时,两者基本相当。在正常工作温度下,两种铵盐都不会发生再结晶。
(4)在试验温度范围内,碳酸铵受热分解为2/3级反应,表观活化能为62 614J/mol,表观指前因子为4.3×106s-1。氨基甲酸铵受热分解为1/2级反应,表观活化能为 56 382J/mol,表观指前因子为6.07×105s-1。这为固态SCR系统中氨气生成和供给系统装置的设计提供技术依据。
