摘叶和挪叶处理对‘赤霞珠’葡萄种子黄烷-3-醇类物质的影响
2018-07-23刘月,何非,李强,严静,张波,石英
刘 月,何 非,李 强,严 静,张 波,石 英
(1中国农业大学 食品科学与营养工程学院,农业部葡萄酒加工重点实验室,北京100083;2中国农业科学院 a蔬菜花卉研究所,北京100081;b郑州果树研究所,河南 郑州450009;3甘肃农业大学 食品科学与工程学院,甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070)
黄烷-3-醇类物质是由植物体内类黄酮代谢途径产生的一类多酚物质,广泛存在于植物的根、茎、叶片、果实和种子等组织中[1],不仅参与植物的生长,而且也对抵抗病原微生物侵染[2]、防护诱变损伤具有十分重要的作用[3]。此外,黄烷-3-醇类物质的酚羟基结构对活性氧等自由基有很强的清除能力,通过与自由基结合,可减少或阻止组织中氧化反应的进行,从而起到抗氧化作用[4]。在酿酒葡萄中,黄烷-3-醇类物质是一类重要的生物活性物质,主要存在于葡萄的种子、果皮和果梗中,其中以种子中含量最高[5],并伴随着酿酒过程的浸渍及发酵工艺逐步进入到葡萄酒中,赋予葡萄酒色泽、口感、风味和澄清度等感官特征。在陈酿阶段,其通过与花色苷等物质之间的相互作用,对葡萄酒体的稳定性也具有十分积极的效果。
随着果实的成熟及葡萄生长环境的变化,黄烷-3-醇类物质的组成和含量会有所不同。随着成熟度的增加,黄烷-3-醇类物质的聚合体(原花色素)含量及聚合度也逐渐增加[6]。研究表明,不同葡萄品种之间黄烷-3-醇类物质的含量及类型差异很大,相同品种葡萄中该类物质的构成及含量也会受地域、栽培条件、气候条件等多种因素的影响,其中光照、温度、水分等环境因素以及外源植物激素对黄烷-3-醇的合成有十分明显的影响[7-11]。通过在葡萄结果部位附近进行摘叶和挪叶处理,可以改善结果带的空气流动,防止病害的发生[12],同时还可以改变果实的曝光量及温度[13]。目前,关于摘叶和挪叶处理对酿酒葡萄品质影响的研究,主要集中在产量、果穗紧密度、总糖和总酸等基本理化指标和颜色风味等感官方面[14-17],较少涉及果皮中花色苷和黄烷醇类物质的分析[18-19],而对种子中黄烷-3-醇类物质的影响尚未见文献报道。因此,通过对果实发育不同时期的葡萄进行摘叶和挪叶处理,改变葡萄果实发育过程中的曝光量和温度,研究成熟过程中葡萄种子中黄烷-3-醇类物质的变化模式,对于研究黄烷-3-醇类物质的积累及提高酿酒葡萄的品质具有重要意义。
新疆玛纳斯地区位于天山北麓经济带核心位置,当地气候条件非常适宜酿酒葡萄的生长,是我国葡萄酒的主要产区之一。本研究以当地主要栽培的‘赤霞珠’(VitisviniferaL.cv.Cabernet Sauvignon)葡萄为试材,在不同发育期葡萄的结果带附近分别进行摘叶和挪叶处理,研究摘叶和挪叶处理对葡萄种子黄烷-3-醇类物质组成及含量的影响,以期为揭示光照与葡萄品质形成的本质关系提供理论依据,并为实际生产中通过栽培措施改良葡萄品质的研究提供参考。
1 材料与方法
1.1 试验材料
试验于2011年在新疆昌吉州玛纳斯县进行,试验地位于北纬44°18′,东经86°12′,海拔470 m;属于半干旱气候,平均气温8.2 ℃,最高平均气温13.6 ℃,最低平均气温3.4 ℃,日照2 899 h,降雨量217.8 mm,其中8-9月日照时数为2 173.7 h。试验地土壤类型为砂壤土,弱碱性(不同深度土壤pH为7.2-7.5)。
供试葡萄品种为‘赤霞珠’,2000年定植,株行距1.0 m×2.5 m,为倾斜单龙干水平向上的整形方式,简称改良VSP(M-VSP),南北行向,施肥和病虫害管理按照行业标准(GB 12696-1990, GB/T 25393-2010)进行。葡萄于06-01进入盛花期,花期持续约1周,花后60 d(07-30)开始转色,转色期持续约3周。试验设2个因素,分别为处理时期和处理方式,处理时期分3个水平,分别为08-09(转色50%,记为“V”)、08-24(转色100%,记为“AV”)、09-08(采收前2周,记为“PH”);处理方式分3个水平,分别为摘除新稍基部以上1,3,5节位上的叶片(半摘叶,记为“HLR”)、摘除新稍基部以上1-6节上的叶片(全摘叶,记为“LR”)和移开新稍基部以上1-6节上的叶片(挪叶,记为“LM”)。
试验共有9个处理,分别记为HLR-V(表示50%转色期半摘叶,余类推)、HLR-AV、HLR-PH、LR-V、LR-AV、LR-PH、LM-V、LM-AV和LM-PH,以常规栽培处理为对照(CK)。采用随机区组设计,每种处理均有3个重复,每个重复15株葡萄树。分别在葡萄花后31 d(07-01)、45 d(07-15)、60 d(07-30)、69 d(08-09)、73 d(08-13)、84 d(08-24)、98 d(09-08)、114 d(09-24)采样,直至果实成熟采收。果实采摘后立即置于-80 ℃冰箱中保存待测。
1.2 试 剂
试剂儿茶素((+)-Catechin,C)、表儿茶素((-)-Epicatechin,EC)、表棓儿茶素(Epigallocatechin,EGC)和表儿茶素没食子酸酯(Epicatechin-3-O-gallate,ECG),纯度>98%,购于美国Sigma公司;乙腈、甲醇、醋酸,均为色谱纯,来自美国Fisher公司;甲醇、丙酮、盐酸、间苯三酚和抗坏血酸等均为国产分析纯试剂,来自蓝弋化工。
1.3 试验方法
1.3.1 样品处理 黄烷-3-醇的提取参照Liang等[20]的方法。随机选出一定数目的葡萄果实,手工分离葡萄种子,将种子置于液氮中研磨至粉末状,用真空冷冻干燥机冻干并于-40 ℃保存待用。(1)游离体黄烷-3-醇的提取。称取0.1 g葡萄籽干粉,加入1 mL体积分数70%丙酮(含0.005 g Vc),10 000 r/min离心15 min,收集上清液,共提3次,合并上清液并摇匀。取400 μL上清液用N2吹干后,用200 μL含体积分数1% HCl酸化的甲醇溶解,再加入200 μL乙酸钠(200 mmol/L)中和后,0.22 μm滤膜过滤上样。(2)聚合体黄烷-3-醇的裂解和提取。称取0.1 g葡萄籽干粉,加入1 mL间苯三酚缓冲液(含0.3 mol/L HCL,50 g/L的间苯三酚和0.005 g抗坏血酸),50 ℃下静置20 min,加1 mL乙酸钠(200 mmol/L)终止反应,10 000 r/min离心15 min,收集取上清液,共提3次,合并上清液摇匀后,0.22 μm滤膜过滤上样。
1.3.2 HPLC-MS条件 Agilent 1100系列LC/MSD Trap-VL液相色谱-离子阱质谱联用仪,美国AgilentTechnologies公司。选择反相色谱条件,ZORBAXSB-C18 (5 μm,250 mm×4.6 mm)色谱柱,流动相A为体积分数0.2%乙酸水溶液,B为乙腈-体积分数0.2%乙酸水溶液(V(乙腈)∶V(体积分数0.2%乙酸)=4∶1);洗脱程序:0~20 min,10.0% B; 20~40 min,10.0%~20.0% B;40~50 min,20.0%~33.0% B;50~55 min,33.0%~40.0% B;55~58 min,40%~100% B;58~63 min,100% B;63~64 min,100%~10.0% B;64~70 min,10% B。流速为1 mL/min;柱温:25 ℃,检测波长280 nm,进样量10 μL。质谱采用电喷雾离子源(ESI),负离子模式,离子扫描范围100~2 200m/z,雾化气压力0.24 MPa;干燥气流速10 L/min,干燥气温度350 ℃,碰撞电压1.00 V。
1.3.3 样品的定性和定量 黄烷-3-醇的定性按照质谱信息和标样保留时间进行,采用外标法进行定量分析。原花色素经酸催化发生裂解反应形成延伸单元和起始单元,延伸单元为与间苯三酚结合的黄烷-3-醇复合物,起始单元为其中游离的黄烷-3-醇单体减去丙酮提取所检测到的游离单体。样品重复测定2次,试验结果以每克干种子中所含的各单元的质量表示,单位为mg/g。样品的没食子酸化程度(G)和平均聚合度(mDP)的计算公式如下:
1.4 数据处理
采用IBM SPASS Statistics 20软件进行数据统计与分析,采用单因素方差分析进行差异显著性(P<0.05)检验,采用Origin 8.1软件绘图。
2 结果与分析
2.1 摘叶和挪叶处理对葡萄种子黄烷-3-醇类物质含量变化的影响
图1显示,在‘赤霞珠’葡萄生长发育过程中,种子黄烷-3-醇的含量自花后31 d开始逐渐升高,在果实转色初期(花后60 d)达到峰值(78.3 mg/g),之后逐渐下降,虽在成熟阶段其含量有所回升,但一直维持在相对稳定的水平(50 mg/g左右),同转色开始时相比,降幅为36.1%。这一变化趋势与前人的研究结果[21-23]相似。‘赤霞珠’种子中共检测到3种黄烷-3-醇单体,分别为C、EC和ECG,也与前人的研究结果[24]一致。‘赤霞珠’种子黄烷-3-醇单体主要以EC和ECG为主,占黄烷-3-醇总量的75%以上。EC和ECG在转色初期(花后60 d)达到峰值,含量分别为30.7和34.2 mg/g,之后含量有所降低,至采收时分别下降了18.9%和35.4%。相比EC和ECG,C的含量较低,仅占总含量的8.9%~22.6%。C在花后69 d时含量达到最高,之后开始下降,并逐渐稳定在4.6 mg/g左右。
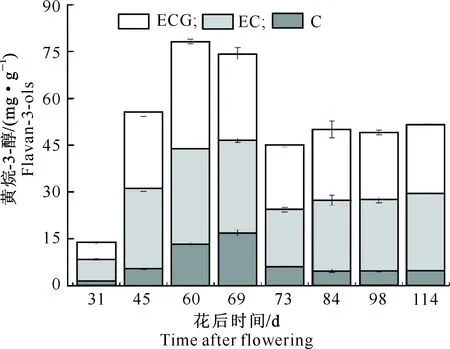
图1 葡萄成熟过程中种子黄烷-3-醇类物质的变化Fig.1 Change of flavan-3-ols in seeds during grape ripening
图2所示为‘赤霞珠’葡萄采收时不同时期摘叶和挪叶处理对种子黄烷-3-醇含量的影响。
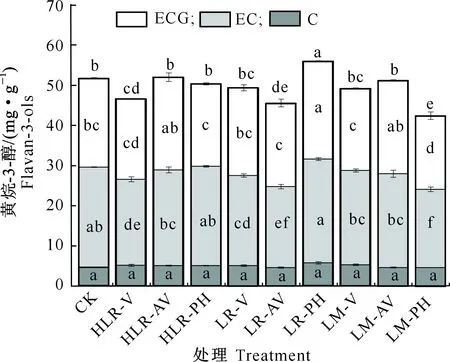
柱上标不同字母表示不同处理间差异显著。图4同Different letters indicate significant difference at P<0.05.The same for Fig.4图2 摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇类物质的影响Fig.2 Influence of leaf removing and moving on concentration of flavan-3-ols in grape seeds at harvest
由图2可知,与对照相比,仅LR-PH显著增加了黄烷-3-醇的含量,增幅为7.7%;而HLR-V、LR-AV及LM-PH的黄烷-3-醇含量均显著低于对照,其中LM-PH的含量最低(42.3 mg/g),较对照降低18%;其他处理的黄烷-3-醇含量与对照相比无显著差异(P<0.05)。对黄烷-3-醇单体而言,HLR-AV、LM-AV和LR-PH处理的ECG含量均高于对照,其中LR-PH处理的ECG含量显著高于对照,增幅为9.5%;其余处理组的ECG含量均低于对照,其中LM-PH处理的ECG含量显著低于对照,降幅为17.1%。对EC含量而言,HLR-V、LR-V、LR-AV及LM-PH处理均显著低于对照,而其他处理的EC含量与对照均无显著差异(P<0.05)。各处理的C含量均较低,且在所有处理之间均无显著差异。
2.2 摘叶和挪叶处理对葡萄种子黄烷-3-醇类物质组成单元的影响
黄烷-3-醇的总含量包括延伸单元、起始单元和游离单体,图3显示了延伸单元、起始单元和游离单体含量随果实发育的变化情况。延伸单元是黄烷-3-醇的主要组成单元,由图3-A可知,在花后60 d 其含量上升到最高(38.2 mg/g),之后略有下降,转色结束后又呈略微升高的趋势,至采收时,与花后60 d相比仅下降4.7%。图3-B表明,起始单元含量在花后69 d上升至最高(24.8 mg/g),之后持续下降,至采收时降幅达42.9%。由图3-C可以看出,黄烷-3-醇中的游离单体与起始单元相似,也在花后69 d上升至最高(21.3 mg/g),花后73 d出现急剧下降,降幅89.2%,之后含量维持在1 mg/g左右。
表1显示了延伸单元、起始单元和游离单体中各组成单体,即EC、C、EGG所占比例的变化情况。延伸单元中EC为主要单体,其所占比例随葡萄的生长成熟呈逐渐下降趋势,从花后31 d的82.26%下降为花后114 d的57.22%;ECG所占比例居次,总体呈升高趋势,至花后73 d,其比例上升至最高(47.85%),之后保持平稳;C的比例最低,随葡萄的生长呈先上升后下降趋势,基本保持在10%以下。与延伸单元不同,起始单元中ECG为主要单体,其比例随葡萄的生长成熟先下降后趋于平稳,从花后31 d的76.95%下降为花后114 d的47.16%;EC的比例呈逐渐增加趋势,而C的比例基本一直保持稳定的状态,至采收时,EC和C的比例分别为27.11%和25.73%。对于游离单体而言,3种单体的比例随着葡萄的生长成熟呈波动状态,EC的比例最低,基本上低于30%,C的比例为20%~40%,而ECG的比例为30%~60%,波动变化趋势明显。
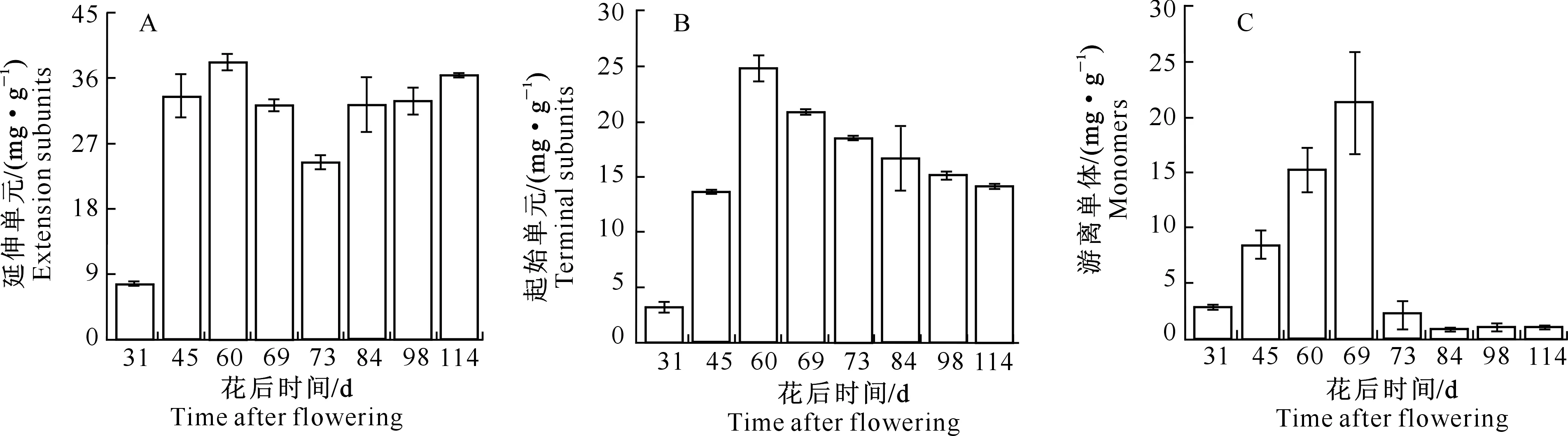
图3 葡萄成熟过程中种子黄烷-3-醇类物质组成单元的变化Fig.3 Change of concentrations of flavan-3-ols units in seeds during grape ripening
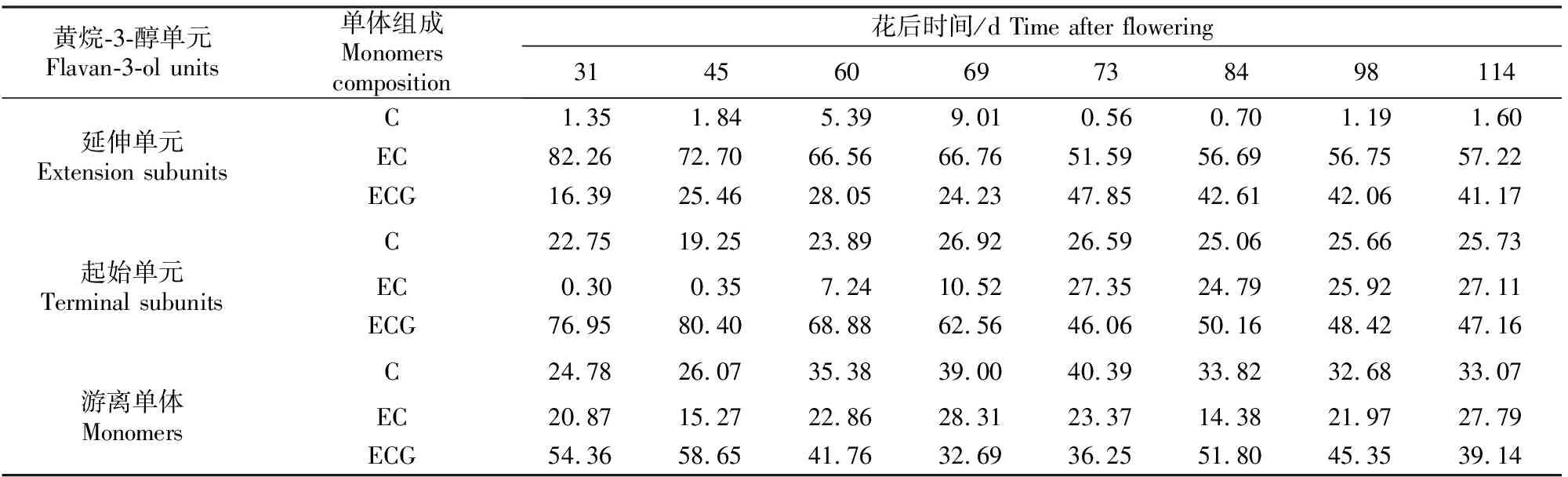
表1 葡萄成熟过程中种子黄烷-3-醇类物质组成单元中单体比例的变化Table 1 Change of monomers ratios of flavan-3-ol units in seeds during grape ripening %
摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇延伸单元、起始单元和游离单体的影响见图4。
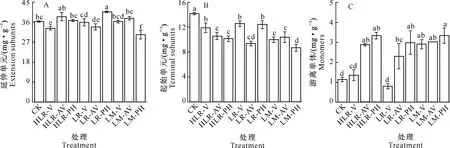
图4 摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇类物质组成单元的影响Fig.4 Influence of leaf removing and leaf moving on concentrations of flavan-3-ols units in grape seeds at harvest
由图4-A可知,延伸单元为黄烷-3-醇类物质的主要组成单元,其含量的多少直接影响着黄烷-3-醇总含量的变化。因此,半摘叶、全摘叶和挪叶处理对延伸单元含量的影响与其对黄烷-3-醇总含量的影响表现出相同的规律,在此不再赘述。由图4-B可以看出,不同时期摘叶和挪叶处理对起始单元含量的影响规律表现相同,即均显著地降低了其含量(P<0.05)。例如,LM-PH处理的起始单元含量最低,较对照组降低38.7%。由图4-C可知,对于游离单体而言,除HLR-V和LR-V处理外,其他处理组游离单体含量均显著高于对照,同时表现出处理时期越晚,其含量越高的变化规律。例如,HLR-PH处理的游离单体含量分别较HLR-V和HLR-AV处理高59.6%和13.8%。
表2显示了摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇延伸单元、起始单元和游离单体中各组成单体所占比例的影响。对延伸单元组成单体而言,两种摘叶处理方式均降低了ECG的比例,并显著地增加了C的比例(P<0.05)。例如,LR-PH处理的C和ECG比例较对照组分别增加了67.5%和降低了9.6%。对延伸单元EC比例的影响,则表现为采收前的各处理均使其比例有所增加,而转色结束时各处理的比例又有所降低。对起始单元而言,半摘叶、全摘叶和挪叶处理均显著地降低了其EC的比例,但显著增加了ECG的比例,其中LM-PH处理的影响效果最明显,使EC降低了94.7%,而使ECG增加了36.8%;起始单元C的比例仅以HLR-V、HLR-PH和LR-V处理高于对照。在游离单体的组成中,仅LR-V处理能分别显著地增加ECG的比例和降低C的比例,其他处理组的ECG比例均低于对照,而C和EC的比例均高于对照,其中EC的比例均有显著增加。
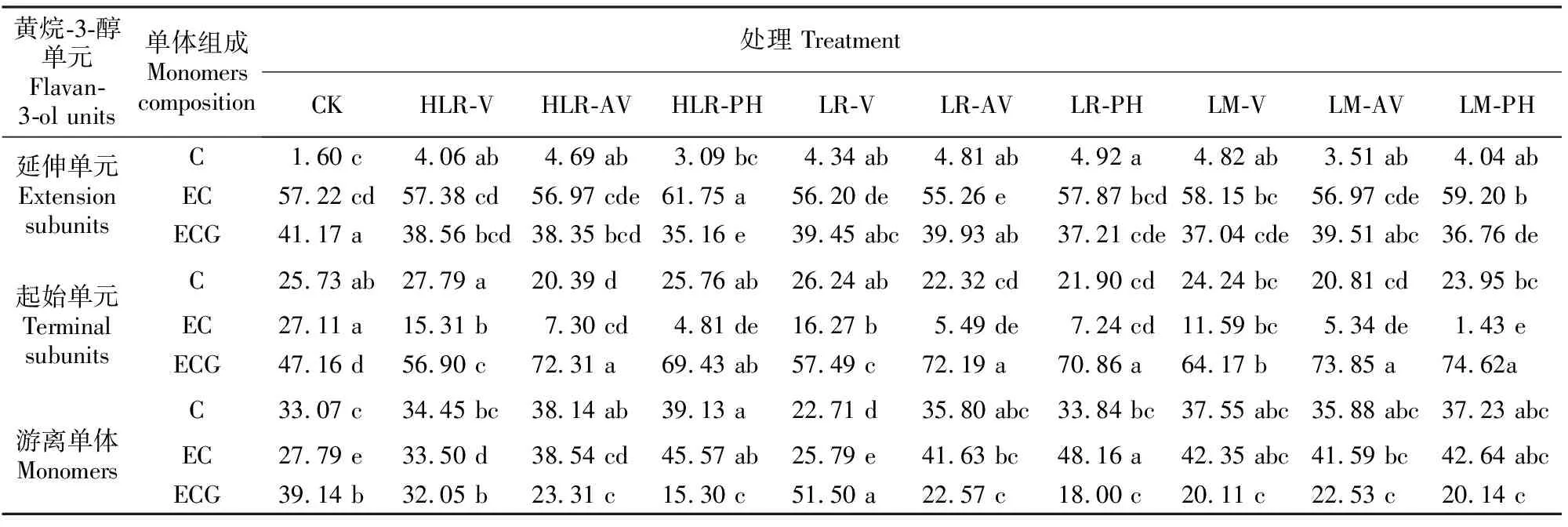
表2 摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇类物质组成单元中单体比例的影响Table 2 Influence of leaf removing and leaf moving on monomers ratios of flavan-3-ols units in grape seeds at harvest %
注:同一行数据后标不同字母表示不同处理之间具有显著差异(P<0.05)。
Notes: Different letters in same row indicate significant difference atP<0.05.
2.3 摘叶和挪叶处理对葡萄种子黄烷-3-醇类物质mDP及G的影响
对酿酒葡萄黄烷-3-醇类物质进行分析时,mDP和G通常作为重要的分析指标,用以反映酒体的收敛性和结构感。一般来说,随着mDP的升高,酒体的苦味会减少而涩味有所增强,同时较高的G则会使葡萄酒口感粗糙[25]。在葡萄果实发育过程中,种子黄烷-3-醇mDP及G的变化规律如图5所示。
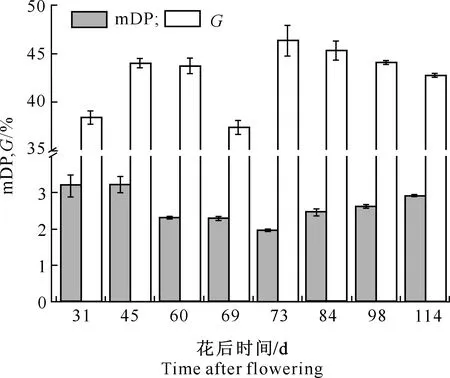
图5 葡萄成熟过程中种子黄烷-3-醇类物质mDP和G的变化Fig.5 Change of flavan-3-ols mDP and G in seeds during grape ripening
摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇物质mDP和G的影响如图6所示。
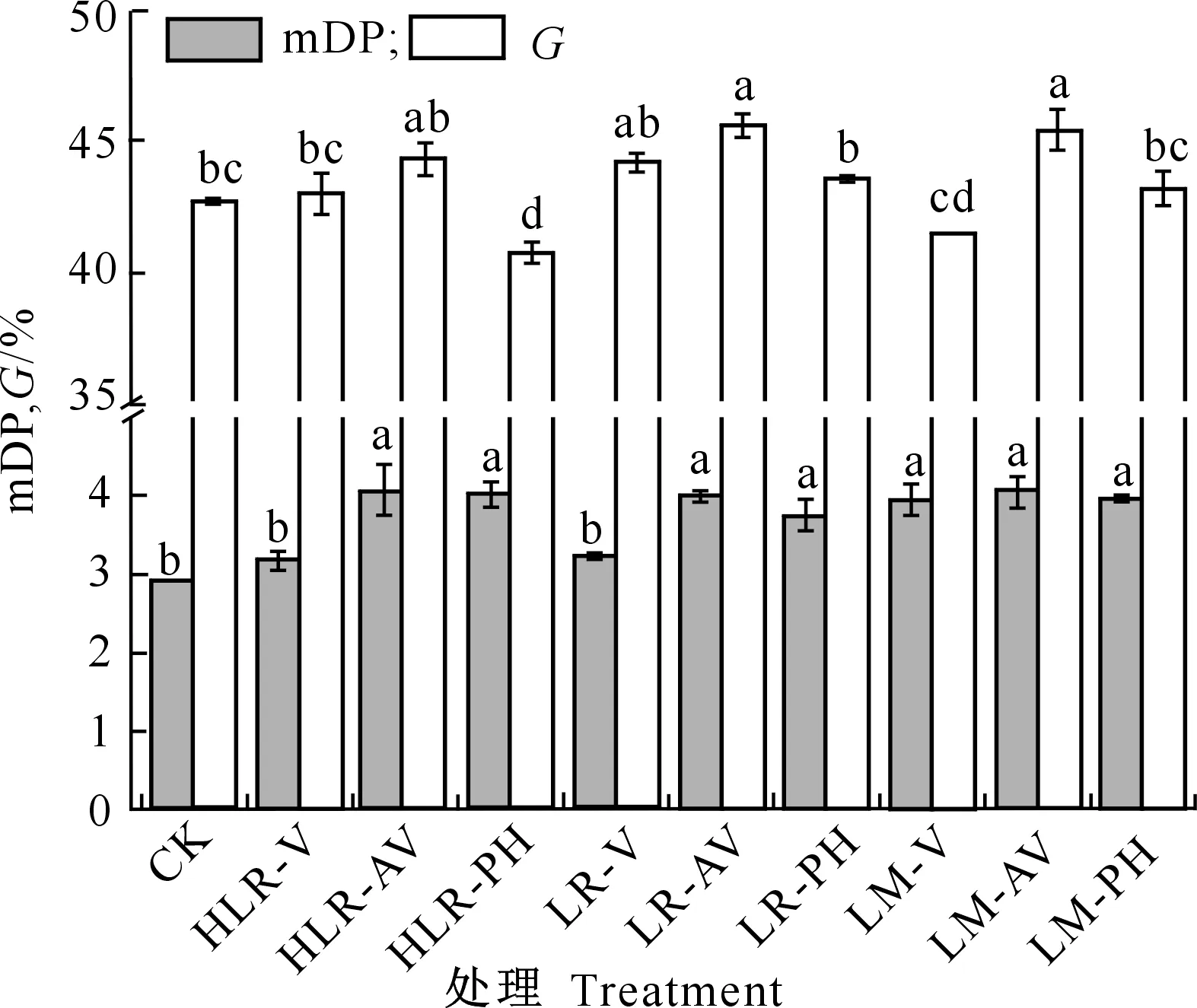
相同颜色柱上标不同字母表示处理间差异显著Different letters on same color bars indicate significant difference at P<0.05图6 摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇类物质mDP和G的影响Fig.6 Influence of leaf removing and leaf moving on mDP and G of flavan-3-ols in grape seeds at harvest
图5显示,随葡萄的生长发育mDP呈现先下降后上升的趋势,至采收时达到2.9。相比mDP的变化,种子G总体呈波动性变化,在花后73 d达到最高值(46.3%),之后又开始缓慢降低,在采收时达到42.8%。
由图6可见,所有摘叶和挪叶处理的mDP值均高于对照,除HLR-V和LR-V处理外,其他处理的mDP值与对照之间均具有显著差异(P<0.05),mDP值基本上在3.8左右波动。对于G而言,HLR-PH处理的G值显著低于对照,降幅为4.7%;LR-AV和LM-AV处理的G值均显著高于对照,增幅分别为6.4%和6.0%,其他处理与对照间均无显著差异。
3 讨 论
在‘赤霞珠’葡萄果实生长发育过程中,种子黄烷-3-醇类物质含量在转色开始时达到最高,在转色过程中大幅度下降,之后含量变化趋势较为平缓。关于转色后种子黄烷-3-醇类物质含量显著降低的原因:一方面,种子中的黄烷-3-醇类物质在转色后发生了氧化和降解作用[26];另一方面,随着果实的发育,大部分黄烷-3-醇形成聚合体并与细胞壁上的多糖和蛋白结合,种子发育后期氧化后的黄烷醇类物质具有更多的多糖和蛋白质结合位点,增加了黄烷醇类物质和细胞壁的结合力,从而降低了种子中可提取的黄烷-3-醇类物质含量[27-29]。
通过对比摘叶和挪叶处理对采收时葡萄种子黄烷-3-醇含量的影响可以发现,仅采收前全摘叶处理的黄烷-3-醇含量显著高于对照,而其他处理与对照之间无显著差异,甚至显著降低。研究发现,在果实的转色阶段,增加光照和温度(例如转色期摘叶和挪叶处理)有利于此阶段黄烷-3-醇类物质的合成[30],但是超过一定温度(>35 ℃),黄烷-3-醇类物质的合成也将受到抑制[31];然而,在果实的成熟阶段,强光照反而会加快黄烷-3-醇的下降速率[32]。因此,强光照和高温可能导致转色期半摘叶、全摘叶和挪叶处理的黄烷-3-醇含量与对照之间无显著差异,甚至显著降低。此外,摘叶处理可对植物造成机械伤害胁迫,而胁迫能促进次生代谢产物的积累[33];同时,在果实的成熟阶段通过摘叶处理能降低库源比,延缓叶片的衰老[34],保证葡萄果实源的供应,从而增加次生代谢产物黄烷-3-醇类物质的合成。因此,造成了采收前全摘叶处理的黄烷-3-醇含量显著高于采收前挪叶处理。
在黄烷-3-醇类物质生物合成的途径中,EC和C由共同的前体物无色花色素形成,EC的C3位与没食子酸发生酯化反应后形成ECG。试验结果表明,‘赤霞珠’葡萄种子中的EC和G均较高,而C的含量较低,说明无色花色素更多流向了EC合成途径。黄烷-3-醇的mDP从转色到成熟过程中有明显增加,其值基本上在1.5~4.0,这与前人的研究结果[27]具有一致性。不同时期的摘、挪叶处理均可以增加mDP和游离单体的含量,降低起始单元的含量,说明摘、挪叶处理增加了起始单元向游离单体的转化,同时在形成聚合体的过程中,游离单体可能主要参与延伸单元的形成。另一方面,较高的mDP也可能与摘叶和挪叶处理增加了聚合的前体物质(黄烷-3-醇单体)有关,但是有关果实发育过程中聚合体的聚合机制,目前研究认为其与光照强度并无关联[35],具体原因有待进一步研究。此外,摘叶和挪叶处理增加了EC在游离单体中的比例,反而降低了其在起始单元中的比例,说明摘叶和挪叶处理有利于起始单元中的EC更多地向游离单体转化。
摘叶处理对葡萄酒化学组成影响的相关研究已有报道,这些化学成分主要包括葡萄酒中的可溶性固形物、酒石酸、挥发性化合物以及原花色素等[36-37]。本试验仅研究了摘叶和挪叶处理对葡萄种子黄烷-3-醇含量及组分的影响,而未进一步进行酿酒试验研究其变化对葡萄酒口感的影响。因此,后续有必要研究不同处理葡萄种子对终产品葡萄酒口感的贡献,以期为进一步找到适宜的栽培管理措施、改善葡萄酒品质提供理论依据。
4 结 论
试验表明,半摘叶、全摘叶与挪叶等处理类型与转色期、转色结束和采收前等处理时期可不同程度地影响葡萄种子黄烷-3-醇的含量及组成,这主要与果实的曝光量、温度和植物的库源关系有关。综合考虑不同时期摘叶和挪叶处理对黄烷-3-醇含量及mDP、G的影响可以发现,采收前全摘叶处理使葡萄种子黄烷-3-醇的含量显著高于对照组,而G与对照之间无显著差异。采收前半摘叶处理的G显著低于其他处理组,而黄烷-3-醇的含量与对照之间不存在显著差异。对于mDP而言,所有处理均可使其值有所增大。所以,为了提高酿酒葡萄的品质,可以采用采收前半摘叶和全摘叶的栽培措施。
