参芪扶正注射液调节多药耐药相关蛋白7改善紫杉醇和吉西他滨非小细胞肺癌耐药
2018-07-23李磊
李 磊
(新汶矿业集团有限责任公司中心医院药学部,新泰 271233)
肺癌临床高发,我国肺癌发病率逐年上升,其中非小细胞肺癌占所有肺癌的75%~80%[1]。非小细胞肺癌目前的首选治疗方法是手术,但对于局部晚期不适合手术的患者及术后治疗,化疗仍是主要手段。
紫杉醇和吉西他滨是临床非小细胞肺癌治疗的主要药物,但临床多药耐药问题严重影响了两药在临床的有效使用[2-3]。肿瘤细胞多药耐药的机制复杂,多种因素均可导致肿瘤多药耐药的发生,其中肿瘤细胞多药耐药相关蛋白的高表达是导致肿瘤药物耐药的最主要原因[4]。多药耐药相关蛋白7(MRP7)是多药耐药相关蛋白家族中的一种,其对紫杉烷类和长春花生物碱类药物具有细胞外排作用[5-6]。研究表明,在使用过紫杉醇(peclitaxel) 或长春瑞滨并产生耐药的非小细胞肺癌细胞中MRP7具有高表达[6]。此外,采用实时定量PCR(RT-PCR)研究证明,在吉西他滨耐药的非小细胞肺癌中MRP7的基因表达也明显增高,基因组学研究表明,在乳腺癌细胞中MRP7的基因高表达是预测吉西他滨耐药的重要指标[7-8]。
参芪扶正注射液是我国传统扶正补气药物,主要成分是党参和黄芪,具有益气扶正、益肺健脾的功效[9-10]。近年临床将参芪扶正注射液用于非小细胞肺癌的辅助治疗,疗效明显。研究表明,参芪扶正注射液配合紫杉醇在治疗非小细胞肺癌中可提高化疗疗效、减轻化疗毒性;配合吉西他滨化疗治疗老年晚期非小细胞肺癌,能减轻化疗的毒性和不良反应[11-14],并通过抑制基质金属蛋白酶9(MMP-9)的活性而抑制肿瘤的生长和转移[15]。研究发现,参芪扶正注射液可通过调节多药耐药基因(multidrug resistanct,MDR1)和肺耐药蛋白(lung resistance protein,LRP)的蛋白表达,改善非小细胞肺癌顺铂耐药[16]。但参芪扶正注射液与紫杉醇和吉西他滨联用提高疗效的作用机制还有待研究。因此,本研究将建立紫杉醇和吉西他滨非小细胞肺癌耐药细胞株,考察参芪扶正注射液对紫杉醇和吉西他滨在非小细胞肺癌耐药方面的改善作用及其机制。
1 仪器与试药
1.1仪器 HF-90型二氧化碳培养箱(中国力康生物科技公司);Tecan Mpro200多功能酶标仪(瑞士Tecan公司);BSC-ⅡA2生物洁净工作台(苏州安泰空气有限公司)。
1.2试药 非小细胞肺癌细胞株A549,购自中国科学院上海细胞库;DMEM培养基、胎牛血清(Fetal bovine serum,FBS),购自GIBCO公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐和MTT,购自Sigma公司,质量分数95%;紫杉醇(质量分数98%,批号325022),吉西他滨(质量分数95%,批号BIFK0023),均购自北京百灵威科技有限公司;甲醇、乙腈均为分析纯(美国Fisher公司);其他试剂均为国产分析纯。
2 方法
2.1紫杉醇和吉西他滨耐药A549细胞的建立 采用逐步增加药物浓度的方法,持续刺激A549细胞,分别建立紫杉醇和吉西他滨耐药细胞,取对数生长期A549细胞,分别加入紫杉醇和吉西他滨使其作用浓度为1和3 nmol·L-1的低浓度持续作用于A549细胞,保证A549细胞在该药物浓度下稳定生长、传代;待细胞适应紫杉醇和吉西他滨并可稳定增殖时,增加紫杉醇和吉西他滨的作用浓度(3和5 nmol·L-1)继续培养,维持药物浓度直至存活细胞能在此浓度下稳定生长、传代;2个月后获得稳定的紫杉醇和吉西他滨非小细胞肺癌耐药细胞株[17]。
2.2MTT法检测紫杉醇和吉西他滨耐药A549细胞存活率 将紫杉醇和吉西他滨耐药A549细胞以2×104个·孔-1接种于96 孔板中,细胞贴壁后,在37 ℃、体积分数为5%的CO2孵箱中孵育24 h,后加入不同浓度的紫杉醇和吉西他滨并设置空白对照,每孔总体积为200 μL,孵育24 h后吸出培养基,每孔200 μL,各浓度设5个复孔,培养12 h,用于MTT检测;每孔加入质量浓度为5 mg·mL-1的MTT溶液100 μL,继续孵育4 h,吸去MTT液;每孔加入200 μL DMSO,振荡15 min,使DMSO充分溶解,在490 nm波长处用酶联免疫检测仪测定各孔吸光度值。
2.3MTT法检测参芪扶正注射液联合紫杉醇和吉西他滨对耐药A549细胞存活率的影响 将紫杉醇和吉西他滨耐药A549细胞以2×104个·孔-1接种于96孔板中,细胞贴壁后,在37 ℃、体积分数为5%的CO2孵箱中孵育24 h后,加入含有不同剂量的参芪扶正注射液的培养基及紫杉醇和吉西他滨并设置空白对照,每孔总体积为200 μL,孵育24 h后吸出培养基,每孔200 μL,各浓度设5个复孔,培养24 h后,用于MTT检测;每孔加入质量浓度为5 mg·mL-1的MTT溶液100 μL,继续孵育4 h后,吸去MTT液;每孔加入200 μL DMSO,振荡15 min,使DMSO充分溶解,在490 nm波长处用酶联免疫检测仪测定各孔吸光度值,以对照组吸光度值为对照,计算细胞相对存活率。
2.4胞内紫杉醇和吉西他滨的浓度检测 将A549细胞及耐药A549细胞以5×106个·孔-1接种于6孔板中,细胞贴壁后培养12 h,在含有10 nmol·L-1紫杉醇和20 nmol·L-1吉西他滨的培养液中培养4 h,用冷PBS缓冲液冲洗2次,以2 700 r·min-1离心5 min,然后用高效液相色谱仪测定细胞内紫杉醇和吉西他滨的含量(浓度用测定每5×106个细胞中的紫杉醇和吉西他滨含量表示)。另外,测定联合给予参芪扶正注射液后,细胞内紫杉醇和吉西他滨的含量。紫杉醇色谱条件为:色谱柱Diamonsil C18(250 mm×4.6 mm,5 μm);柱温:25 ℃;流动相比例为水∶甲醇∶乙腈=25∶40∶35;流速:1 mL·min-1;检测波长:254 nm[18-19]。吉西他滨检测条件:色谱柱Phenomenex C18(250 mm×4.6 mm,5 μm);炔诺酮为内标;流动相为甲醇∶乙腈∶水=40∶30∶30;流速:1.0 mL·min-1;检测波长:227 nm;柱温:40 ℃[20]。
2.5Western Blot实验检测细胞中的MRP7 对数生长期的A549耐药细胞(4×105个·mL-1)接种于6孔板中,其中每板设1孔阴性对照,其余4孔细胞贴壁后加入终浓度为60 mL·L-1的参芪扶正注射液,培养24 h后裂解、收集进行SDS聚丙烯酰胺凝胶电泳,蛋白在质量分数为8%的分离胶中电泳,电泳后转膜,2 h后蛋白条带转移至硝酸纤维素滤膜中,后将滤膜在质量分数为5%的脱脂奶中封闭1.5 h,加入MRP7一抗过夜(1∶500),再加入二抗(羊抗鼠辣根过氧化物酶)2 h,在室温条件下孵育60 min。采用ECL显色曝光,使用凝胶成像系统扫面分析,同时检测GAPDH 蛋白作为内参。
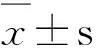
3 结果
3.1紫杉醇和吉西他滨耐药细胞对紫杉醇和吉西他滨的敏感度明显降低 通过MTT实验证明紫杉醇和吉西他滨耐药细胞模型,低剂量紫杉醇和吉西他滨诱导建立的A549耐药细胞株在同等紫杉醇和吉西他滨给药剂量下(紫杉醇:1.25,2.5,5,10,20和40 nmol·L-1,吉西他滨:6.25,12.5,25,50,75和100 nmol·L-1),对A549非小细胞肺癌细胞的抑制率相对于正常A549细胞显著降低,说明紫杉醇和吉西他滨耐药细胞造模成功,见图1。
3.2紫杉醇和吉西他滨耐药细胞内紫杉醇和吉西他滨含量明显降低 采用HPLC法检测A549细胞中紫杉醇和吉西他滨的含量,实验结果见图2。A549耐药细胞内紫杉醇和吉西他滨的浓度显著降低,给予10 nmol·L-1的紫杉醇或25 nmol·L-1的吉西他滨后,正常A549细胞中每5×106个细胞中含有紫杉醇18.2±1.85和3.11±0.74 ng;A549耐药细胞中每5×106个细胞内紫杉醇和吉西他滨含量分别为4.38±0.47和0.74±0.17 ng。耐药细胞中紫杉醇及吉西他滨含量相对于正常A549细胞差异具有统计学意义(*P<0.05)。
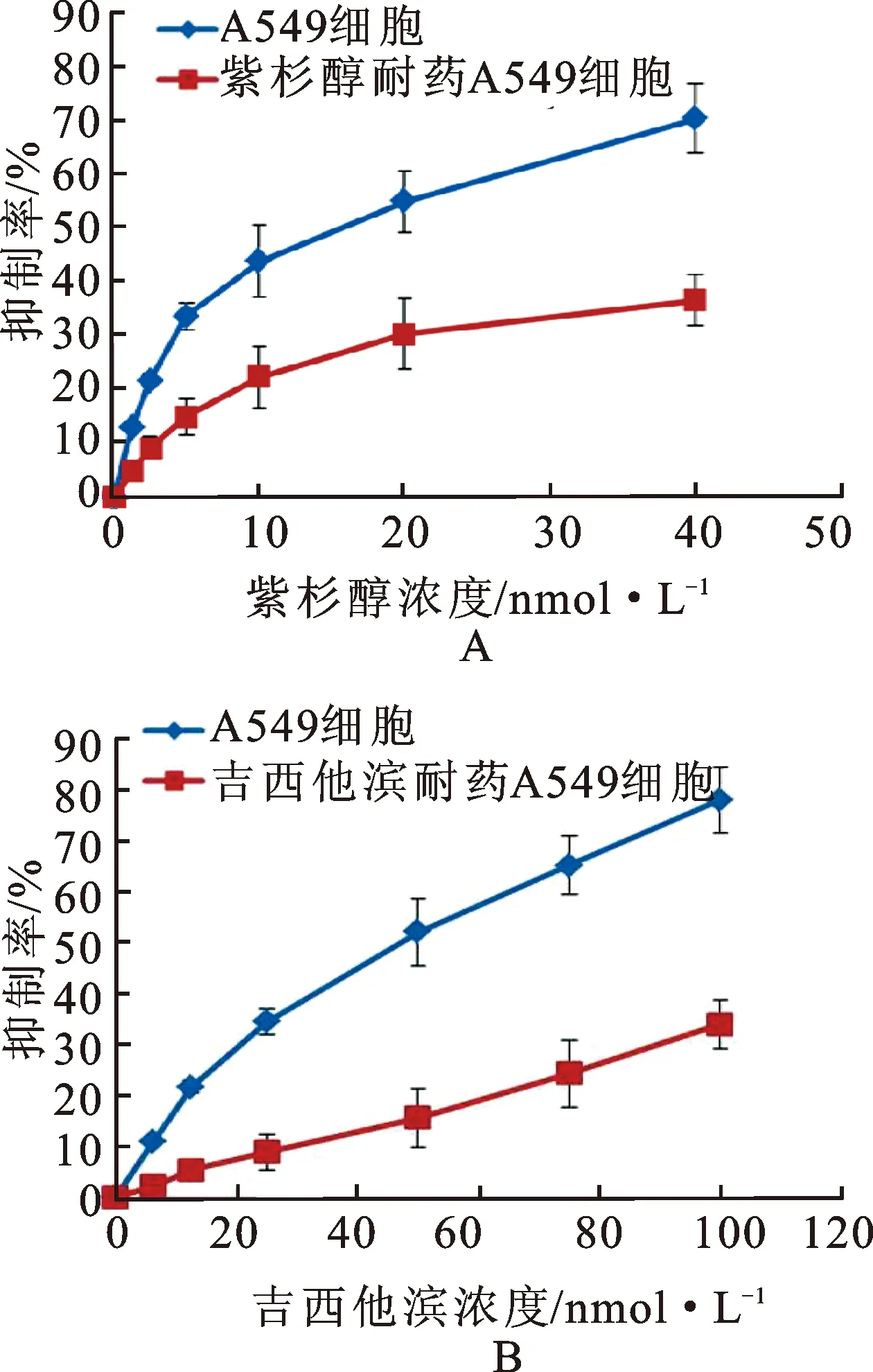
图1非小细胞肺癌细胞及耐药细胞抑制率
A.正常A549细胞与紫杉醇耐药细胞抑制率;B.正常A549细胞与吉西他滨耐药细胞抑制率。(n=3)。
Fig.1 The inhibition rate of normal cells and drug resistance cells
A.the inhibition rate of normal A549 cells and paclitaxel drug resistance cells;B.the inhibition rate of normal A549 cells and gemcitabine drug resistance cells.(n=3).
图2细胞内紫杉醇和吉西他滨的含量
A.正常细胞与紫杉醇耐药细胞;B.正常细胞与吉西他滨耐药细胞。*P<0.05,n=5。
Fig.2 The content of paclitaxel and gemcitabine in cells
A.normal cells and paclitaxel resistance cells;B.normal cells and gemcitabine resistance cells.*P<0.05,n=5.
3.3参芪扶正注射液明显提高紫杉醇和吉西他滨耐药细胞敏感性 在含有不同剂量的(5,15,30和60 mL·L-1)的参芪扶正注射液的培养基中,加入紫杉醇和吉西他滨耐药A549细胞,细胞增殖实验结果见图3,参芪扶正注射液对耐药细胞无明显抑制作用。将含有60 mL·L-1的参芪扶正注射液的培养液与不同浓度紫杉醇5 nmol·L-1(a)和20 nmol·L-1(b)单独与联合作用于A549紫杉醇耐药细胞后,细胞增殖实验结果见图4。紫杉醇20 nmol·L-1组,细胞存活率为73.3%±7.5%,而参芪扶正注射液与等剂量紫杉醇联用后,细胞存活率为52.7%±6.4%,与单一组比较差异具有统计学意义。将含有60 mL·L-1的参芪扶正注射液的培养液与不同浓度吉西他滨单独与联合使用后,实验结果见图5。吉西他滨20 nmol·L-1(a)和45 nmol·L-1(b)单一组细胞存活率分别为92.3%±4.5%和87.3%±4.6%,而等剂量吉西他滨与参芪扶正注射液联用后,细胞存活率分别为80.6%±6.4%和74.7%±4.4%,与单一吉西他滨组比较差异具有统计学意义。

图3参芪扶正注射液对A549耐药细胞抑制率
A.紫杉醇耐药A549细胞;B.吉西他滨耐药A549细胞(n=5)。
Fig.3 The inhibitory rate of Shenqi Fuzheng Injections on resistant A549 cells
A.paclitaxel resistant A549 cells;B.gemcitabine resistant A549 cells (n=5).

图4参芪扶正注射液提高紫杉醇在紫杉醇耐药A549细胞中的敏感性
注:*P<0.05 vs紫杉醇20 nmol·L-1,n=5。
Fig.4 Shenqi Fuzheng Injections improved the sensitivity of paclitaxel in paclitaxel-resistant A549 cells
Note:*P<0.05 vs paclitaxel 20 nmol·L-1,n=5.

图5参芪扶正注射液提高吉西他滨在吉西他滨耐药A549细胞中的敏感性
注:*P<0.05,n=5。
Fig.5 Shenqi Fuzheng Injections improved the sensitivity of gemcitabine in gemcitabine-resistant A549 cells
Note:*P<0.05,n=5.
3.4参芪扶正注射液明显增加紫杉醇和吉西他滨耐药细胞内紫杉醇和吉西他滨浓度 检测细胞中紫杉醇和吉西他滨含量,结果显示,紫杉醇和吉西他滨与参芪扶正注射液联合使用后,紫杉醇耐药A549细胞中每5×106个细胞内含有紫杉醇7.20±1.27 ng,吉西他滨耐药A549细胞中每5×106个细胞内含有吉西他滨1.5±0.41 ng;与单一给药组比较,每5×106个细胞内分别含有紫杉醇和吉西他滨4.38±0.47和0.74±0.17 ng,差异具有统计学意义(*P<0.05),见图6。

图6参芪扶正注射液提高紫杉醇和吉西他滨耐药A549细胞中紫杉醇和吉西他滨的含量
注:*P<0.05 vs单一给药,n=5。
Fig.6 Shenqi Fuzheng Injections enhanced the content of paclitaxel and gemcitabine in paclitaxel or gemcitabine-resistant A549 cells.
Note:*P<0.05 vs single drug,n=5.
3.5参芪扶正注射液明显抑制紫杉醇和吉西他滨耐药细胞中的MRP7表达 Western Blot实验结果表明,紫杉醇和吉西他滨诱导的A549耐药细胞中MRP7明显升高,但给予参芪扶正注射液可显著降低耐药细胞中MRP7表达,见图7。
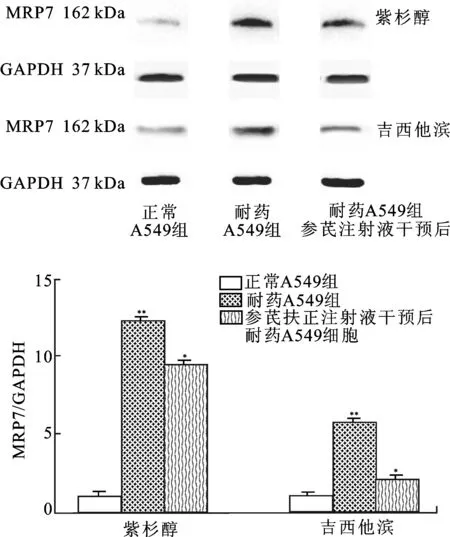
图7参芪扶正注射液对紫杉醇和吉西他滨诱导的A549耐药细胞中MRP7的影响
注:与正常A549细胞比较,**P<0.01;与耐药A549细胞比较,*P<0.05,n=3。
Fig.7 The effect of Shenqi Fuzheng Injections on MRP7 in paclitaxel or gemcitabine-induced multidrug resistance A549 cells
Note:compared with normal A549 cells,**P<0.01;compared with drug resistant A549 cells,*P<0.05,n=3.
4 讨论
肿瘤细胞多药耐药是临床肿瘤治疗面临的重要问题,紫杉醇和吉西他滨是临床非小细胞肺癌治疗的主要用药,而耐药是导致紫杉醇和吉西他滨临床治疗失败的主要原因。近期研究发现,MRP7在紫杉醇和吉西他滨等非铂类肿瘤药物的耐药中具有重要作用,可减少肿瘤细胞中肿瘤药物浓度和肿瘤药物细胞毒性作用。本研究通过建立非小细胞肺癌紫杉醇和吉西他滨耐药细胞株,表明紫杉醇和吉西他滨耐药细胞对紫杉醇和吉西他滨敏感性显著降低,其中MRP7蛋白表达升高,通过HPLC法检测胞内紫杉醇和吉西他滨含量,结果表明,2种肿瘤药物在细胞中的含量显著降低;但将参芪扶正注射液与紫杉醇和吉西他滨联合给药后,在紫杉醇和吉西他滨耐药剂量下,可提高该剂量下对细胞增殖的抑制作用;提高细胞中紫杉醇和吉西他滨含量,降低耐药细胞中MRP7的表达。
化疗在非小细胞肺癌NSCLC的治疗中至关重要,而多药耐药是导致化疗失败的重要原因。MRP7是新近发现的ATP结合盒式蛋白(ATP-bindingcassette transporter,ABC)家族C族成员,报道显示,ABC家族膜转运体在MDR中起主要作用,MRP7通过外排功能导致化疗药物从肿瘤细胞中向外排出细胞,导致化疗药物靶浓度减少,疗效降低。早期研究发现,MRP7在紫衫醇耐药中发挥着重要作用,但在吉西他滨的耐药中存在争议,近期研究发现,采用MRP7抑制剂千金藤素作用于非小细胞肺癌细胞可明显提高吉西他滨的疗效[7],此外基因组学研究表明,MRP7的高表达在吉西他滨肿瘤耐药中是重要预测指标[8]。实验发现,参芪扶正注射液对非小细胞肺癌紫杉醇和吉西他滨耐药细胞MRP7具有一定的抑制作用,可提高肿瘤细胞中紫杉醇和吉西他滨的含量。因此,参芪扶正注射液提高肿瘤患者的化疗效果与抑制MRP7具有一定的关系。而紫杉醇和吉西他滨肿瘤耐药的作用机制复杂,与多药耐药蛋白家族及P-糖蛋白、微管蛋白和热休克蛋白基因等均有关系[21-22],因此针对参芪扶正注射液对非小细胞肺癌紫杉醇和吉西他滨耐药细胞的逆转作用机制还有待进一步研究。
