共水蒸馏当归川芎挥发油工艺优化及隔水蒸馏GC-MS的比较
2018-07-23杨范莉史亚军崔春利邹俊波张小飞
齐 菲,杨范莉,史亚军,崔春利,邹俊波,张小飞
(1.陕西中医药大学,西安 712046;2.西安交通大学药学院,西安 710061)
中药药对是临床上常用的配伍形式,虽然组成相对简单,但它具有中药配伍的基本特点[1]。药对配伍是研究复方配伍规律的基础和重要切入点之一,了解药对配伍的化学成分变化,有利于阐述复方中药配伍的机制[2-4]。当归、川芎伍用,名曰佛手散,又名芎归散,出自《普济本事方》,主治妊娠伤胎、难产、胞衣不下等。《医宗金鉴》云:“命名不曰归芎,而曰佛手者,谓妇人胎前、产后诸症如佛手之神妙也。当归、川芎为血分之主药,性温而味甘辛,以温能活血,甘能补血,辛能散血也。”当归川芎配对可协同增强养血活血、活血袪瘀及调经止痛的功效,是临床常用的养血活血药对。当归和川芎药材均含挥发油,文献报道[5],当归和川芎的挥发油成分是这2种中药的有效成分之一。
提取挥发油最常用的是水蒸气蒸馏法[6]。到目前为止,实验室多用共水蒸馏,工业上生产以隔水蒸馏为主,后者是安装一块多孔的隔板,将中药置于板上,水放在板下,水面距离板有相当距离。本实验采用Box-Behnken设计原理和方法[7-11],确定共水蒸馏提取药对挥发油的最佳工艺条件,利用GC-MS[12-13]分析共水蒸馏与隔水蒸馏单味药与药对及配伍前后的挥发油成分变化,比较2种方法提取挥发油,并为阐释药对当归川芎物质基础提供实验依据。
1 仪器与试药
1.1仪器 7890B-5977B气相色谱-质谱联用分析仪(GC-MS,美国Agilent公司);分析天平(上海佑科仪器仪表有限公司);中药粉碎机(QE-400克,浙江屹立工贸有限公司);挥发油提取器(郑州市中原区兴华玻璃仪器厂);MH型电子调温电热套(科伟电热仪器有限公司)。
1.2试药 当归、川芎饮片(陕西兴盛德药业有限责任公司);正己烷(色谱纯,批号20170815),无水硫酸钠(分析纯,批号20170320),均购自天津市科密欧化学试剂有限公司。
2 实验方法
2.1药对当归川芎挥发油的提取方法 分别将当归、川芎药材粉碎过筛,精密称取药材粉末各30 g,根据《中国药典》2015年版四部通则2204,采用共水蒸馏法进行挥发油提取,精密测定挥发油体积,计算挥发油得率。
2.2供试品溶液的制备 在挥发油中分别加入无水硫酸钠除水,精密吸取除过水的挥发油各0.1 mL,置于10 mL量瓶中,用正己烷定容,即得。
2.3挥发油的测定条件
2.3.1色谱条件 色谱分离采用HP-5MS毛细管色谱柱,载气为氦气,以1 mL·min-1恒定的流速通过HP-5MS毛细管柱,进样量:1 μL;进样口温度:310 ℃;柱温程序:100 ℃,保持3 min,以3 ℃·min-1升至170 ℃,再以2 ℃·min-1升至210 ℃,再以8 ℃·min-1升至250 ℃,保持5 min。
2.3.2质谱条件 离子源:电子轰击离子源(EI);离子源温度:280 ℃;接口温度:280 ℃;四级杆温度:150 ℃;检测电压:70 eV;质量扫描范围(m/z):40~700 amu。
2.4挥发油的GC-MS分析 将2.2项下制备的供试品溶液按照2.3项下条件进行分析,得到总离子流图,见图2。采用NIST质谱数据库检索并进行比对,应用峰面积归一化法计算挥发油中各化学成分的相对百分含量[14-18]。
3 实验结果
3.1单因素实验 以不同的提取时间、料液比和浸泡时间3个因素为指标,考察3个不同条件下挥发油得率和药对提取的条件。
3.1.1共水蒸馏提取时间对药对挥发油得率的影响 每次实验取药对粗粉60 g,在料液比1∶10和浸泡1 h的条件下,按照2.1项下方法提取,提取时间选取2,4,6,8和10 h 5个水平进行实验。结果显示,提取时间在8 h时挥发油得率不再明显增高,故以8 h作为提取时间。
3.1.2料液比对药对挥发油得率的影响 每次实验取药对粗粉60 g,浸泡1 h提取8 h的条件下,按照2.1项下方法提取,料液比选取1∶4,1∶6,1∶8,1∶10和1∶12进行实验,得出料液比为1∶10时挥发油得率最高,故以1∶10作为料液比。
3.1.3浸泡时间对药对挥发油得率的影响 每次实验取药对粗粉60 g,在提取8 h,料液比为1∶10的条件下,按照2.1项下方法提取,浸泡时间选取0,0.5,1,1.5和2 h 5个水平进行实验,结果浸泡1 h时挥发油得率最高,故以1 h作为浸泡时间。
3.2响应面设计实验
3.2.1Box-Behnken响应面法优化共水蒸馏提取挥发油工艺 在单因素实验的基础上,选取影响药对挥发油提取工艺的3个因素:提取时间(X1)、浸泡时间(X2)和料液比(X3)为考察对象,以药对挥发油提取率(%)为评价指标,采用3因素3水平的Box-Behnken响应面法优化药对挥发油提取工艺,因素水平见表1,提取工艺参数实验安排及结果见表2。
表1响应面分析实验的因素与水平
Tab.1 Factors and levels of response surface analysis experiment

编码水平因素低(-1)中(0)高(1)提取时间(X1)/h6810浸泡时间(X2)/h0.511.5料液比(X3)/g·mL-11∶81∶101∶12
表2响应面分析实验结果
Tab.2 Experimental results of the response surface analysis
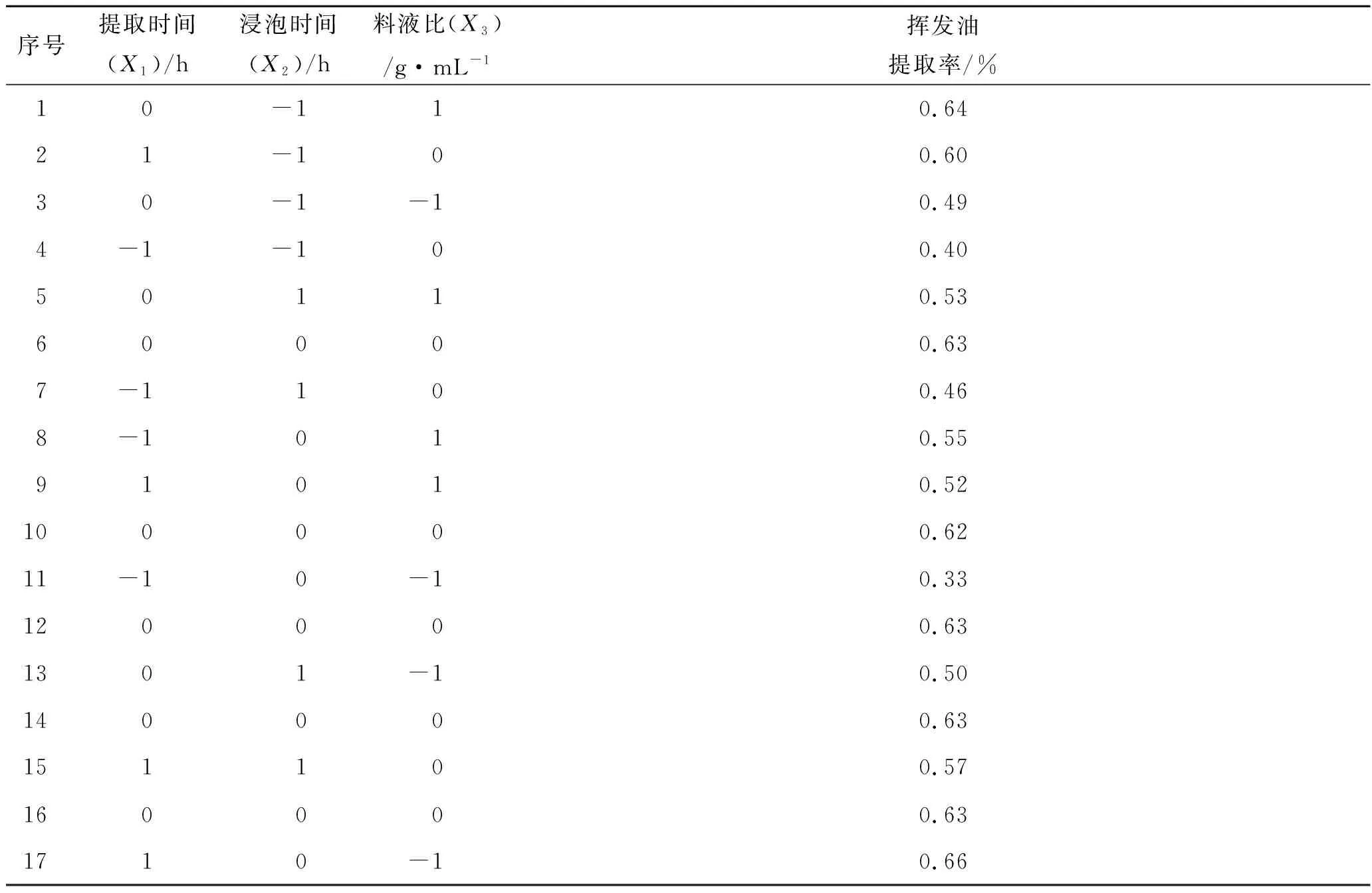
序号提取时间(X1)/h浸泡时间(X2)/h料液比(X3)/g·mL-1挥发油提取率/%10-110.6421-100.6030-1-10.494-1-100.4050110.5360000.637-1100.468-1010.5591010.52100000.6211-10-10.33120000.631301-10.50140000.63151100.57160000.631710-10.66
3.2.2建立模型方程与显著性检验 利用软件Design Expert 8.0.6对实验结果进行多元回归拟合分析,得到挥发油得率与各因素变量的二次方程模型:Y(%)=0.628 0+0.076 250×A-0.008 75×B+0.032 5×C-0.022 5×A×B-0.09×A×C-0.03×B×C-0.072 75×A2-0.047 750×B2-0.040 250×C2,对回归方程进行显著性检验,结果见表3。
该方程的相关系数r=0.987 6,接近于1,从拟合方程的相关系数可知,多元二次项拟合方程r较高,且实验模型P<0.000 1,结果表明,回归方程模型拟合度好。
表3回归模型方差分析结果
Tab.3 Variance analysis results of regression model

方差来源平方和自由度均差FP常数项0.1490.01530.72<0.000 1 A-A0.04710.04794.24<0.000 1 B-B0.000 612 510.000 612 51.240.302 1 C-C0.008 4510.008 45017.120.004 4 AB0.002 02510.002 0254.100.082 5 AC0.03210.03265.64<0.000 1 BC0.003 610.003 67.290.030 6 A^20.02210.02245.150.000 3 B^20.009 610.009 619.450.003 1 C^20.006 82110.006 82113.820.007 5残差0.003 45570.000 493 6失拟项0.003 37530.001 12556.250.001 0纯误差0.000 0840.000 05总和0.1416
由表3可知,提取时间和料液比对药对挥发油提取率影响较为显著,二次项、交互项交互对挥发油提取的曲面效应极显著。失拟项F值为0.406,表明失拟项相对于绝对误差不显著,而不显著的失拟项是可取的,说明该回归方程对实验拟合情况较好,该模型能较好地描述实验。
3.2.3响应面分析 响应面图形是响应值对因素A、B、C所构成的三维空间曲面图,从响应面图上可看出各参数之间的相互作用,结果见图1。由图1可知,提取时间和浸泡时间之间的交互作用较为显著。沿A轴的等高线密度变化相对沿B轴的变化较大,说明提取时间对挥发油得率的影响比浸泡时间的影响大。
3.2.4验证实验 根据软件Design Expert 8.0.6分析,药对挥发油的最佳提取工艺条件为提取时间8 h,料液比为1∶8,浸泡时间为0.5 h,药对挥发油得率的理论值可达0.689%。实际测得的挥发油得率为0.66%,RSD值为0.87%,与理论值相符,因此基于响应面法优化的提取工艺条件准确可靠。
3.3隔水蒸馏提取药对挥发油 用响应面优化的最优条件,用隔水蒸馏提取当归川芎挥发油,平均提取率为0.63%±1.59%(n=3)。
3.4GC-MS结果分析 见图2和表4。
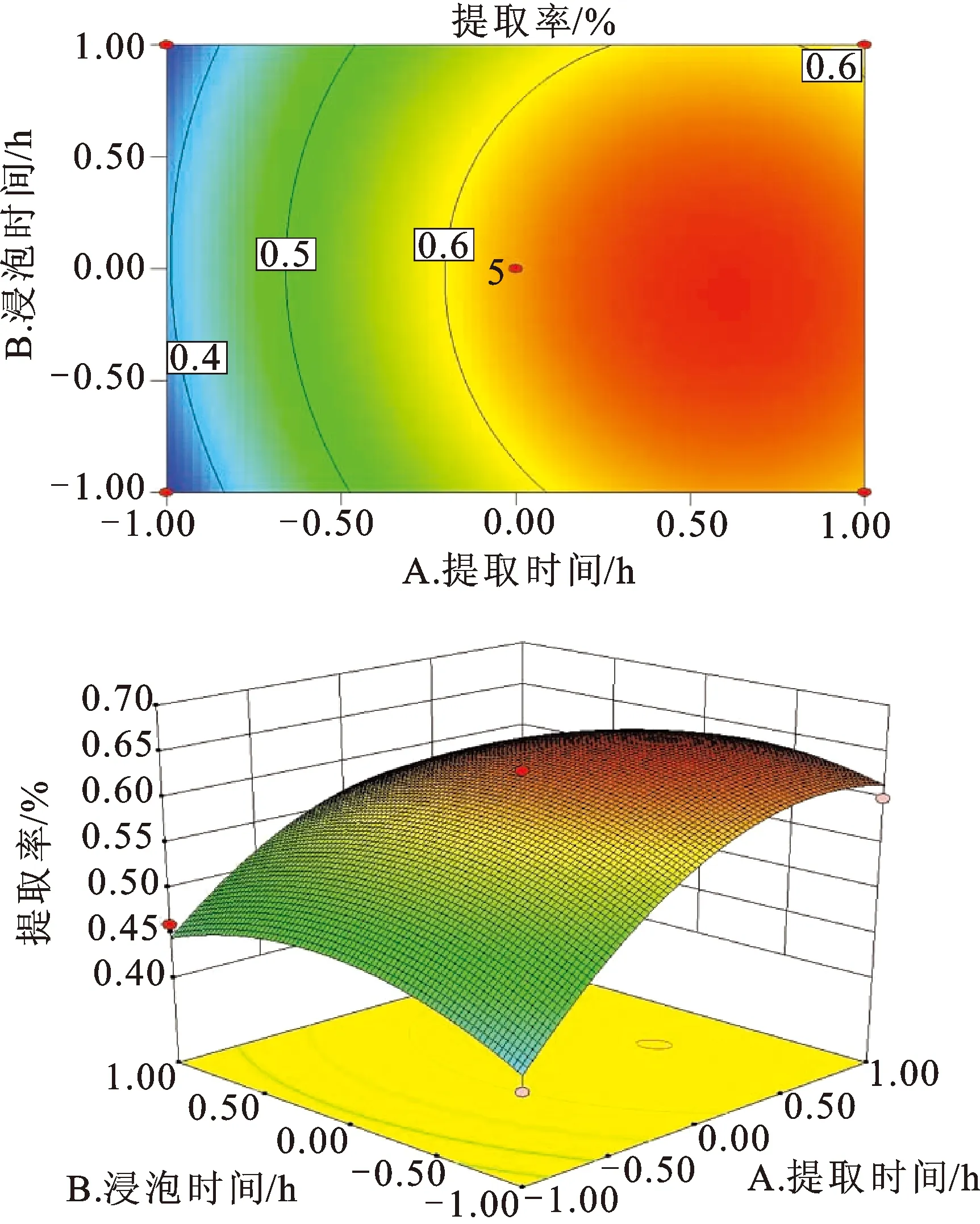
图1响应面曲线图
Fig.1 The response surface curve

图2总离子流图
A.共水蒸馏当归离子流图;B.隔水蒸馏当归离子流图;C.共水蒸馏川芎离子流图;D.隔水蒸馏川芎离子流图;E.共水蒸馏当归川芎离子流图;F.隔水蒸馏当归川芎离子流图。
Fig.2 The graph of total ion current
A.common water distillation ofAngelicasinensis(Oliv.) Diels;B.separated water distillation ofAngelicasinensis(Oliv.) Diels;C.common water distillation ofLigusticumchuanxiongHort;D.separated water distillation ofLigusticumchuanxiongHort;E.common water distillation ofAngelicasinensis(Oliv.) Diels andLigusticumchuanxiongHort;F.separated water distillation ofAngelicasinensis(Oliv.) Diels andLigusticumchuanxiongHort.
表4化学分析结果
Tab.4 The results of chemical analysis
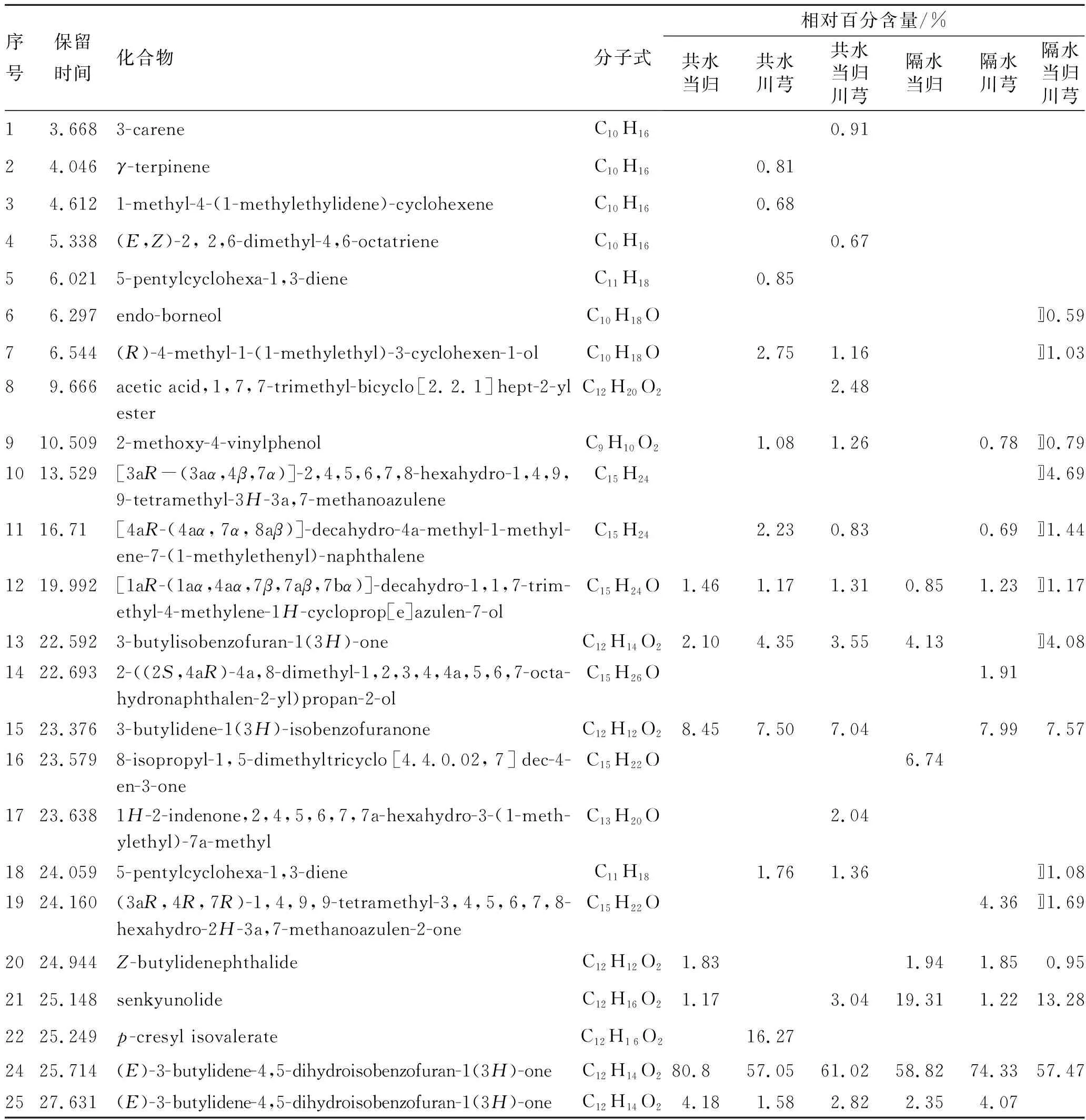
序号保留时间化合物分子式相对百分含量/%共水当归共水川芎共水当归川芎隔水当归隔水川芎隔水当归川芎13.6683-careneC10H160.9124.046γ-terpineneC10H160.8134.6121-methyl-4-(1-methylethylidene)-cyclohexeneC10H160.6845.338 (E,Z)-2, 2,6-dimethyl-4,6-octatrieneC10H160.6756.0215-pentylcyclohexa-1,3-dieneC11H180.8566.297endo-borneolC10H18O〛0.5976.544(R)-4-methyl-1-(1-methylethyl)-3-cyclohexen-1-olC10H18O2.751.16〛1.0389.666acetic acid,1,7,7-trimethyl-bicyclo[2.2.1]hept-2-yl esterC12H20O22.48910.5092-methoxy-4-vinylphenolC9H10O21.081.260.78〛0.791013.529[3aR-(3aα,4β,7α)]-2,4,5,6,7,8-hexahydro-1,4,9,9-tetramethyl-3H-3a,7-methanoazuleneC15H24〛4.691116.71[4aR-(4aα,7α,8aβ)]-decahydro-4a-methyl-1-methyl-ene-7-(1-methylethenyl)-naphthaleneC15H242.230.830.69〛1.441219.992[1aR-(1aα,4aα,7β,7aβ,7bα)]-decahydro-1,1,7-trim-ethyl-4-methylene-1H-cycloprop[e]azulen-7-olC15H24O1.461.171.310.851.23〛1.171322.5923-butylisobenzofuran-1(3H)-oneC12H14O22.104.353.554.13〛4.081422.6932-((2S,4aR)-4a,8-dimethyl-1,2,3,4,4a,5,6,7-octa-hydronaphthalen-2-yl)propan-2-olC15H26O1.911523.3763-butylidene-1(3H)-isobenzofuranoneC12H12O28.457.507.047.997.571623.5798-isopropyl-1,5-dimethyltricyclo[4.4.0.02,7]dec-4-en-3-oneC15H22O6.741723.6381H-2-indenone,2,4,5,6,7,7a-hexahydro-3-(1-meth-ylethyl)-7a-methylC13H20O2.041824.0595-pentylcyclohexa-1,3-dieneC11H181.761.36〛1.081924.160(3aR,4R,7R)-1,4,9,9-tetramethyl-3,4,5,6,7,8-hexahydro-2H-3a,7-methanoazulen-2-oneC15H22O4.36〛1.692024.944Z-butylidenephthalideC12H12O21.831.941.850.952125.148senkyunolideC12H16O21.173.0419.311.2213.282225.249p-cresyl isovalerateC12H16O216.272425.714(E)-3-butylidene-4,5-dihydroisobenzofuran-1(3H)-oneC12H14O280.857.0561.0258.8274.3357.472527.631(E)-3-butylidene-4,5-dihydroisobenzofuran-1(3H)-oneC12H14O24.181.582.822.354.07
由表4可知,当归川芎挥发油化学成分种类较多。挥发油主要成分均为藁苯内酯,其含量最高。两者均含有Z-正丁烯基苯酞,但当归挥发油中的含量高于川芎挥发油,且共水大于隔水。在当归、川芎挥发油中检测到苯酞类、萜类和脂肪酸类等成分,其含量见图3。由图3可知,苯酞类含量较高。整体来看,共水蒸馏的含量大于隔水蒸馏的含量,但隔水蒸馏川芎中藁本内酯含量高于共水蒸馏;脂肪酸类成分,隔水蒸馏当归川芎的含量大于共水蒸馏当归川芎,隔水蒸馏提取药对藁本内酯含量下降,但脂肪酸类含量增多。
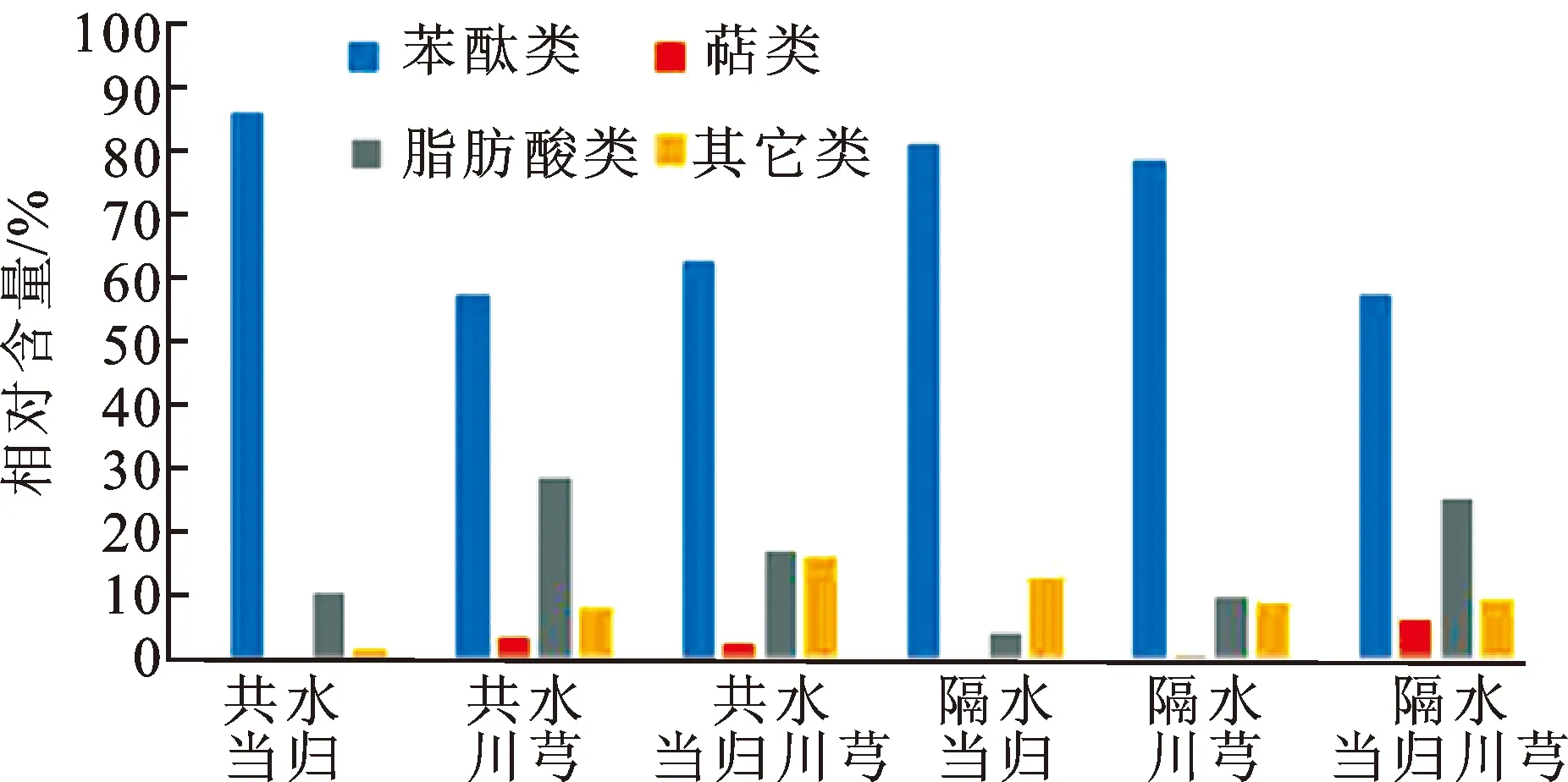
图3各类成分含量
Fig.3 The content of various components
4 讨论
4.1挥发油提取工艺优化 应用Box-Behnken响应面法对当归川芎药对提取工艺进行优化,实测药对挥发油提取率与预测值基本一致。通过对药对挥发油的提取工艺进行响应面优化,得到药对挥发油的最佳提取工艺,所得结果提取率高、重复性好。但挥发油的提取不仅要重视得率,还应观察挥发油的化学成分和生物药效的变化。
4.2挥发油GC-MS分析 通过共水蒸馏和隔水蒸馏提取中药挥发油,共水蒸馏是将含有挥发性成分的药材与水共同蒸馏,使挥发性成分随水蒸气一并馏出,中药在水中浸泡时间长,因此芳香性物质会有一部分留在水中,不能被提取出来。隔水蒸馏对芳香性物质较易蒸馏,可加快蒸馏速度,中药没有在水中浸泡,因此对芳香性物质损失较少。结果表明,共水蒸馏得到挥发油的含量、种类高于隔水蒸馏,有可能是药材在水中浸泡,溶出其他物质所得。
当归和川芎都为伞形科,所含化学物质有许多相似的,主要功效物质为藁本内酯和芳香酸类成分,这2类物质对心脑血管系统和免疫功能有很好的调节作用[19]。当归治疗痛经的效果优于川芎,但川芎治疗血瘀头痛的效果优于当归;当归具有润肠通便、抗辐射损伤的作用,但川芎没有,川芎具有解热作用,但当归却没有[20-21],2种药材可优势互补。GC-MS分析中,随着程序升温,温度升高,所得化合物相对分子质量变大,成分变复杂。药对提取挥发油具有加和性,但并非简单加和,与单味药比较,当归和川芎药物配伍使挥发油含量增加,为后续研究比较提取单味药挥发油与药对挥发油成分差异提供依据。
