肿瘤异常蛋白及血清肿瘤标记物测定在乳腺癌新辅助化疗效果评估中的意义
2018-07-20宋颖
宋颖
乳腺癌属于最常见的恶性肿瘤之一,女性乳腺是由皮肤、纤维组织、乳腺腺体和脂肪组成,乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤。原位乳腺癌并不致命,但由于乳腺癌细胞丧失了正常细胞的特性,细胞之间连接松散,容易脱落,使得游离的癌细胞可以随血液或淋巴液播散全身,形成转移,危及生命[1]。随着医疗技术的不断发展与进步,乳腺癌的预后效果也得到了极大的提升。在临床治疗中,新辅助化疗已成为治疗乳腺癌的常用方法,其又称为术前治疗,是针对局部晚期肿瘤患者在实施手术前,对其进行系统性、全身性细胞毒性药物治疗,促使不可手术变为可手术,不能保乳治疗的变为可保乳治疗,对提高患者的生活质量具有重要意义。同时新辅助化疗,可有效控制病灶细胞向远处微转移,提高化疗药物的敏感性。通过辅助化疗达到病灶完全缓解的目的,有效改善患者生存率。在治疗过程中,血清肿瘤标记物,在评估和监测肿瘤细胞是否转移及复发中具有一定的作用[2]。肿瘤异常蛋白是一种新型的肿瘤标记物,当肿瘤细胞分泌的肿瘤异常蛋白达到一定程度时,就会在血液中检出,可有效评估乳腺肿瘤的发展。该次研究基于以上背景,对该院自2015年12月—2017年1月收治的72例乳腺癌患者作为研究对象,针对性分析肿瘤异常蛋白及血清肿瘤标记物测定在乳腺癌新辅助化疗效果评估中的意义,现汇报如下。
1 资料与方法
1.1 一般资料
随机抽取72例该院收治的乳腺癌患者作为研究目标,所有患者均实施乳腺癌新辅助化疗治疗,回顾相关资料,根据治疗效果将其分为对照组(n=36)、研究组(n=36),研究组患者为病情完全缓解与部分缓解,对照组患者为病情稳定与病情进展者。对照组年龄38.12~65.38岁,平均年龄(52.45±11.10)岁,肿瘤直径 1.8~5.1 cm,平均直径(3.4±1.3)cm; 研究组年龄 36.25~64.23 岁, 平均年龄(51.56±10.09)岁,肿瘤直径 1.9~5.3 cm,平均直径(3.3±1.4)cm。将两组患者基线资料进行对比分析,差异无统计学意义(P>0.05)。排除标准:先天性心肺疾病者;宫内感染引起脑损伤者:腋窝淋巴转移者;远处转移者。该次研究经本院伦理委员会批准,并全程跟进。所有患者及其家属均了解该次研究方法,并签署知情同意书。
1.2 方法
1.2.1 治疗方法
所有患者入院后,均进行相应体征检查,确诊病情后,均实施辅助治疗,即给予患者NCT治疗,应用表柔比星(国药准字H20000496)、环磷玲酰胺(国药准字H21022578)序贯,连续治疗4个周期;紫杉醇(进口药品注册证号H20090175),Her-2基因扩增的患者同时接受曲妥珠(注册证号S20050008)单抗治疗,连续治疗4个周期。以上两组患者均应用此治疗措施,共治疗8个周期。
1.2.2 监测评估方法
所有患者于化疗前后,均采集其空腹末梢静脉血,对肿瘤标记物中的黏蛋白抗原类标记物CA15-3、CA125、胚胎型抗原标记物CEA浓度,应用化学发光方法进行测定。肿瘤异常蛋白检测(TAP)检测方法如下:先采集患者的2 mL静脉血,将其制作成血涂片,之后将事先准备好的凝集素滴加于血涂片上,待其自然干燥后,送到病理科室,由专业医生在显微镜下对其进行观察,察看凝聚物的颗粒,并对凝聚物面积的大小进行测量,进而将肿瘤异常蛋白数值记录下来[3-4]。
1.3 分析指标
根据辅助化疗效果,将72例患者分为两组,即研究组与对照组,研究组患者病情完全缓解与部分缓解,对照组患者病情稳定与病情进展者。分析对比两组患者化疗前后的CA15-3、CA125、胚胎型抗原标记物CEA、TAP的数值。
1.4 统计方法
应用SPSS 22.0统计学意义软件分析该文数据,计量资料行 t检验,采用(x±s)表示;计数资料行 χ2检验,采用(%)表示,P<0.05为差异有统计学意义。
2 结果
2.1 比较两组肿瘤标记物的数值差异
化疗前,肿瘤标记物差异无统计学(P>0.05);化疗后,肿瘤异常蛋白两组对比差异有统计学意义(P<0.05),见表1。

表1 两组患者肿瘤标记物的数值差异比较(x±s)
2.2 两种数值变化情况
化疗前后两组数值均有升降(P<0.05);但 CA125、CEA化疗前后数值升降差异无统计学意义(P>0.05),见表2。
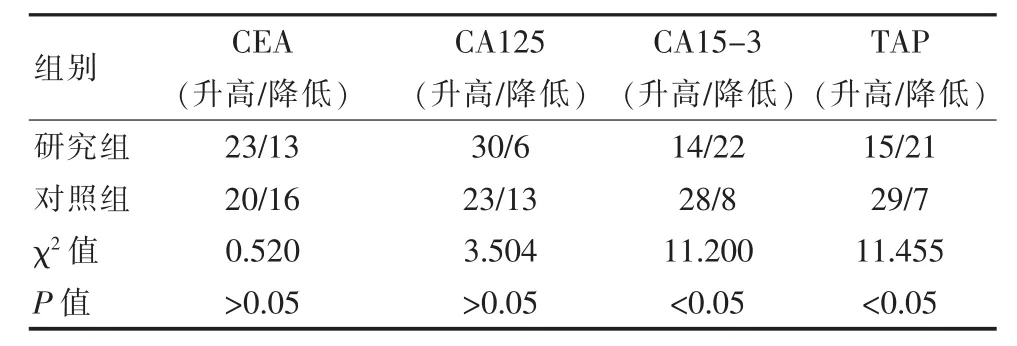
表2 两组数值变化情况比较
3 讨论
乳腺癌属于临床常见病、多发病,对患者生命健康造成严重影响。在临床治疗中,多采用新辅助治疗。针对新辅助治疗效果的评价,主要是通过病理学及临床效果进行评价,临床效果评价,有影像学、临床触诊评估,但临床触诊易受医生主观因素的影响,且对深部肿块不能评估,易出现评估误差;而影像学评估虽具有可重复操作性、便捷等特点,但其费用较高,易增加患者的济经负担;病理学评估,具有准确性高特点,但病理评估须在手术后检查,易错失最佳治疗方案[5-6]。因此,对乳腺癌临床疗效进行评估时,采取有效评估方式尤为重要。
肿瘤异常蛋白属于新型的肿瘤标记特,其预防与诊断意义在恶性肿瘤的具有一定的作用。该次研究显示,肿瘤异常蛋白实验组升高者15例、降低者21例;对照组肿瘤异常蛋白高者29例、降低者7例(P<0.05)。此外研究结果与陈锐等人[1]的研究结果相似[反应组TAP升高13例、降低26例、无反应组升高14例、无反应5例(P<0.05)。由此可知,肿瘤异常蛋白水平,在乳腺癌化疗后,实验组降低者低于对照组,而升高患者治疗效果并不明显。同时在化疗前,肿瘤异常蛋白两组对比差异无统计学意义 (P>0.05),但化疗后两组差异有统计学意义(P<0.05)。 由此可以说明,当肿瘤异常蛋白出现明显差异时,通过升降变化,可将乳腺癌临床疗效很好的评估出来,具有一定意义[7-9]。血清肿瘤标记物包括CA15-3、CA125、CEA,其在评估乳腺癌的早期诊断及预后效果具有一定的作用。其中CA15-3是一种肿瘤相关抗原,也属于黏蛋白膜型蛋白,其在辅助化疗前后,其可有效提高肿瘤负荷,在一定程度时可有效反映乳腺癌化疗的效果。CA125属于肿瘤特异性标记物,其在乳腺癌的表达中,具有一定效果。CEA是从胎儿肠组织及结肠腺癌中提取出的一种非特导性肿瘤相关抗原,其在乳腺癌中有一定的表达作用,但敏感性较低[10-12]。该次研究显示,以上3种肿瘤标志物,在辅助治疗前两组差异无统计学意义;化疗后CA15-3、CA125、CEA较治疗前有明显降低(P<0.05);尤其是CA15-3可对辅助治疗结果进行评估,具有一定的意义。
综上所述,肿瘤异常蛋白及血清肿瘤标记物测定在乳腺癌新辅助化疗效果评估中具有一定的意义,可在临床中推广应用。
