4-羟基-2,2,6,6-四甲基哌啶对糖尿病大鼠肾脏氧化应激水平的影响
2018-07-19
(山西职工医学院,山西 太原 030012)
糖尿病(diabetes mellitus,DM)是一种以高血糖为特征的代谢性疾病,高血糖的原因包括胰岛素分泌缺陷或其生物作用受损,糖尿病存在的高血糖会导致器官组织损伤,功能受损[1]。近年来我国糖尿病的患病率呈直线上升趋势,患病人数已达4 000万,其中糖尿病肾病的患病率为33.3%。所以糖尿病患者最常见的慢性并发症和最终致死原因即糖尿病肾病,它严重威胁着患者的生活质量和生命安全。目前,我国的糖尿病已上升为仅次于慢性肾炎所引起终末期肾脏疾病的第二大原因[1]。因此, 糖尿病肾病发病机制和防治方法成为现代医学非常重要的研究方向。研究资料表明糖尿病所产生的血管并发症无论大血管,还是微血管,其发病机制均相同,即高糖损伤的共同基础--氧化应激[2]。新型抗氧化剂4-羟基-2,2,6,6-四甲基哌啶(tempol)是超氧化物歧化酶的相似物,有歧化超氧阴离子的效果,但是其否可以对抗糖尿病肾病的氧化应激过程,作为其治疗药物使用,则尚未见有关文献报道,且其抗氧化机制目前也并不十分清楚。本研究先使用部分大鼠制造糖尿病模型,再用Tempol干预,最后检测大鼠肾脏的氧化应激状态,来阐明Tempol的抗氧化效果,为糖尿病肾病的防治提供新的思路和方法,报告如下。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 成年健康雄性Sprague-Dawley(SD)大鼠(山西医科大学实验动物中心,清洁级),体重(250±25)g。
1.1.2 主要试剂仪器 4-羟基-2,2,6,6-四甲基哌啶(美国Sigma公司);超氧化物歧化酶(SOD) 、谷胱甘肽过氧化物酶(GSH-Px) 、过氧化氢酶(CAT)和丙二醛(MDA) 试剂盒(南京建成生物工程研究所)、尿白蛋白试剂盒(法国SPI公司);链脲佐菌素(美国Sigma公司);UV-752型紫外分光光度仪(上海精密仪器仪表有限公司);三诺血糖仪(长沙三诺生物传感股份有限公司)。
1.2 方法
1.2.1 动物模型制作及分组 由山西医科大学动物中心取回18只大鼠适应性饲养1周后,随机分为对照组、糖尿病组和治疗组,每组6只。
糖尿病大鼠模型的制备[3]:经前期实验,发现在造模前先给予大鼠高糖、高盐、高脂饮食饲养2周左右,造模成功率较高。糖尿病组与治疗组大鼠造模时腹腔注射剂量为30mg/kg的链脲佐菌素溶液(浓度:20 g/L), 72 h后由尾静脉采血,检测血糖。成模标准:大鼠空腹血糖≥16.7 mmol /L。对照组同时腹腔注射等量枸橼酸缓冲液。待糖尿病模型大鼠血糖稳定1周后开始实验, 治疗组大鼠每天用Tempol溶于生理盐水(浓度:10 mg/mL)中按60 mg/kg灌胃,对照组和糖尿病组大鼠每天灌胃等量生理盐水。实验期间供给常规饲料,3组大鼠自主饮食,禁用激素、格列本脲、水果等对血糖有影响的药物或食物。每周定时监测大鼠的体重、血糖(BG)和活动情况。
1.2.2 标本检测 实验4周后用代谢笼收集每只实验大鼠的24 h尿量并留存,严格按照法国SPI公司试剂盒说明检测24 h 尿白蛋白 (UAlb/24 h) 含量;再禁食12 h后称重记录,用3%的戊巴比妥钠腹腔注射麻醉,经腹主动脉采血测血糖并记录,然后放血处死大鼠并迅速取出右肾称重,计算大鼠肾重/体重(KW/BW)比值,分离肾皮质,-70℃保存。拿出保存的右肾皮质,加适量冰冷生理盐水,在低温下剪碎研磨制成组织匀浆,低温离心3 min(3 000 r/min)后取上清液,严格按照南京建成生物工程研究所试剂盒说明书操作,测定MDA的含量,SOD、GSH-Px 和CAT 的活性。
1.3 统计学方法
2 结果
2.1 各组大鼠KW/BW、 UAlb/24h和BG比较
实验4周后, 与对照组大鼠比较,糖尿病组和治疗组的KW/BW、UAlb/24 h和BG均增高,差异有统计学意义(P<0.05);治疗组大鼠各指标均较糖尿病组降低,差异有统计学意义(P<0.05)。见表1。
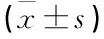
表1 各组大鼠KW/BW、UAlb/24h和BG的比较
注:1)与对照组相比,P<0.05;2)与糖尿病组相比,P<0.05
2.2 各组大鼠肾组织MDA、SOD、GSH-Px和CAT水平比较
实验4周后, 与对照组比较,糖尿病组和治疗组大鼠肾组织SOD活性减弱,GSH-Px活性增强,MDA含量升高,差异均有统计学意义(P<0.05),CAT活性变化不大,差异无统计学意义(P>0.05)。与糖尿病组比较,治疗组大鼠肾组织CAT活性和MDA含量降低, SOD和GSH-Px活性增强,差异均有统计学意义(P<0.05)。见表2。
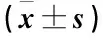
表2 各组大鼠肾组织SOD、CAT、GSH-Px活性和MDA含量比较
注:1)与对照组相比,P<0.05;2)与糖尿病组相比,P<0.05
3 讨论
现代医学对糖尿病肾病的研究已经越来越多,并且逐渐加深,已经深入到分子水平。虽然截止目前其发病机制仍不十分清楚,但对氧化应激在糖尿病患者肾脏的病变过程中起着非常重要的作用,这一点已达成共识[1]。氧化应激对糖尿病时肾组织的损害涉及多个方面,其中最重要的关键因子是活性氧自由基(reactive oxygenspecies, ROS),由高糖引发肾小球系膜细胞和小管上皮细胞产生,激活蛋白激酶C,分裂原激活的蛋白激酶使转录因子核因子及活化蛋白-1,诱发多种生长因子和细胞因子的合成,这些因子激发多系列的生物化学反应,促进肾细胞重构,胶原蛋白合成增加,分解减少,引起肾脏增生,促进糖尿病肾病的发生及病情进展[4]。本研究中的Tempol是一种新型抗氧化剂,是ROS的清除剂,SOD的拟似物。与同类抗氧化剂如硫酸锌等比较,具有稳定性高、穿透力强、分布广,金属非依赖性及毒性小等优点。有抗ROS的作用,可清除O2-,减少OH-产生。
表1结果显示:实验4周后,与对照组、糖尿病组大鼠比较,治疗组KW/BW、 UAlb/24 h、BG等3项指标,差异均有统计学意义(P<0.05),提示Tempol能在一些方面保护早期糖尿病大鼠肾脏,可以减轻肾组织的水肿和增生重构,减少尿蛋白含量,但不能改善到未发生糖尿病前。与糖尿病大鼠比较,治疗组BG略低,但差异有统计学意义(P<0.05),这与其他研究抗氧化剂对糖尿病大鼠的血糖无明显改变不符[5]。按作用机制来说Tempol并无降低糖的作用,产生不符的原因可能是由于实验设计不同,本研究时间较短,高糖导致的氧化应激对大鼠的损伤是一个缓慢的渐变过程,损伤还未完全出现,Tempol的抗氧化作用在一定程度保护了早期糖尿病大鼠的胰岛功能,延缓了胰岛的病变过程,如延长实验时间,可能结果会发生改变。表2结果显示:治疗组大鼠经Tempol治疗后,肾组织SOD、GSH-Px活性和MDA含量的变化,与对照组、糖尿病组比较差异均有统计学意义(P<0.05)。说明Tempol虽可使糖尿病大鼠肾组织氧化应激水平减轻,但不能完全阻断氧化应激发生和发展的过程。糖尿病和治疗组大鼠GSH-Px活性升高,与对照组比较差异均有统计学意义(P<0.05),按理论来说,在氧化反应中糖尿病大鼠GSH-Px活性应不高于正常大鼠,原因可能是由于实验设计产生的误差,本研究时间较短,大鼠对突然出现的高糖刺激在短期内产生了代偿机制。另治疗组CAT活性有所减弱,但与对照组比较差异无统计学意义(P>0.05),理论上来说在氧化反应中糖尿病大鼠CAT活性应不低于正常大鼠,此结果产生的原因不明,可能属实验操作误差,由于无统计学差异,数据依然有效。
综上所述,Tempol能在一定程度上抑制糖尿病大鼠肾组织中发生的氧化应激反应,减轻糖尿病高糖情况下对肾脏的损伤过程,延缓糖尿病肾病的发展。但不能完全阻断氧化应激反应,说明氧化应激是非常复杂的多系统多途径反应,Tempol只能阻滞其中的某些环节。
