血清补体C1q/肿瘤坏死因子相关蛋白12与非酒精性脂肪性肝病相关性研究
2018-07-19沈德峰倪小英傅聿明庞东岳苏长春
沈德峰,张 磊,倪小英,傅聿明,庞东岳,苏长春,刘 婧
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD) 是最常见的慢性肝脏疾病之一[1],NAFLD涵盖了不同阶段的肝脏疾病,从单纯性脂肪变性、脂肪性肝炎到纤维化和肝硬化[2]。NAFLD被广泛认为是代谢综合征的肝脏表现[3]。胰岛素抵抗、炎症、肝脏脂肪代谢紊乱是NAFLD重要的发病机制,而2型糖尿病和肥胖是其重要的危险因素[4]。
研究表明,众多脂肪因子与胰岛素抵抗相关性疾病关系密切,并参与了NAFLD的发生和发展[5]。脂肪因子补体C1q/肿瘤坏死因子相关蛋白12(serum complement C1q/tumor necrosis factor related protein 12,CTRP12)属于CTRPs家族,具有胰岛素增敏和抗炎作用,并在肥胖和糖尿病小鼠血清和脂肪组织中水平下降[6]。此外,也有研究发现血清CTRP12在糖尿病患者中较对照组浓度下降[7]。该研究旨在测定NAFLD患者血清CTRP12水平,并探讨其与NAFLD患者临床代谢参数及胰岛素抵抗的关系。
1 资料与方法
1.1一般资料选取2016年10月—2016年11月在兴化市人民医院体检中心通过彩色超声筛选出临床资料完整的NAFLD患者86例,其中男56例,女30例;年龄34~69岁;均符合2002年中华医学会肝脏病学分会《非酒精性脂肪性肝病诊断标准》。另选同期该医院健康体检者86例为对照组,男54例,女32例;年龄33~71岁。NAFLD入选者乙醇摄入男性每周<140 g,女性每周<70 g,并排除自身免疫性肝病、病毒性肝炎、药物及毒物引起的肝病。所有入选者均排除糖尿病、严重肝肾疾病、心力衰竭、恶性肿瘤、库欣综合征、急性感染等,无吸烟史。该研究通过医院伦理委员会批准,所有观察对象均签署知情同意书。
1.2研究方法
1.2.1体质参数的测定所有受试者均穿单衣单裤,脱鞋袜,测量腰围(WC)、臀围(HC),并计算腰臀比(WHR),WHR=WC/HC。测量身高体质量,并计算体质量指数 BMI。 BMI=体质量/身高2(kg/m2);由体检中心护士测量3次血压取平均值,受试者测血压前静坐至少15 min。
1.2.2生化指标测定空腹至少10 h后,所有研究对象采集晨起静脉血15 ml,3000 r/min离心10 min后分离血清,部分存于-80℃冰箱待测定CTRP12(ELISA,Aviscera,Santa,USA)。 其余血清用于总胆固醇(TC)、三酰甘油(TG)、空腹血糖(FBG)、血尿酸(UA)、空腹胰岛素 (FIns)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的测定。FIns采用化学发光法测定 (AIA-2000ST,TOSOH company,Japan)。
1.2.3稳态模型评估法测定胰岛素抵抗指数(HOMAIR)HOMA-IR=FIns(mIU/L)×FBG(mmol/L)/22.5。
1.3统计学处理采用SPSS 17统计软件,计量资料以均数±标准差(x±s)表示。计数资料比较采用χ2检验,两组连续变量比较采用独立样本t检验。CTRP12与其他变量分别进行Spearman相关、多元线性逐步回归分析。P<0.05为差异有统计学意义。
2 结果
2.1临床代谢指标及血清CTRP12水平比较两组一般临床资料及血清CTRP12水平比较见表1。两组间年龄、性别、血压、TC、LDL-C无统计学差异,WC、BMI、WHR、HDL-C、UA、HOMA-IR、TC、FBG、CTRP12 差异有统计学意义(P<0.01 或 P<0.05)。
2.2IMT与临床指标的相关分析在NAFLD组中 Spearman相关分析显示,CTRP12与 WC (r=0.312,P<0.01)、WHR(r=0.361,P<0.01)、BMI (r=0.357,P<0.01)、FBG (r=0.342,P<0.01)、HOMA-IR(r=0.265,P<0.01)、TG(r=0.242,P<0.01)呈正相关,与其他指标相关性无统计学意义(表2)。
2.3多元线性逐步回归分析为明确CTRP12的独立相关因素,进一步以CTRP12作为因变量,以年龄、性别、血压、UA、FBG、血脂谱、HOMA-IR、BMI、WC、WHR等作为自变量,结果发现 FBG、BMI、WC是NAFLD患者血清CTRP12的独立影响因子(表 3)。
3 讨论
越来越多的证据表明,脂肪组织分泌的脂肪因子参与了能量代谢、炎症调节等病理生理过程。脂肪因子分泌调节的紊乱和肥胖相关性疾病关系极为密切,瘦素、脂联素、抵抗素等脂肪因子在糖尿病、代谢综合征、NAFLD等代谢性疾病中的作用已得到广泛认可[5]。CTRPs家族成员 CTRP1 和CTRP13已被证实参与了NAFLD的病理过程,血清CTRP1有可能成为 NAFLD 新的预测手段[8,9]。

表 1 两组一般资料的比较
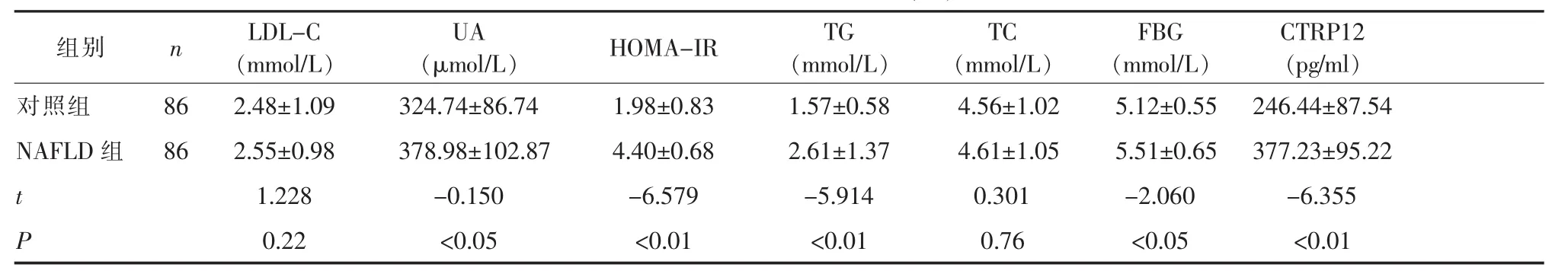
表 1 两组一般资料的比较(续)

表 2 CTRP12与其他指标的相关性分析
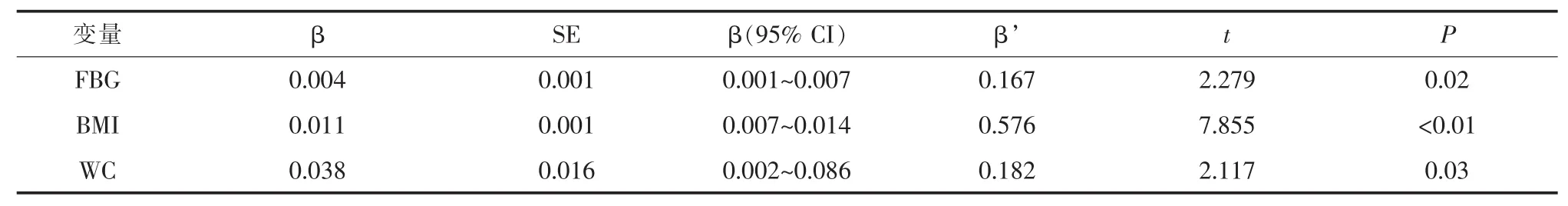
表 3 CTRP12的独立影响因素
NAFLD病因复杂,研究较多的有“二次打击”学说、肥胖基因的多态性、炎症机制、胃肠微生物群体变化等[4]。在“二次打击”学说中,胰岛素抵抗所致的肝脏脂质代谢紊乱是NAFLD发病的始动因素。胰岛素抵抗时胰岛素对脂肪代谢的调节作用减弱,导致脂肪的脂解作用增强,释放游离脂肪酸(FFA)增多,致使循环中FFA增加,增多的FFA一方面通过血糖、血脂循环干扰肌肉组织对胰岛素的敏感性,另一方面通过其在肝脏的β氧化途径刺激糖异生,诱导肝糖输出,并降低肝对胰岛素的灭活能力,加重胰岛素抵抗,形成恶性循环[10]。该研究中NAFLD组肥胖指标、糖脂参数、HOMA-IR明显高于对照组,与NAFLD的临床表现相吻合。
CTRP12作为CTRP家族中的一员,和其他成员类似,拥有Clq/肿瘤坏死因子样球形结构域,其氨基酸序列与脂联素同源性为20%[6]。研究表明,CTRP12能够抑制肝糖异生,促进脂肪细胞糖摄取,改善胰岛素抵抗。Enomoto等[6]发现 CTRP12能在胰岛素浓度不变的前提下增加肥胖小鼠的糖耐量,改善其胰岛素敏感性。该研究还发现肥胖小鼠经CTRP12干预后,其体重下降,脂肪细胞体积较对照组明显减小。进一步研究表明,CTRP12主要是通过激活PI3K-Akt信号通路,抑制肝糖异生,促进脂肪细胞对葡萄糖摄取。该研究首次发现,NAFLD组血清CTRP12浓度明显高于对照组,且与血糖、TG、HOMA-IR、肥胖指标有显著相关性。多元线性回归分析提示血糖、WC、BMI是CTRP的独立影响因素。由此可见,CTRP12可能通过改善糖脂代谢及胰岛素敏感性,参与NAFLD的病理生理过程。类似于瘦素和脂联素抵抗,笔者推测CTRP12浓度升高可能是胰岛素抵抗发生时的代偿作用。
作为一项观察性实验,笔者未能观察CTRP12在NAFLD不同病理阶段的变化,并不能明确血清CTRP12和NAFLD发生的因果关系,研究结果需在前瞻性队列研究及基础实验中证实。
综上所述,脂肪因子CTRP12血清浓度在NAFLD患者中显著升高,可能在NAFLD发病进程中发挥作用。但具体机制亟待更加深入的研究。
