基于3D打印的I型胶原涂覆β-TCP骨组织工程支架研究
2018-07-19孙开瑜徐铭恩周永勇
孙开瑜 徐铭恩,2* 周永勇
1(杭州电子科技大学生命信息与仪器工程学院,杭州 310018)2(浙江省医学信息与生物三维打印重点实验室,杭州 310018)3(浙江省杭州捷诺飞生物科技股份有限公司,杭州 310018)
引言
骨移植对于修复由疾病或创伤引起的骨缺损至关重要。自体骨移植作为骨修复的金标准,存在来源有限、引发感染、对自身造成残疾等问题。近年来,利用组织工程技术研制合适的骨移植替代物以修复骨缺损成为研究热点之一[1]。骨组织工程通过构建替代传统移植物的三维多孔支架作为细胞载体,支持成骨相关细胞增殖分化及营养物质和代谢产物的运输,在骨修复中起着关键作用[2]。因此,制备一款力学性能与自体骨相近,具有良好生物相容性、可促进细胞成骨分化的骨组织工程支架具有实际意义。
β-磷酸三钙(β-tricalcium phosphate,β-TCP)因其类似于人类骨骼的主要无机成分,作为人工骨替代材料具有良好的生物相容性、骨传导性,且较羟基磷灰石(hydroxyapatite,HA)在体内更易降解,在临床上具有巨大的应用潜力[3-4]。传统制备多孔β-TCP支架的方法如化学/气体发泡法、盐析法、冷冻干燥法、热致相分离法等[5-7]。这些方法难以控制支架形貌、孔隙率和内部结构,准确限制孔径大小在符合血管化和骨组织再生的200~500 μm范围内,使支架在微观和宏观形状上无法满足患者临床上的特异性需要[8]。
3D打印技术作为一种新型数字化成型技术,与临床计算机断层扫描、磁共振成像等结合,利用计算机辅助设计个性化植入物,实现对孔隙结构的精准控制,设计出与患者骨缺损区域几乎完全相同的三维多孔高活性骨修复支架,有利于提高植入支架的生物相容性[9-10]。Carrel等[11]通过3D打印技术制备特异性β-TCP/HA支架,孔隙率为50%~60%,大孔直径约为250 μm,有效促进皮质骨的垂直生长。但由于磷酸钙陶瓷具有韧性较差、成形困难、在体内降解较慢等缺点,在机械强度和降解速率中表现出局限性。目前,已有研究团队使用聚己内酯(polycaprolactone,PCL)、聚乳酸(polylactic acid,PLA)等聚合物作为粘合剂溶解在有机溶剂中,使β-TCP浆料分布浓度均匀,挤出时具有一致性[12]。许国军等将β-TCP、HA和PLA按比例溶于氯仿溶液中配置3D打印浆料,表现出良好的弹性性能便于成型[13]。然而,由于在制备支架过程中无法完全将有机溶剂从中去除,对细胞产生毒害作用[14-15]。同时,支架中钙磷的含量受到限制,钙磷相与聚合物存在相分离的倾向,从而降低了支架的力学性能和生物活性。因此,需提供新的加工方法和最佳浆料配方以满足β-TCP支架3D打印的要求。
在天然骨中,纤维状I型胶原是细胞外基质的主要有机成分。I型胶原具有良好的生物相容性,且易于被人体吸收,为人工骨支架研究和应用开辟新的方向。文献报道,I型胶原与β-TCP结合使复合物具有骨诱导性,β-TCP/胶原复合物能模拟骨组织中的有机和无机成分,提供适合细胞生长的三维环境[16]。Matsuno T等人[17]基于低温3D打印技术打印胶原凝胶支架和胶原/β-TCP复合支架。但目前仍无法模仿天然骨胶原纤维结构[18-19]。另外,由于制备中缺少烧结过程,引起支架的机械强度不足、结构不稳定,对此尚未有成熟的解决办法。因此,对β-TCP/胶原支架的制备工艺进行改进是亟待解决的问题。
本研究提出由β-TCP和I型胶原制备个性化可吸收的支架,以修复患者骨缺损。由于每个患者的骨缺损都有其外形和结构特征,利用SolidWorks软件设计个性化骨缺损修复三维支架模型,通过3D打印技术构建多孔互连的β-TCP支架。考察不同填充角度的β-TCP支架对支架内部孔径、力学性能的影响,选定最优填充角度。对烧结后的β-TCP支架表面涂覆I型胶原,通过扫描电子显微镜(SEM)、机械弯曲测试等表征β-TCP/胶原支架,选择适合的胶原浓度。在β-TCP/胶原支架上种植大鼠骨髓间充质干细胞(mBMSCs),并通过观察细胞活性和增殖来评价其生物相容性。利用RT-PCR技术检测β-TCP/胶原支架对刺激mBMSCs向成骨细胞分化的相关蛋白在mRNA水平上的表达。研究结果表明,烧结的β-TCP支架和涂覆胶原的β-TCP/胶原支架有利于促进细胞的黏附和增殖。涂覆胶原的β-TCP/胶原支架对促进细胞增殖在体外成骨分化有显著作用。
1 材料和方法
1.1 试剂及仪器
1.1.1试剂及药品
β-磷酸三钙(β-TCP,杭州铭众,中国);聚丙烯酸铵(9003-3-6,上海宛道,中国);甲基纤维素(9004-65-3,Sigma,美国);I型胶原(200110-10,杭州欣友,中国);Alamra Blue(Invitrogen,美国);DMEM高糖培养基(C1199550BT,Gibco,美国);FBS(085-150,Multicell,美国);Trizol(15596-026,Invitrogen,美国);活死细胞活力检测试剂盒(KGA502,南京凯基,中国);逆转录试剂盒(RR037A,Takara,日本);SYBR Green荧光定量试剂盒(RR420A,Takara,日本)。
1.1.2实验器材
生物3D打印机(Bio-Architect,Regenovo,中国);马弗炉(SX3-2-12,杭州卓驰仪器有限公司,中国);电子分析天平(BSA224S,Sartorius,德国);酶标仪(Multiskan GO,Thermo,美国);光学倒置显微镜(CX23 ,Olympus,日本);扫描电子显微镜(JSM-6460,JEOL,日本);实时荧光定量PCR仪(ABI7300,ABI,美国);二氧化碳恒温培养箱(HF90,Heal force,中国);台式高速冷冻离心机(Neofuge 15R,Heal Force,中国);精密pH计(PB-10,Sartorius,德国);百级洁净工作台(AHC-2D1,Esco,新加坡)。
1.2 三维打印制备β-TCP/胶原支架
用SolidWorks软件设计骨修复支架模型结构如图1(b)所示。以可溶性钙盐和磷酸盐反应工艺合成的微纳米级类球形β-磷酸三钙(β-TCP)粉体为原料,以去离子水和聚丙烯酸铵(PAA-NH4)(2 wt% β-TCP)为溶剂,搅拌30 min,配制固相含量为32 vol%的浆料。将甲基纤维素(1 wt% β-TCP)加入浆料中,搅拌20 min。将制备好的β-TCP浆料填充到定制料筒中,置于Regenovo生物3D打印机的成型室中准备打印。

图1 (a)骨修复三维支架打印过程图;(b)骨修复三维模型示意图;(c)烧结后的β-TCP三维支架;(d)对β-TCP支架进行胶原涂覆Fig.1 (a) Images representing the printing of the 3D bone repair model. (b) Schematic of three-dimensional bone repair model. (c) Representative images of sintered β-TCP scaffolds. (d)Images of collage gel coating on β-TCP scaffolds
为减小设计模型结构和打印支架间的显著差异,实验中所使用的Regenovo生物3D打印机重复定位精度(XYZ)为±0.01 mm。同时,应用迭代反馈式生物打印技术(iterative feedback bio-printing,IFBP)保证打印支架的均一性[20]。确定打印平台温度为37℃,打印填充距离为0.8 mm,填充角度为0/90°、0/60°和0/45°,打印层厚0.28 mm,样品大小为9 mm×9 mm×2 mm和5.5 mm×5.5 mm×4.0 mm3。生物3D打印机相关参数见表1。

表1 生物3D打印机的主要参数
将打印好的β-TCP支架常温干燥48 h。使用马弗炉进行1 200 ℃高温烧结,保温时间为3 h,升温/降温速率为3℃/min。将烧结后的β-TCP支架,进行高温高压灭菌处理,所得支架如图1(c)所示。在无菌条件下,分别用0.50、0.25、0.10、0 mg/mL的胶原溶液涂覆灭菌后支架,37 ℃孵育2 h后,待支架表面胶原成凝胶化,超净台内风干48 h,4℃存储备用。
1.3 孔隙率测试
选用改良的比重瓶法对β-TCP支架的孔隙率进行测试[21]。乙醇可以完全渗入孔中并且不改变β-TCP支架材料的物理和化学性质,因此用作支架的孔隙度值测量的液体。分别对填充角度为0/90°、0/60°、0/45°的β-TCP支架进行孔隙率测量,每组对象测试4个样品。
1.4 力学性能测试
采用Zwick/Roell万能材料试验机,以不同填充角度(0/90°、0/60°、0/45°)的β-TCP支架和不同胶原浓度(0.50,0.25,0.10,0 mg/mL)涂覆的β-TCP/胶原支架为测定对象,尺寸大小为5.5 mm×5.5 mm×4.0 mm3立方体,每组对象测试4个样品。以2 mm/min的加载速度在轴向压缩下进行力学性能测试,直至支架断裂。通过应力-应变曲线得到支架的抗压强度和压缩弹性模量,确定合适的填充角度及胶原浓度。
1.5 扫描电镜观察
采用JSM-6460型电子显微镜,对干燥后的β-TCP支架和涂覆0.5 mg/mL胶原的β-TCP/胶原支架喷碳15 s,做好标记,分别对两组支架表面形貌进行观察。设置扫描电压为15 kV,观测×70倍的大孔结构和×1 000倍的微观结构。
1.6 骨髓间充质干细胞(mBMSCs)的提取及接种
根据文献方法提取mBMSCs[22]。将冻存的mBMSCs放入37℃的振荡水浴锅中约80 s,将mBMSCs转移到装有H-DMEM培养基的离心管内,100 g离心5 min。吸弃离心后的上清培养液,加入适量H-DMEM培养基,将50 μL细胞悬浮液(2.0×104mBMSCs)分别接种在β-TCP支架和β-TCP/胶原支架上,放入培养箱中孵育1 h。然后每孔加入1 mL H-DMEM培养基,静置于培养箱中(37℃,5% CO2)培养,之后每隔3 d更换一次培养基。
1.7 细胞增殖检测
利用Alamar Blue试剂盒分别检测β-TCP支架和涂覆0.5 mg/mL胶原的β-TCP/胶原支架内细胞的增殖,每组对象测试4个样品。将接种mBMSCs的支架培养于二氧化碳恒温培养箱中,总计7 d。分别在第1、3、5、7 d,将Alamar Blue与细胞培养基以1∶10体积比混合后,以500 μL/mL取该混合溶液加入到每个样品中。37℃孵育2 h后,从每个样品吸取100 μL溶液至96孔板中,用酶标仪检测544 nm/590 nm处的激发/发射值。移除支架内残留的检测溶液并用PBS洗涤两次,加入新鲜的培养基并放入二氧化碳恒温培养箱中继续培养。
1.8 细胞活性检测
用活死细胞活力检测试剂盒检测培养5 d后β-TCP支架和涂覆0.5 mg/mL胶原的β-TCP/胶原支架中的细胞存活情况。从二氧化碳恒温培养箱中取出培养5 d的三维支架,用DPBS分别洗涤培养的两组支架3次,加入染色工作液。室温下避光孵育1 h,吸出染色工作液终止孵育,用DPBS冲洗支架3次,荧光正置显微镜下观察β-TCP支架和涂覆0.5 mg/mL胶原的β-TCP/胶原支架中的细胞形态和分布。
将接种mBMSCs的涂覆0.5 mg/mL胶原的β-TCP/胶原支架及β-TCP支架用4%多聚甲醛固定30 min,并在PBS配置的0.2% Triton X-100中透化。用PBS多次洗涤后,在室温下使用DAPI对细胞核染色5 min,在显微镜下检查染色。
1.9 实时荧光定量PCR分析
采用实时荧光定量PCR检测涂覆0.5 mg/mL胶原的β-TCP/胶原支架及β-TCP支架上成骨基因(ALP、Collagen-I、BSP)的表达情况,测试mBMSCs向成骨方向分化能力。分别取第1、3、7 d的mBMSCs,加入TRIzol 裂解液,按试剂说明进行总RNA 提取,超微量分光光度计(Nanodrop 2000)检测总RNA的纯度和浓度。用逆转录试剂盒将总RNA逆转录成cDNA,用SYBR Green荧光定量试剂盒,在7300plus(ABI)进行实时荧光定量PCR(RT-PCR)检测。
引物序列见表2,内参基因选用GAPDH。ΔΔCT法分析β-TCP支架和β-TCP/胶原支架培养下细胞内目的基因的表达差异[23]。
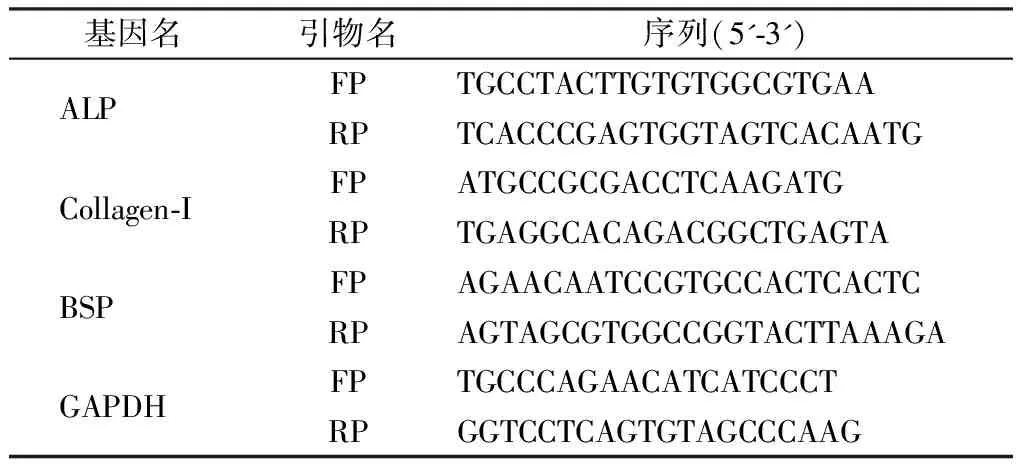
表2 RT-PCR引物序列及产物片段
1.10 统计分析
采用SPSS 17.0软件进行统计学分析。所有数据资料以平均值±标准差表示,统计分析采用单因素方差分析,以P< 0.05作为差别有显著性意义。
2 实验结果
2.1 支架的形貌
如图2所示,利用3D打印技术制备的骨修复三维支架具有横向通道及纵向通道,能准确地再现SolidWorks 设计的三维结构,孔道整齐有序,相互连通,具有较高的均一性,有利于提高结构上抗压能力。β-TCP支架打印后的微丝直径为(351.87±11.62) μm,烧结后的微丝直径为(303.49±9.37) μm,由烧结引起的支架收缩率为13.6%。图3(a)为烧结后的β-TCP三维支架SEM图像。β-TCP支架表面粗糙,内部形成良好整齐的多孔网状结构,孔隙互相连通,大孔平均直径为(315.30±6.85) μm,可供培养液深入结构内部。图3(b)为β-TCP三维支架SEM图像,在材料丝上可见许多近似圆形的微孔结构,直径分布在3~5 μm之间。图3(c、d)为涂覆0.5 mg/mL胶原的β-TCP/胶原支架的表观形貌,支架表面形成胶原涂层,孔径和孔隙互连性在用胶原凝胶涂覆后无显著变化。在β-TCP/胶原支架中观察到胶原成网状,形成的胶原纳米纤维直径约为50~500 nm。

表3 不同填充角度对支架性能的影响Tab.3 The effect of different filling angles on the performance of scaffolds
注:与0/90°填充角度支架比较,aP<0.05;与0/60°填充角度支架比较,bP<0.05。
Note:Comparing with 0/90° of filling angle,aP<0.05;Comparing with 0/90° of filling angle,bP<0.05.

图2 烧结后的β-TCP支架。(a)俯视图;(b)剖视图Fig.2 Representative images of sintered β-TCP scaffolds. (a)Top view; (b) Sectional view

图3 支架的扫描电镜图。(a)和(b)不同标尺的β-TCP支架;(c)和(d)不同标尺的β-TCP/胶原支架Fig.3 Representative SEM images of scaffolds. (a) and (b) β-TCP scaffolds with different scales (c) and (d) β-TCP/col scaffolds with different scales
2.2 填充角度对支架性能的影响
通过3D打印技术制备了填充角度为0/90°、0/60°和0/45°的β-TCP三维支架。从表3中可看出,填充角度对支架的孔径大小和孔隙率影响较少,填充角度为0/90°、0/60°和0/45°的β-TCP支架孔径分别为315.30、308.18、313.21 μm,在统计学上均无显著差异。不同填充角度的β-TCP支架的光学显微镜图如图4所示。填充角度为0/90°的孔隙率为84.96%,略高于其他填充角度。通过对不同填充角度的支架力学性能分析,填充角度对支架抗压强度和压缩弹性模量有显著影响,0/90°填充角度的β-TCP支架具有最高的抗压强度为(15.02±0.82) MPa,压缩弹性模量为(179.69±17.07) MPa,0/45°填充角度支架的抗压强度最低为(8.30±1.21) MPa,压缩弹性模量为(86.45±10.09) MPa,均在人体松质骨抗压强度2~12 MPa、压缩弹性模量50~500 MPa范围内。0/90°是基础β-TCP支架填充角度的最优选择。
2.3 胶原浓度对支架力学性能的影响

图4 不同填充角度的β-TCP支架的光学显微镜图。(a)0/90°;(b)0/60°(c)0/45°Fig.4 Representative SEM images of scaffolds. (a) 0/90° (b) 0/60° (c) 0/45°
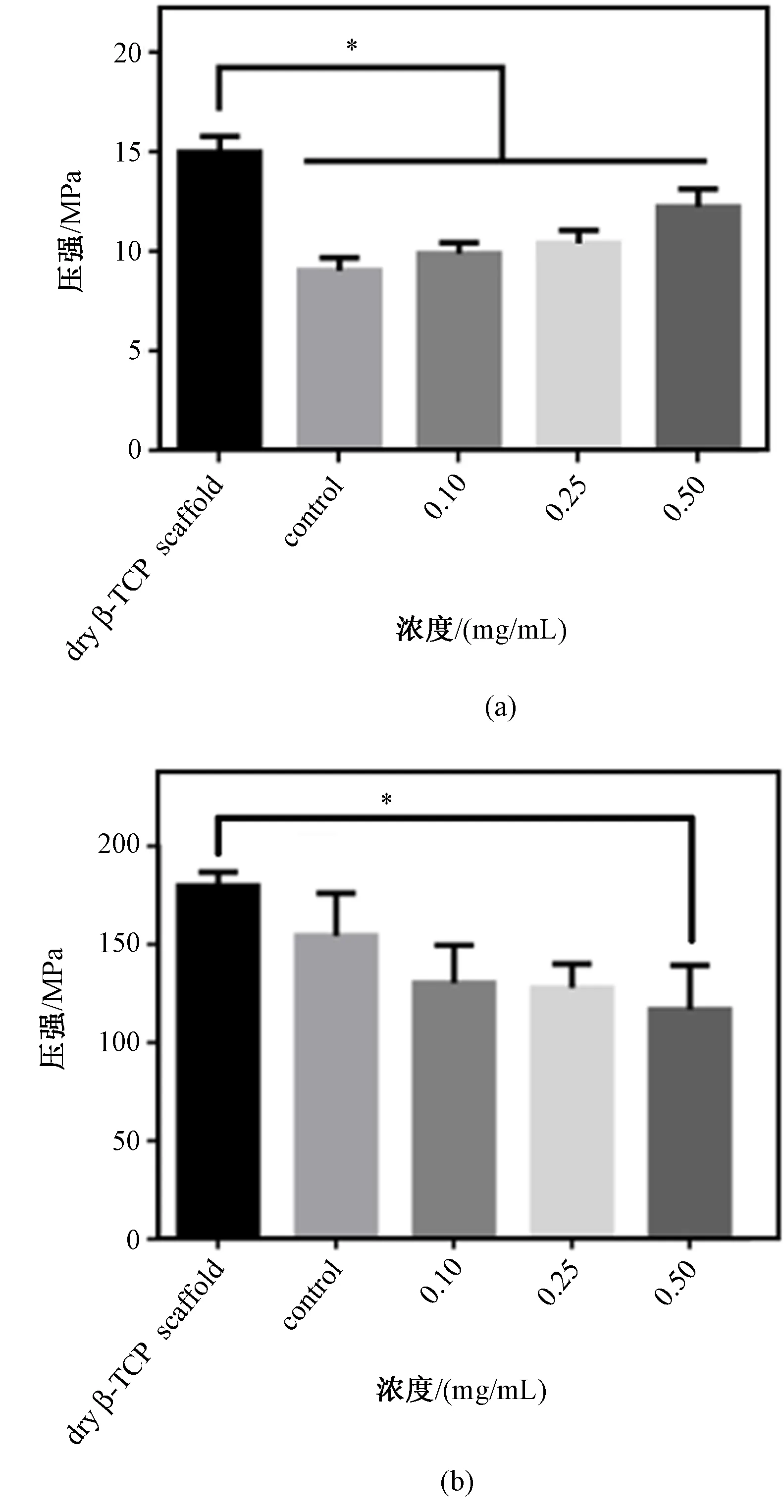
图5 不同胶原浓度的β-TCP/胶原支架的力学性能。(a)抗压强度;(b)压缩弹性模量(*P<0.05)Fig.5 Mechanical properties of β-TCP/col scaffolds with different collagen concentrations.(a)Compressive strength;(b)Elastic modulus(*P<0.05)
根据2.2实验结果,选择最优填充角度0/90°,设定0 mg/mL胶原涂覆的β-TCP/胶原支架为control 组,对比不同胶原浓度下β-TCP/胶原支架的力学性能,每组对象测试4个样品。由图5(a)可见,干燥的β-TCP支架浸没于液体后会降低其抗压强度。β-TCP支架涂覆不同浓度的胶原溶液后其抗压强度都有所降低。随胶原浓度的增加而抗压强度增加,抗压强度都在2-12 MPa天然松质骨的范内。其中,0.5 mg/mL胶原浓度涂覆的β-TCP/胶原支架抗压强度为(12.29±0.88) MPa。压缩弹性模量表示支架的刚度。如图5(b)所示,涂覆胶原会降低支架的压缩弹性模量。0.5 mg/mL胶原涂覆的β-TCP/胶原支架的压缩弹性模量为(116.74±27.75) MPa,与β-TCP支架(179.69±17.07) MPa间存在显著性差异。实验结果表明,涂覆胶原能提高支架的抗压强度,减小β-TCP支架的压缩弹性模量。
2.4 β-TCP/胶原支架和β-TCP支架对mBMSCs细胞活性的影响
采用Alamar Blue法对细胞增殖进行检测并绘制细胞增殖曲线,如图6所示。随着培养时间的增长,β-TCP/胶原支架组和β-TCP支架组中mBMSCs数量都明显增加,且β-TCP/胶原支架组在各个时间点上的细胞数均高于β-TCP支架组。在第5 d两组之间表现出显著性差异,到第7 d时β-TCP/胶原支架组的细胞数量与β-TCP支架组差异增大。 mBMSCs在β-TCP/胶原支架中增殖速度较快。β-TCP/胶原支架和β-TCP支架都具有良好的生物相容性,涂覆0.50 mg/mL胶原能促进细胞的增殖。
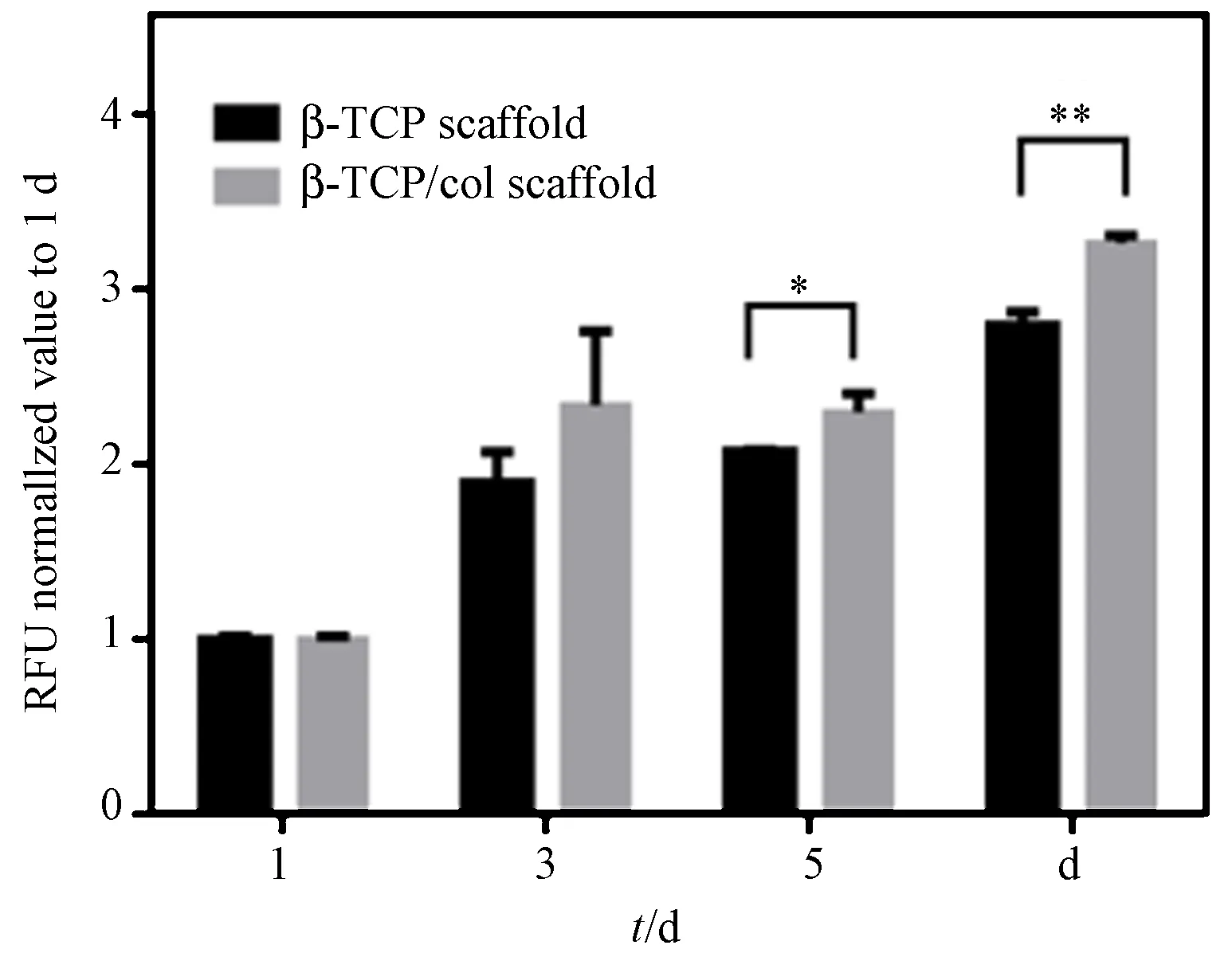
图6 细胞在三维支架中的增殖(*P<0.05,**P<0.01)Fig.6 Cell proliferation on sintered β-TCP scaffolds or β-TCP/col scaffolds.(*P<0.05,**P<0.01)
通过DAPI染色及活死染色对比mBMSCs在β-TCP支架及β-TCP/胶原支架上第5 d的增殖情况。与Alamar Blue法检测细胞增殖结果一致,细胞在两种支架细丝表面的分布数量相差明显,在β-TCP/胶原三维支架中增殖更加旺盛,表面已完全铺满,细胞伸展充分,呈细长梭形或星形,排列紧密,多层叠加。但β-TCP支架上,仍有少量mBMSCs未充分贴壁呈圆状或椭圆状,直径大小不一。细胞在三维支架中的分布和形态如图7所示。

图7 细胞在三维支架中的分布和形态。 (a) 培养5 d的β-TCP支架的细胞DAPI染色图; (b) 培养5 d的β-TCP支架的细胞活死染色图,活细胞被染成绿色荧光;(c)培养5 d的β-TCP/胶原支架的细胞DAPI染色图;(d)培养5 d的β-TCP/胶原支架的细胞活死染色图Fig.7 mBMSCs cellular morphology on β-TCP scaffolds or β-TCP/col scaffolds. (a) and (c) Immunofluorescent staining of the intracellular nuclei with DAPI on either β-TCP scaffolds or β-TCP/col scaffolds after 5 days of culture; (b) and (d) Cell viability in either β-TCP scaffolds or β-TCP/col scaffolds after printing measured by Live & Dead viability assay kit, live cells were stained in green
2.5 β-TCP/胶原支架和β-TCP支架对mBMSCs成骨化影响
通过实时定量PCR测定,mBMSCs在β-TCP支架和β-TCP/胶原支架上培养1、3、7 d后的成骨基因的表达变化差异,包括早期分化标志分子(ALP和Collagen-I),晚期分化标志分子(BSP)。如图8所示,在培养期间,β-TCP/胶原支架中的mBMSCs在各个时间点对ALP、Collagen-I和BSP的相对表达量都较β-TCP支架高。随着培养时间的增长,ALP和Collagen-I在β-TCP支架上的相对表达量增长缓慢,无显著性差异,在β-TCP/胶原支架上的相对表达量上升趋势明显。其中第7 dALP的相对表达量上调到4倍。第7 d时,Collagen-I在β-TCP/胶原支架上的相对表达量是β-TCP支架的1.9倍,呈极显著差异。在β-TCP支架中,BSP的相对表达量无上升趋势,而在β-TCP/胶原支架上第3天的相对表达量是β-TCP支架中的7倍,第7 d时上升至8倍。这一研究结果显示,胶原涂覆的β-TCP/胶原支架促进mMSCs向成骨细胞分化。

图8 1,3和7 d后三维支架mBMSCs中成骨及矿化相关基因在mRNA水平的相对表达(*P<0.05,**P<0.01)。(a)ALP; (b) BSP;(c)Collagen-IFig.8 The expression of genes related to osteoblastic differentiation and biomineralization relative to the housekeeping gene GAPDH in mBMSCs in β-TCP scaffolds or β-TCP/col scaffolds for 1,3 and 7 days(*P<0.05,**P<0.01). (a)ALP; (b) BSP; (c) Collagen-I
3 讨论
生物3D打印能够快速制造具有定制三维多孔结构的骨组织支架,在临床上展现出良好的应用前景。本实验利用β-TCP具有良好骨结合性、骨传导性、降解性及降解中释放Ca、P离子利于新骨形成的特点,通过3D打印技术制备了具有多级孔结构的基础β-TCP支架。利用内径为0.35 mm锥形针头打印的β-TCP支架微丝直径为(351.87±11.62) μm。由于配置β-TCP浆料中使用聚丙烯酸铵、甲基纤维素等有机溶剂,在高温烧结过程中有机物的去除会使支架产生一定收缩,支架的微丝直径为(303.49±9.37)μm,收缩率为13.6%[24]。烧结后的β-TCP支架通道结构清晰,既有整齐排列的大孔结构,有利于细胞生长的微孔结构。大孔直径约为(315.30±6.85) μm,满足文献中建议的大孔直径在250-350 μm的范围,以保证组织再生空间,实现细胞迁移和物质交换,避免由于较大孔径引起机械强度的降低[25]。同时具备直径3~5 μm的微孔(见图3(b)),可能由水和有机物挥发形成,这些微孔形成液态微环境可以改善细胞的代谢环境,通过毛细管作用促进液体和细胞的摄入[26]。
不同填充角度β-TCP支架的孔隙率分布在79%~85%之间,在天然松质骨孔隙率为30%~90%的范围内。填充角度为0/90°的β-TCP支架的孔隙率最高,为84.96%±0.77%(见表3)。研究表明,高孔隙率且互连的骨支架在植入人体组织后期有利于细胞的黏附和生长。填充角度对β-TCP支架的抗压强度影响较大。填充角度为0/90°的β-TCP支架相比其他填充角度,在单位面积内的接触面积大于其他角度,根据力的作用与接触面积成正比,其具有最高的抗压强度(15.02±0.81) MPa,压缩弹性模量为(179.69±17.07) MPa,力学性能达到了成人的天然松质骨抗压强度2~12 MPa和压缩弹性模量50~500 MPa[27]。因此,0/90°是基础β-TCP支架填充角度的最优选择。
为了在保持机械强度的基础上更好地模仿天然骨的细胞外基质,在填充角度为0/90°的β-TCP支架上涂覆了不同浓度的胶原凝胶模拟天然骨的胶原纤维结构。比较不同胶原浓度对支架力学性能的影响,干燥的β-TCP支架与涂覆胶原β-TCP/支架在力学性能上成显著性差异。β-TCP支架浸没于液体后因溶解使支架材料颗粒体积逐渐缩小,导致颗粒与颗粒之间原先存在的连接发生显微断裂,材料颗粒彼此分离,降低其抗压强度[28]。支架植入区为人体液体环境,其抗压强度也会有所下降。涂覆浓度0.50 mg/mL的β-TCP/胶原支架表现出良好的力学性能,抗压强度为(12.29±0.88) MPa,压缩弹性模量为(116.74±27.75) MPa。β-TCP/胶原复合支架上分布着50~500 nm的胶原纤维(见图3(d)),在负载作用下,跨越裂纹的胶原纤维网络可能阻止裂纹扩大及传播,使受力部位裂隙发生偏斜产生大量基质裂纹,裂纹越多产生的基质碎片及断裂面也就越多,能吸收更多的能量,为三维支架提供一定强度[29]。胶原有一定的亲水性,其氨基可与β-TCP产物羟基磷灰石形成氢键,不但使二者结合紧密,而且提高了复合体的顺应性和延展性,降低了材料的弹性模量[29]。与Theinhan等构建胶原/磷酸钙骨水泥复合支架实验中的结果相似[30]。
文献报道,骨矿化发生前成骨细胞会经历增殖分化的过程,其间又会受细胞和材料相互作用的控制[31]。在接种mBMSCs检测β-TCP/胶原支架的生物相容性实验中,mBMSCs在涂覆胶原浓度0.5 mg/mL的β-TCP/胶原支架增殖更快(见图6)。由于β-TCP支架前期表面细胞黏附能力不足,不利于细胞后期在整个结构体中的持续增殖、迁移和发育。经I型胶原涂覆后,mBMSCs在支架上的黏附和铺展得到改善,诱导细胞增殖,弥补β-TCP支架因骨诱导性较差导致成骨性能有限的缺点。该现象在实时定量PCR测定中得到验证,在没有骨诱导基因的刺激下β-TCP支架不能激活细胞进行ALP表达,在β-TCP/胶原复合支架中ALP表达明显(见图8)。胶原纳米纤维结构的缺失会阻碍矿化过程。同样,Collage-I和BSP相当表达量的快速增长,涂覆胶原可促进基质矿化。表明涂覆胶原浓度为0.5 mg/mL的β-TCP/胶原支架比单纯的β-TCP支架更好地表达成骨特性,可刺激基质矿化,有利于促进mBMSCs向成骨细胞分化。
4 结论
本研究提出了基于3D打印技术制备个性化的多孔β-TCP/胶原支架来修复骨缺损的方法。通过3D打印技术打印制备出整个与患者缺损区吻合且具有一定三维内部孔隙结构的β-TCP/胶原支架。该支架具有不同尺度上的分级结构,可满足成骨细胞的粘附和铺展,适合血管化和骨组织再生。支架的力学性能与天然松质骨相似。在β-TCP支架上涂覆胶原后,骨髓间充质干细胞在支架上的生物相容性提高,有更高的ALP活性、成骨基因Collage-I和BSP表达,细胞向成骨方向分化能力得到提升。因此,该方法制备的β-TCP/胶原支架适合于骨组织再生,为后续个性化的骨缺损修复研究提供一定参考。
