以线性参数模型和信息分解方法评价QT变异性对心率变异性的响应
2018-07-19李晨曦王志刚张正国
李晨曦 潘 越 王志刚 张正国 彭 屹*
(中国医学科学院基础医学研究所 北京协和医学院基础学院, 北京 100005)
引言
心室复极化的时间离散倾向是心律失常发生的重要因素。已知的与心律失常相关的因素包括逐拍复极变异性[1], 如逐拍QT间期变异性(QT variability, QTV)、复极交替[2-3]以及心室复极化对心率变化响应[4-7],也即QT间期(QTI)与RR间期(RRI)之间的耦合关系。在医学研究领域,对各调节系统之间和子系统内部的驱动-响应关系的理解变得越来越受关注。
RRI和QTI之间的耦合性,不仅体现在两者绝对数值上的响应关系,也体现在QTV对HRV的响应上。事实上,QTV可以解释为与HRV相关部分和与之无关部分,而与HRV无关部分与固有的心室复极动态有关,如异常的离子通道动力学,涉及钙和钾调节以及它们与β-肾上腺素(交感神经)心室活性的相互作用[8-10],可使心室复极动态变化增强,并且已被证明与心律失常发生相关[8-9,11]。Baumert 通过记录高血压患者和正常人安静态冠状窦中去甲肾上腺素分泌量直接获取交感神经活性指标,分别以方差与均值平方之比RRVN和QTVN表示HRV和QTV[12]。与正常对照组相比,原发性高血压患者的去甲肾上腺素和QTVN上升,而RRVN降低。而且,只是原发性高血压患者QTVN与去甲肾上腺素存在一定的相关性,正常对照组中这种相关性则不存在。此种有创研究结果表明,心室复极不稳定性的增加和心交感神经过度兴奋有关,提示在交感神经活性病理性增强时,HRV与QTV的耦合水平发生改变。Almeida等提出QTV与HRV的相互作用模型[13]。利用中低阶线性自回归(autoregressive, AR)模型,将QTV分解为与HRV相关和不相关两个部分,并通过计算功率谱密度将其量化,提出QTV受HRV驱动的线性量化指标,并将该模型用于仿真数据和正常人心电数据。在对正常人群的心电图分析中,发现对于绝大部分的分析段, QTV与HRV不相关的部分不小于40%。此模型在病理状态下的应用尚待研究。
对系统之间耦合强度的量化分析,传统的线性方法包括时域的互相关分析[14]以及频域的交叉功率谱密度[15]、时不变多变量自回归模型[13,16-17]等。然而,线性方法可能不足以体现生理(子)系统的非线性结构和复杂性,近年来非线性方法的提出更有助于捕捉时间序列间复杂的相互作用。传递熵和交叉熵作为非线性方法,常用来分析不同信号或时间间期序列的耦合性以及检测信息流[18-19]。最近提出的基于熵的信息预测方法同时关注信号自身的信息储存和传递[20],综合衡量信号被预测的可能性,在研究脑力活动时心率和呼吸耦合变化及其驱动原因方面显示了其效果[21],但尚未用于病理条件下间期序列的耦合分析中。
本课题结合频域和熵分析的线性和非线性分析方法,进行基于频域线性参数模型和信息分解的HRV和QTV耦合性分析,以期更全面了解生理变化和病理变化的影响。
1 材料与方法
1.1 实验数据
所用数据来自公共数据库Telemetric and Holter ECG Warehouse (THEW, http://www.thew-project.org)中的Normal子数据库(E-HOL-03-0202-003)和ESRD(E-HOL-12-0051-016)子数据库。其中,Normal子数据库提供了202位正常人24 h Holter心电数据,ESRD子数据库提供了51位具有高心律失常和心源性猝死(sudden cardiac death, SCD)风险的终末期肾病(end stage renal disease, ESRD)患者的48 h Holter心电数据。在去除了昼夜数据不完整的记录后,分别选取Normal中的186个记录和ESRD中的41个记录。对于选取的每条记录,分别挑选出白天和夜晚各5 min安静态数据段,在07:00-20:00间选取白天数据段,00:00-6:00间选取夜晚数据段。数据库中提供了RRI的注释文件,对应的QTI采用一种复合算法进行提取[22]。数据分析前,所有的间期序列都经过去异位心拍处理。
1.2 方法
本研究主要运用频域的线性参数模型和信息分解方法,通过对RRI和QTI序列的联合分析,量化QTV对于HRV的响应。同时对相应的RRI序列进行经典方法的HRV分析,包括时域的均值计算; 频域的基于AR模型的归一化功率谱分析指标LFn、HFn和LF/HF[23];以及符号动力学分析(symbolic dynamic analysis, SDA)[24],其中以0 V%和2UV%分别衡量交感神经和迷走神经活性,文中不再赘述。
从线性和非线性两个方面进行RRI和QTI的耦合性分析,以及这种耦合性在Normal组和ESRD组之间的差异。频域采用一动态线性参数模型[25],评价HRV和QTV相互作用的线性成分。该方法利用低阶线性AR模型,通过参数辨识和功率谱分解,区分和量化QTV与HRV之间线性相关和无关的比例,进而探讨QTV对心动周期改变的依赖。利用基于信息理论的非线性信息分解方法,设RRI为驱动序列,QTI为目标序列,得到目标序列的预测信息以及反映间期内部动态和间期之间相互作用的各个指标。
1.2.1HRV和QTV相互作用模型
参照文献[25],RR(n)与QT(n)分别表示第n拍的RRI和QTI。用均值对间期序列RRI和QTI进行校正后,得到xRR(n)=RR(n)-TRR和xQT(n)=QT(n)-TQT,其中,TRR和TQT分别表示被分析时段的RRI和QTI的均值。
假设QTV和HRV相互作用模型为一开环线性模型(见图1)。其中,A11(z)、A12(z)、A22(z)和D(z)是系数分别为a11(k)、a12(k)、a22(k)和d(k)的多项式。wRR(n)和wQT(n)是两个不相关的平稳零均值白噪声序列,标准差分别为λRR和λQT。
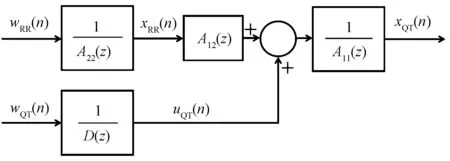
图1 QTV与HRV相互作用模型Fig.1 The model for QTV and HRV interaction
HRV由一个p阶AR平稳随机过程(ARP)表示为
(1)
QTV被认为可能取决于QTI自己的过去和RRI的过去值,由ARARXq模型表示为
(2)
因此,模型可被描述为
式中,q为所用模型的阶数。
该模型假定QTV由两个不相关的源产生:一个由HRV驱动,另一个则不依赖于HRV。计算xQT(n)的功率谱密度(PSD),记为PQT,PQT可表示为每个源在总变异性中贡献的两个部分谱之和,即
PQT=PQT|RR(f)+PQT|QT(f)
(5)
下面分别表示QTV与HRV的相关部分和不相关部分,有
式中:f表示频率,单位为Hz;TRR为平均RRI,单位为s,作为采样频率进行功率谱估计。
分析低频(low frequency,LF,0.04~0.15 Hz)和高频(high frequency,HF,0.15~0.40 Hz)段的指标,以评价不同频段的作用。
低频段和高频段QTV变化受HRV驱动部分分别表示为
(8)
(9)
考虑AR模型阶数的选择约为ARARX模型的2倍,结合文献[13],最终选取p=7,2q=8。
1.2.2信息分解
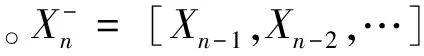
(10)
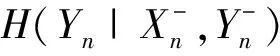
之后可将预测信息PIY分解成两部分,一部分描述驱动序列X到目标序列Y的信息传递,另一部分包含Y的信息存储有
(11)
其中
故PIY=SY+TX→Y
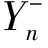
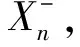
(14)
其中
故PIY=CX→Y+SY|X
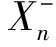
在探讨QTV对HRV的响应时,对间期序列RRI和QTI做联合分析,令RRI为驱动序列,QTI为目标序列。
1.2.3统计分析
所有指标的计算结果均采用均值±标准差的方式表示。采用配对t检验或Wilcoxon秩和检验(Wilcoxon rank sum test)比较Normal组和ESRD组各组指标的昼夜差异。Mann-Whitney U检验用于Normal组和ESRD组两组之间同时段同指标的差异对比。
统计分析采用SPSS 19.0(SPSS Inc., Chicago, USA),P<0.05时认为被检验指标间存在显著性差异。
2 结果
表1为时域和频域分析结果。由表可见,所有指标在Normal组均存在昼夜显著差异,而在ESRD组,仅RRI和QTI存在昼夜间的显著差异。关于两组间同时段的指标对比,较之于Normal组, ESRD组白天的心率显著降低,夜晚心率显著升高;同样与Normal组对比,ESRD组的QTI在白天显著升高,在夜晚则无显著差异;LFn、HFn和LF/HF这3个指标的表现相似,白天的指标两组间有显著差异,夜晚的指标两组间则不存在显著差异;白天0 V%两组间没有显著差异,但夜晚ESRD组显著升高(33.57%±16.94%vs41.78%±21.15%,P<0.05), 2UV%的情况则相反;QTV与HRV相关部分所占百分比,在LF和HF段均表现为白天显著小于夜晚;而在ESRD组,均无昼夜显著差异。两组间同时段对比时,LRLF无显著差异,而对于LRHF,Normal组的指标均小于同时段ESRD组的指标(白天:18.36%±17.38%vs39.37%±23.80%,P<0.05;夜晚: 28.63%±18.77%vs42.31%±21.97%,P<0.05)。
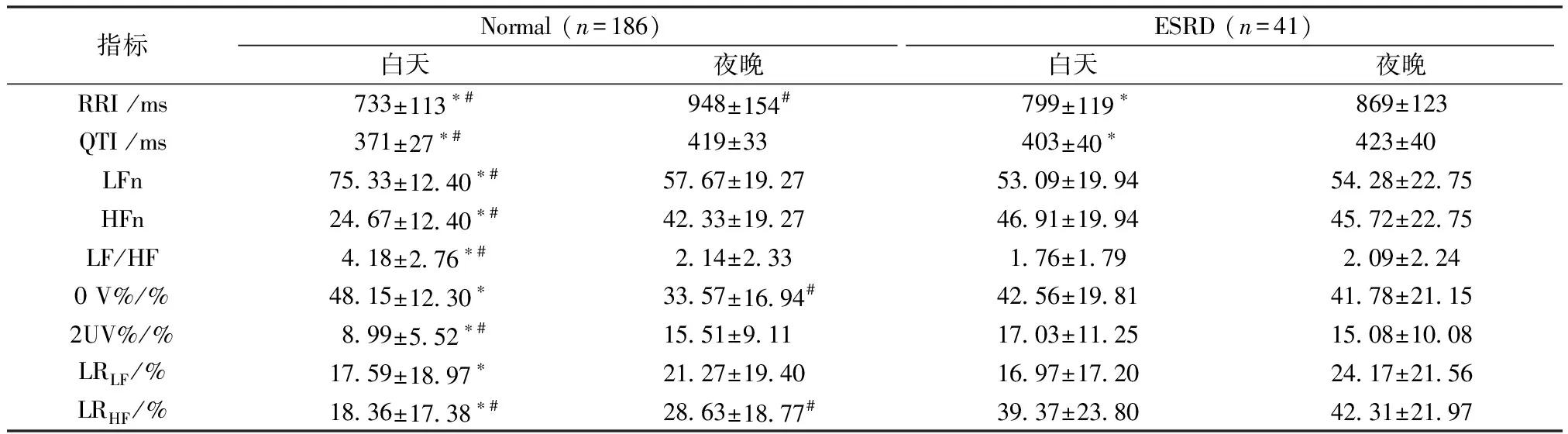
表1 Normal组和ESRD组的时域、频域及SDA指标对比分析结果Tab.1 Comparative results of time domain, frequency domain and SDA indexes in Normal and ESRD
注:*为P<0.05,白天vs夜晚;#为P<0.05,NormalvsESRD。
Note:*:P<0.05,DayvsNight;#:P<0.05,NormalvsESRD.
表2给出了以RRI为驱动序列,以QTI为目标序列的信息分解结果。Normal组中白天的PI显著小于夜晚的PI(0.222±0.142vs0.310±0.155),但在ESRD组中不存在这种昼夜间的显著差异;在两组人群同时段指标对比分析中,Normal组夜晚的PI显著大于ESRD组夜晚的PI(0.310±0.155vs0.236±0.131),而在白天两组的同指标无显著差异;构成预测信息的自熵和传递熵、交叉熵和条件自熵,无论在两组之间的对比中还是两组人群中的昼夜规律上都与预测信息的统计分析结果相同。
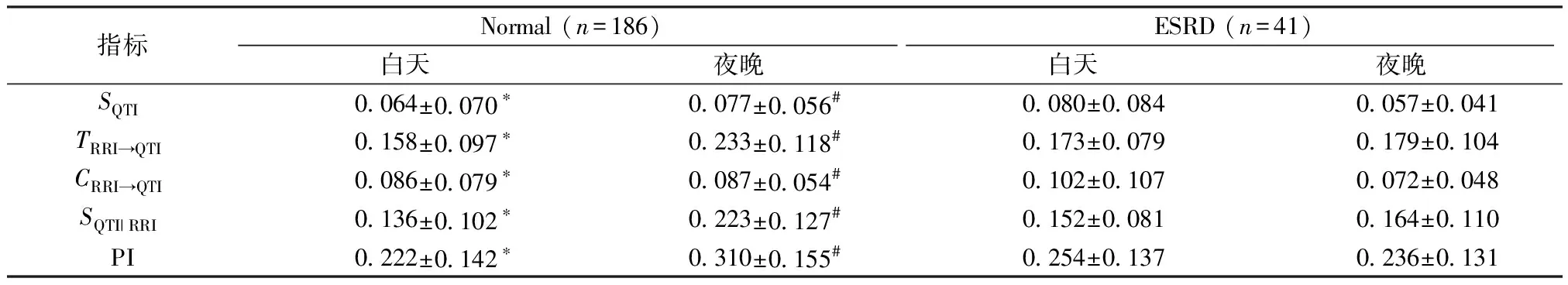
表2 Normal组和ESRD组RRI和QTI的信息分解结果
注:*为P<0.05,白天vs夜晚;#为P<0.05,NormalvsESRD。
Note:*:P<0.05,DayvsNight;#:P<0.05,NormalvsESRD.
3 讨论
本研究运用频域的线性参数模型和信息分解方法,通过对RRI和QTI序列的联合分析,量化QTV对于HRV的响应。研究发现,与正常对照组对比,高心率失常和SCD风险患者的评估指标昼夜节律消失,而且QTV与HRV的耦合性,在线性和非线性分析中呈现不同的变化行为。
以直接测量为基础的实验结果为我们提供了可靠的分析判别依据。Lee等进行心肌梗塞(MI)致自主神经病变的慢性大鼠试验[26]。观察至8周稳定期时,与假术组对照,MI组白天心率显著降低,LFn和HFn的昼夜节律消失,白天HFn显著升高,且血浆去甲肾上腺素水平显著升高。我们对于ESRD的分析结果中,心率变化和HRV指标的变化行为与该大鼠试验的相应指标一致,证明了本研究结果的可靠性。表1中ESRD组白天的HRV指标,在日间本应交感神经活动更为占优的时段,迷走神经活性占比(HFn)却在升高;而在本应迷走神经占优的夜晚,ESRD组的0 V%较Normal组明显升高,说明夜间交感神经回撤不足,这些自主神经异常行为,致使交感神经和迷走神经交互作用的消失。也正是由于交互作用的消失,导致ESRD组白天的心率较Normal组显著降低,夜晚的心率又较Normal组显著升高。Tulppo等的研究指出,当交感神经和迷走神经此消彼长的交互作用缺失,也即趋于共同兴奋状态时,易导致的心率分形特征的减弱或者消失,与心脏恶性事件的发生密切相关联[27]。
Porta用所提出的线性参数模型,以模型的拟合优度作为指标,研究在正常人直立倾斜(head-uptilt,HUT)试验中,HRV对RT间期变异性(RT variability, RTV)的驱动关系随倾斜角度的变化[16]。他们发现,随着倾斜角度增加,也即随着交感神经活性的增加,RTV与HRV相关部分减少。我们在对Normal组分析的结果中,白天QTV与HRV相关的百分比小于夜晚,鉴于Normal组白天交感神经活动较夜晚时占优,我们的结果与Porta等的结果是一致的,说明了在生理条件改变时本方法运用的可靠性。虽然QTI较RTI更独立于窦房结的调节,但调制机理是类似的。而且在我们的研究中还发现,在LF段,Normal组和ESRD组的行为一致,主要的区别在于HF段QTV与HRV线性耦合性的变化。白天异常的HFn升高和夜晚迷走神经占优时交感神经回撤不足(0 V%显著增强)均导致ESRD组自主神经交互作用的减弱或者消失,特别是使与迷走神经活性相关的HF段的参数发生改变,交感和迷走神经共同兴奋的ANS行为上的病理变化趋势,使QTV对于HRV的线性响应增加。
本研究首次将信息分解方法引入具有病理情况存在的HRV与QTV的非线性耦合分析中。信息分解的方法可用以评估QTV的信息存储和内部信息,以及从心率到QTV的信息传递和交叉信息。传递熵衡量的是从驱动序列到目标序列的信息传递,如驱动序列到目标序列不存在因果联系,则传递熵为零。本研究中,TRRI→QTI即代表与HRV相关的QTV。另一方面,条件自熵反映目标序列的内部信息,如目标序列的内部动态缺失,则条件自熵为零,意味着不受驱动序列内部动态的影响。因此,SQTI|RRI表示仅与其自身变化相关,与HRV无关,也与其它可能的影响因素无关的QTV。从表2的结果中可以看出,对于Normal组,白天交感活性相对较强,致使预测性降低。Baumert等[28]对健康受试者在直立倾斜和心算过程中发现由立位刺激和精神性刺激导致交感神经活性增强时,复极变化的变异性与心率变异性耦合性降低。我们的结果与之一致。Normal组与ESRD组的差异只体现在夜晚的指标上。虽然ESRD组白天存在着交感神经和迷走神经的共同兴奋状态,但在白天PI这一指标上Normal和ESRD组却无显著性差异,说明PI对于这一病理状态不具敏感性。而夜晚时,由于ESRD组交感活性回撤不足,导致预测性比Normal组显著降低,也证明了信息分解方法对于交感神经活性的改变更加敏感。而且可见,ESRD组夜晚QTV预测性的降低同时源自与HRV相关和无关的部分。
结合线性参数模型和信息分解结果可见,ESRD组HRV对QTV调制的病理变化,或者说导致昼夜节律消失的机制是不相同的。白天迷走神经活性的显著升高而导致的HF段QTV受HRV线性驱动的百分占比增加,直接缩小了指标间的昼夜差距;而对于以熵分析为基础的可预测性指标,夜晚交感神经的回撤不足导致QTV的非线性可预测性降低,使昼夜差异减弱或者消失。虽然目前我们尚无法知晓线性预测和非线性预测在QTV对HRV响应中各自的占比,但从中可以看出两点:一是线性预测和非线性预测对自主神经活动的敏感性不同;二是自主神经交互作用缺失,交感神经和迷走神经趋于共同兴奋的病理状态所导致的非线性可预测性减小,意味着HRV对QTV调控的复杂度有降低的趋势。ESRD组中,虽然心率和QTI仍有昼夜节律,但其他指标的昼夜节律几乎全部消失,也说明了间期变异性分析更具敏感性。
该研究数据源来自公共数据库,而数据库中并没有提供交感神经活动的直接测量指标。尽管Holter已经越来越普及,但现有公共数据库中并没有任何一个同时提供Holter数据以及自主神经的直接测量指标。过往的研究通过直接测量证实了ESRD患者的交感神经过于兴奋,而病变的肾脏对其有直接作用。Converse等的研究表明,血液透析患者中用微小神经照相术评估的肌肉交感神经活动(muscle sympathetic nerve activity,MSNA)增加[29]。心脏交感神经活动的直接测量指标显示高血压和糖尿病与心脏和血管交感神经活性的增加以及心律失常风险的增加有关[30-32]。此外,Grassi等还发现,稳定的中度慢性肾功能衰竭和高血压患者的MSNA值明显高于单纯高血压患者,表明肾功能衰竭和高血压的双重影响将导致更高的心律失常风险[33]。因此,THEW中提供的ESRD作为与自主神经功能正常组进行对照的病理组是合理的。其次,因为严格的入选标准和排除标准,ESRD子数据库中包含的个体数还是相对较少的,但正是这些严格的标准保证了入选个体的自主神经功能异常程度是几近相同的,且他们都没有经历过严重的心律失常。这类人群恰是最需要进行心脏安全评估的群体。
4 结论
本研究利用从Holter心电图中提取的短时间期时间序列数据,从线性和非线性分析这两个角度,采用频域分析和信息分解方法,研究高心律失常和SCD风险人群中,QTV对于HRV响应行为的改变。研究结果反映出以频域的线性参数模型所衡量的QTV受HRV线性驱动百分占比的增加,以及以熵分析为基础的非线性可预测性减小。线性参数模型和基于信息分解的非线性预测对自主神经活动的敏感性不同;高心律失常和SCD风险人群中HRV对QTV的调控呈复杂度降低的特点。
